细胞因子信号转导负调控蛋白2在变应性鼻炎中的表达及临床意义
2019-12-26刘海涛
刘海涛 罗 庆 范 立 杨 甜
1.南昌大学第一附属医院耳鼻喉头颈外科,江西南昌 330006;2.江西卫生职业学院五官教研室,江西南昌 330052
变应性鼻炎(AR)是一种以变应原激发、IgE 介导、T 辅助细胞(Th)2 反应为主的慢性鼻部疾病[1]。主要分类是Th1、Th2 细胞和调节性T 细胞(Treg)[2]。Th1细胞分泌γ 干扰素(IFN-γ)和白细胞介素(IL)-2 等细胞因子,Th2 细胞分泌IL-4、IL-5、IL-10 和IL-13。在这些细胞因子中,Treg 细胞调节Th1/Th2 平衡起关键作用[3-4]。细胞因子信号转导负调控蛋白(SOCS)2 是SOCS 家族中的重要成员[5-6]。Knosp 等[7]研究证明,SOCS2 基因敲除小鼠对Th2 介导的气道炎症的易感性增加。本研究初步观察SOCS2 在AR 组织中的表达情况及与炎性因子的关系。
1 材料与方法
1.1 标本来源与分组
AR 组选取南昌大学第一附属医院2018 年2~7 月行鼻中隔偏曲或翼管神经切断术的AR 患者20 例,男11 例,女9 例,年龄20~69 岁。对照组鼻中隔偏曲且无其他鼻科疾病的患者15 例,男8 例,女7 例,年龄18~65 岁。取下鼻甲前端鼻黏膜剪成两份,一份置于4%多聚甲醛固定;另一份放入含有Trizol 的离心管内,转移到冰箱中保存。
1.2 试剂与材料
SOCS2 兔抗人多克隆抗体(bs-1896R)购于北京博奥森有限公司。Trizol 购于Invitrogen 公司。通用型试剂盒(小鼠/兔聚合物法检测系统pv-6000)、正常山羊血清(ZLI-9022)、二氨基联苯胺(DAB)试剂盒(ZLI-9017)购于北京中衫金桥有限公司。
1.3 免疫组化法检测SOCS2 表达
标本置于4%多聚甲醛中固定24 h、常规石蜡包埋,脱蜡,修复抗原,去除内源性过氧化物酶,用正常山羊血清封闭,滴加一抗SOCS2(1∶300),4℃过夜,PBS 冲洗3 次,加辣根酶标记抗山羊IgG 室温孵育1 h,显色剂显色,树胶封片。阴性组以封闭液替代一抗。将图像输入Image-pro Plus 6.0 专业图像分析软件,计算平均吸光度值。
1.4 SOCS2 mRNA 及T 细胞因子mRNA 表达
引物合成:在GenBank 查找人类SOCS2、IFN-γ、IL-4、IL-5、IL-13、FOXP3 序列,引物设计和检测采用Primer 5.0 软件。引物由华大基因有限公司合成。引物序列如下,SOCS2:5'-ACGCGAACCCTTCTCTGACC-3',5'-CATTCCCGGAGGGCTCAAGG-3';IFN-γ:5'-AGTGATGGCTGAACTGTCGC-3',5'-CTGGGATGCTCTTCGACCTC-3';IL-4:5'-GTGCACCGAGTTGACCGTAA-3',5'-GCGAGTGTCCTTCTCATGGT-3';IL-5:5'-GGATGCTTCTGCATTTGAGTTT-3',5'-CAGTGCCAAGGTCTCTTTCA-3';IL-13:5'-CTGCAATGGCAGCATGGTAT-3',5'-TCAGCATCCTCTGGGTCTTC-3';FOXP3:5'-GAAACAGCACATTCCCAGAGTTC-3',5'-ATGGCCCAGCGGATGAG-3';GAPDH:5'-AAATCAAGTGGGGCGATGCT -3',5'-CAAATGAGCCCCA -GCCTTCT-3'。用Trizol 试剂从鼻组织中提取总RNA。用寡聚体(dT)18 引物和M-MLV 逆转录酶(TaKaRa Bio Inc)从2 μg 总RNA 中合成cDNA。用ABI PRISM 7600检测系统(美国加州福斯特市生物系统)和SYBR 预混Taq(TaKaRa Bio Inc)进行实时定量聚合酶链反应(qRT-PCR)。计算样本复制物的循环阈值(Ct)。计算靶基因mRNA水平的倍数变化为2-ΔΔCt。qPCR 仪(StepOneTMReal-Time PCR System)进行mRNA 定量检测,反应条件如下:95℃变性30 s;95℃,15 s;60℃,1 min 退火、延伸,共40 个循环。
1.5 AR 患者视觉模拟评分(VAS)
评价六大症状(喷嚏、流涕、鼻痒、鼻塞、眼痒和流泪)。方法:患者在标尺上标出各种症状相应分值,“0”代表无此种症状,“10”代表此种症状最重,统计VAS总分[8-9]。
1.6 统计学方法
采用SPSS 22.0 和GraphPad Prism 6 进行统计学分析。符合正态分布的计量资料用均数±标准差()表示,采用t 检验,不符合正态分布的计量资料用中位数(四分位数间距)[M(Q)]表示,采用Mann-Whitney U 检验;计数资料采用χ2检验;确定变量线性关系采用Pearson 相关检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 AR 组与对照组的SOCS2 免疫组化表达及平均吸光度值比较
SOCS2 在AR 组和对照组中均有免疫组化表达。AR 组SOCS2 平均吸光度值显著低于对照组,差异有统计学意义(P <0.05)。见图1(封四)。
2.2 AR 组与对照组SOCS2 和细胞因子的相对表达量比较
qRT-PCR 显示,AR 组的SOCS2、IFN-γ 和FOXP3相对表达量显著低于对照组,IL-5、IL-13、IL-4 相对表达量显著高于对照组,差异有统计学意义(P <0.05)。见图2。
2.3 AR 患者SOCS2 与细胞因子和VAS 总分的相关性
AR 患者SOCS2 相对表达与IL-4、IL-5、IL-13、VAS 总分相对表达呈负相关(r=-0.66、-0.50、-0.51、-0.65,P <0.05),与FOXP3 相对表达呈正相关(r=0.67,P <0.05),与IFN-γ 相对表达无相关性(r=0.39,P >0.05)。见图3。
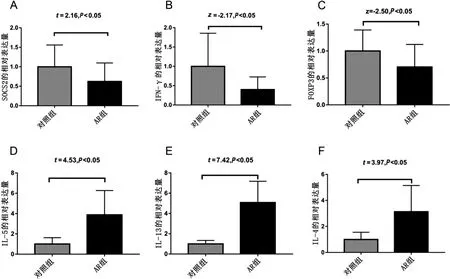
图2 AR 组与对照组SOCS2 和细胞因子的相对表达量比较

图3 AR 患者SOCS2 与细胞因子和VAS 总分的相关性
3 讨论
AR 的发病机制为环境中刺激因子作用于具有遗传背景的个体,引起T、B 淋巴细胞免疫功能紊乱,主要表现为Th2 的优势活化[10-13]。研究证实[14],SOCS2 参与Th 细胞平衡调节,抑制Th2 细胞分化和发育,对Treg 稳定有重要作用[15-16]。
本研究显示,AR 组SOCS2 免疫组化表达和平均吸光度值均较对照组降低。SOCS2 优先在天然调节性T 细胞和诱导的Treg 中表达[9,17]。SOCS2 对维持iTreg的抗炎功能是必需的,可将SOCS2 作为Th2 型偏移疾病的一个潜在的治疗靶点[18]。
本研究结果显示,AR 组的SOCS2、IFN-γ 和FOXP3相对表达量显著低于对照组,IL-5、IL-13、IL-4 相对表达量显著高于对照组,与国内外相关研究结果相符[18-19]。临床中常用VAS 来评估AR 症状的严重程度[20]。本研究发现,SOCS2 可作为临床上评估AR 病情的一个参考指标。
综上所述,SOCS2 在AR 组织中表达降低与多种因子相关,在AR 的发病机制中起重要作用。后期还将进一步研究细胞因子在AR 中的免疫功能和发病机制。
