驴源沙门氏菌的分离鉴定、耐药及毒力分析
2019-12-24孙阳阳杨美解晓莉程凯慧张亮楚会萌任亚初杨宏军
孙阳阳 杨美 解晓莉 程凯慧 张亮 楚会萌 任亚初 杨宏军

摘要:沙门氏菌是一种常见的食源性人畜共患肠道致病菌,兼性胞内致病菌。山东省某养驴场频发流产现象且无明显征兆,本研究对驴流产胎儿内脏及头部感染细菌进行分离,并对分离株进行鉴定及耐药、毒力分析。结果表明,获得的7株分离株均为沙门氏菌,分别命名为SL1-SL7,其中SL1、SL2、SL3、SL5、SL6与鼠伤寒沙门氏菌的同源性分别为100%、99.93%、99.93%、99.79%、99.57%;SL4与爱丁堡沙门氏菌、汤姆逊沙门氏菌的同源性均为99.79%;SL7与阿邦尼沙门氏菌、爱丁堡沙门氏菌、汤姆逊沙门氏菌同源性分别为99.72%、99.72%、99.65%;耐药表型结果显示7株沙门氏菌对本试验中所有药物均比较敏感;毒力基因筛选结果显示,除SL1、SL2、SL3、SL7 毒力岛SPI-4上的ssb毒力基因未检出外,7株分离菌均具有沙门氏菌典型毒力基因;7株沙门氏菌对小鼠的致病性较弱,小鼠喂食菌液后未出现死亡现象。
关键词:沙门氏菌;驴;分离鉴定;耐药分析;毒力基因
中图分类号:S858.22 文献标识号:A 文章编号:1001-4942(2019)11-0143-06
Isolation, Identification, Drug Resistance and
Virulence Analysis of Salmonella from Donkey
Sun Yangyang, Yang Mei, Xie Xiaoli, Cheng Kaihui,
Zhang Liang, Chu Huimeng, Ren Yachu, Yang Hongjun
(Dairy Cattle Research Center, Shandong Academy of Agricultural Sciences, Jinan 250131, China)
Abstract Salmonella is a common foodborne zoonotic enteric pathogen and facultative intracellular pathogen. There was no obvious sign of frequent abortion in a donkey factory in Shandong Province. In this study, the infection bacteria in viscera and head were isolated, and identifying the isolates and analyzing their drug resistance and virulence. The results showed that all the 7 isolates identified were Salmonella and named as SL1-SL7. The homology rates of SL1, SL2, SL3, SL5 and SL6 with Salmonella typhimurium were 100%, 99.93%, 99.93%, 99.79% and 99.57%, respectively. The homology rates of SL4 with Salmonella edinburgh and Salmonella thomson were 99.79%. The homology rates of SL7 with Salmonella arbonini, Salmonella edinburgh and Salmonella thomson were 99.72%, 99.72% and 99.65%, respectively. The results of drug-resistant phenotype showed that 7 strains of Salmonella were sensitive to all the drugs in this study. The results of virulence gene screening showed that all the 7 isolates had typical virulence genes of Salmonella except the ssb virulence genes on SPI-4 of SL1, SL2, SL3 and SL7 virulence islands. The 7 strains of Salmonella were less pathogenic to mice, and the mice did not die after feeding the bacteria solution.
Keywords Salmonella; Donkey; Separation and identification; Resistance analysis; Virulence gene
沙門氏菌(Salmonella enteriditis,SE)属肠杆菌科 (Enterobacteriaceae),革兰氏阴性肠道杆菌,兼性胞内致病菌,是一种常见的食源性人畜共患肠道致病菌,其中畜禽感染非常普遍,主要引起发热、腹泻、败血症、胃肠炎和脑膜炎等症状[1, 2],造成怀孕母畜发生流产,严重时还可导致死亡,对人和动物的健康威胁巨大。因此,沙门氏菌的检测和预防治疗在医学、兽医学和公共卫生方面都有十分重要的意义。猪、鸡等动物沙门氏菌病较为常见,而关于马属动物特别是驴的沙门菌病国内鲜少报道。冯培祥等[3]从流产胎儿中分离到沙门菌,确定是引起驴流产的致病菌。本研究通过剖检采集到的驴流产胎儿样本的组织及器官,并对从中分离出的细菌进行分离鉴定,确定为沙门氏菌,通过对其进行耐药性分析为该病在临床上的用药选择提供了依据,毒力基因的筛选为沙门氏菌侵袭机体的机制研究,尤其是如何突破血-脑屏障进入机体脑部的机制研究奠定了基础。
1 材料与方法
1.1 样品采集
样品:从山东省某养驴场采集6例流产驴胎儿(包括胎盘等流产物),对流产胎儿进行剖检,取其心、肝、脾、肺、肾及脑部等器官,进行细菌分离培养检测。
大肠埃希菌(Escherichia coli)ATCC25922质控菌株,购于海博生物技术有限公司。
1.2 试验试剂
药敏片:头孢他啶(CAZ)、头孢噻肟(CAZ)、亚胺培南(IPM)、头孢西丁(FOX)、美罗培南(MEM)、奥格门汀(ACA)、头孢曲松(CRO)、头孢呋辛(CXM)、头孢唑林(CFZ) 、哌拉西林(PIP)、氨苄西林(AMP)、氨曲南(ATM)、诺氟沙星(NOR)、恩诺沙星(ENR)、环丙沙星(CIP)、阿米卡星(AMK)、庆大霉素(GEN)、卡那霉素(KAN)、四环素(TE)、磺胺异噁唑(G)、甲氧苄氨嘧啶(W)、呋喃妥因(FM)、氯霉素(C)、多黏菌素B(PB),均购于杭州微生物试剂有限公司。
试剂:普通营养肉汤,XLT4培养基,M-H琼脂,普通营养琼脂,沙门氏菌微量生化鉴定管,麦氏比浊管,脱纤维羊血,均为海博生物技术有限公司产品;显色培养基,为法国科马嘉(Chromagar)公司产品;2×Taq Master Mix,DL1000 Marker,为宝日医(Takara)生物技术有限公司产品;EasyPure Bacteria Genomic DNA Kit,为北京全式金(TransGen Biotech)生物技术有限公司产品;引物合成均由华大基因股份有限公司完成。
培养基配制:普通营养肉汤、沙门氏菌显色培养基、XLT4培养基、M-H琼脂、普通营养琼脂培养基按照产品说明书进行操作;血琼脂板配制时需在完成普通营养琼脂配制后高压灭菌冷却至50℃左右加入5%的脱纤维羊血,混匀后倒入无菌平板。
试验动物:6~8周龄昆明鼠,购于山东大学实验动物中心。
1.3 试验方法
1.3.1 菌株分离、纯化
将采集的流产胎儿置于超净台内进行剖检,无菌操作取其心、肝、脾、肺、腎以及胎盘,将以上组织器官剪碎后取少量接种至沙门氏菌显色板、营养琼脂板中,37℃培养箱中培养18~24 h,挑取可疑菌落,分四区划线于XLT4平板、沙门氏菌显色板以及琼脂培养基中,37℃培养箱中培养18~24 h,挑取单菌落,接种于普通肉汤培养基中,37℃摇床过夜孵育增菌,菌液中加入20%无菌甘油,分装保存于-20℃ 冰箱中;需长期保存的菌种,将增菌液分装后按照1∶[KG-*2/3]1比例加入冻干保护剂,置于冻干机中冻干,密封后放置于-20℃冰箱中储存。
1.3.2 分离菌鉴定
(1) 镜检:挑取单菌落,通过革兰氏染色,显微镜下观察细菌的革兰氏属性以及细菌的形态、大小。
(2) 16S rDNA鉴定:取分离株肉汤菌液,送华大基因股份有限公司进行16S rDNA测序,利用NCBI的Blast功能得出与其同源性较近的菌株。
(3)PCR鉴定:采用引物F:5′-CTTTGGTCGTAAAATAAGGCG-3′、R:5′-TGCCCAAAGCAGAGAGATTC-3′[4]扩增沙门氏菌的保守型特异性基因stn。利用细菌DNA提取试剂盒(EasyPure Bacteria Genomic DNA Kit)提取纯化后的分离菌菌液DNA(具体操作步骤可参考试剂盒说明书),PCR反应体系:Master Mix 12.5 μL,10 μmol/L的上下游引物各1 μL,DNA模板2 μL,加入灭菌水配制成25 μL体系;PCR反应程序:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,共35个循环;72℃ 10 min。产物经1%琼脂糖凝胶电泳进行检测,并在凝胶成像系统上观察、拍照。
1.3.3 耐药表型检测
通过Kirby-Bauer法(纸片琼脂扩散法),以E. coli(ATCC25922)为质控菌株,检测7株分离菌对8类24种抗生素的药物敏感性。将分离纯化的单菌落接种于营养肉汤培养基中,37℃振荡孵育6 h,取出后调整浓度至0.5麦氏浊度;用无菌棉棒将配制好的菌悬液均匀涂布于M-H琼脂培养基上,15 min内将药敏片贴于培养基表面,每一皿中最多贴4个药敏纸片,将贴好药敏片的培养皿15 min内置于37℃培养箱中培养18~24 h,取出后用游标卡尺测量抑菌圈直径。
1.3.4 毒力基因检测
查阅文献,选取不同毒力岛上代表性的毒力基因(SPI-1:invA、sipA;SPI-2:sseA、ttrA;SPI-3:mgtCB;SPI-4:ssb、soxSR;SPI-5:sopB、sigD;菌毛基因:fimW),从GenBank中查阅收录的毒力基因序列,通过Primer Premier 5软件分别设计10对引物,以试剂盒提取的7株细菌的DNA为模板,进行细菌毒力基因的PCR扩增,引物序列及PCR反应条件见表1。PCR反应体系同特异性基因stn。
通过细菌DNA琼脂糖凝胶回收试剂盒,回收7株分离菌中检出条带,送华大基因股份有限公司测序。
1.3.5 小鼠致病性试验
复活分离菌,划线接种于普通琼脂培养基上,培养24 h后,挑取单菌落,接种于营养肉汤,37℃摇床过夜孵育,用PBS培养基将菌液稀释为0.5麦氏浊度(约1×108 cfu/mL)。将小鼠分为9组,其中1个空白对照组,1个阴性对照组,7个试验组,每组5只小鼠,空白对照组不喂食菌液,阴性对照组喂食0.4 mL PBS,试验组分别喂食7株分离菌悬液0.4 mL。记录接种后两周内小鼠临床表现,如有小鼠死亡,解剖观察内脏状态并检测内脏染菌情况。
2 结果与分析
2.1 分离菌鉴定结果
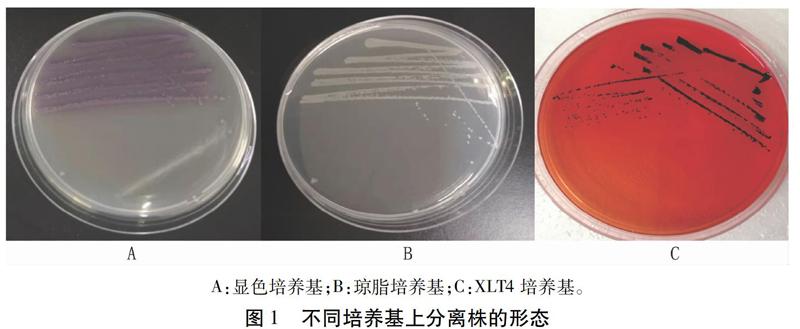
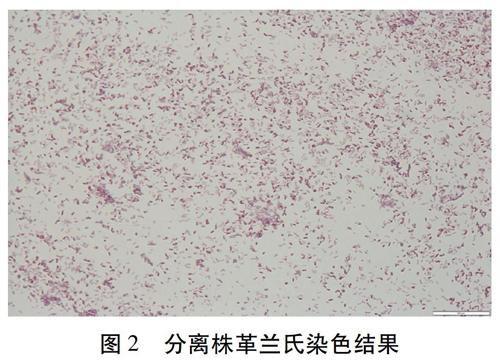
从肺中分离出6株菌,脑中分离出1株菌,分别命名为SL1(肺)、SL2(肺)、SL3(肺)、SL4(脑)、SL5(肺)、SL6(肺)、SL7(肺)。培养基鉴定结果(图1)显示,显色培养基上呈现紫色、边缘整齐、湿润的露滴样菌落;琼脂培养基上显示灰白色、圆形、边缘整齐的菌落;XLT4培养基上出现中心黑色、圆形边缘锯齿状的菌落。不同培养基上出现的菌落形态均符合沙门氏菌特性。革兰氏染色结果表明,细菌无荚膜,无芽孢,为均匀散布的革兰氏阴性短杆菌(图2)。
16S rDNA测序结果与GenBank中登录序列进行Blast比对,SL1、SL2、SL3、SL5、SL6与鼠伤寒沙门氏菌(S. typhimurium)的同源性分别为100%、99.93%、99.93%、99.79%、99.57%;SL4与爱丁堡沙门氏菌(S. edinburg)、汤姆逊沙门氏菌(S. thomoson)的同源性均为99.79%;SL7与阿邦尼沙门氏菌(S. abony)、S. edinburg、S. thomoson同源性分别为99.72%、99.72%、99.65%。PCR鉴定结果中均检测到沙门氏菌特异性基因stn(图3)。综合培养基鉴定结果、16S rDNA及PCR鉴定结果可确定分离菌为沙门氏菌。
2.2 耐药性检测结果
耐药表型结果(表2)显示7株驴源沙门氏菌对所有药物均较为敏感,包括β内酰胺酶类、呋喃类、喹诺酮类、磺胺类、氨基糖苷类、四环素类、氯霉素类及多肽类,说明牧场未给驴大量使用抗生素治疗,若及时检出,沙门氏菌病相对容易治愈。
2.3 毒力基因筛选
如图4所示,除SL1、SL2、SL3、SL7 毒力岛SPI-4上的ssb毒力基因未检出外,7株分离菌均具有沙门氏菌典型毒力基因。虽然ssb未检出,但SPI-4上除ssb具有参与调控沙门氏菌在宿主细胞内环境中适应、存活的作用,soxSR也具有该功能,因此ssb的缺失对沙门氏菌的毒力影响不大。
2.4 小鼠致病性结果
7 d后试验组小鼠出現不同程度的腹泻现象,对照组未有任何异常,10~14 d后试验组小鼠腹泻现象减轻,基本自愈,并无死亡现象发生。该沙门氏菌致病性较弱,自身的免疫能力可以将其控制,但因沙门氏菌为胞内寄生菌,可潜伏于体内,因此并不能够确定沙门氏菌被完全清除。
3 讨论与结论
目前发现沙门氏菌有2 500多种血清型,绝大多数血清型能在人和动物间交叉感染[5]。本试验中分离株SL1、SL2、SL3、SL5、SL6可确定为鼠伤寒沙门氏菌,SL4与爱丁堡沙门氏菌、汤姆逊沙门氏菌同源性更近,SL7与阿邦尼沙门氏菌、爱丁堡沙门氏菌同源性较近。爱丁堡沙门氏菌是一种极为罕见的沙门氏菌血清型,汤姆逊沙门氏菌是鸡养殖中常被感染的一种血清型,而阿邦尼沙门氏菌细菌毒性较强,可引起类似于伤寒沙门氏菌的症状[6-8]。本试验中发生流产的母驴未出现明显的不适症状,由此可以看出沙门氏菌在不同动物体内的寄生作用可能不同,在驴体内寄生未引起肠道症状,但对胎儿影响较大,可对牧场造成巨大损失。但本试验中分离株的耐药性并不强,几乎对所有药物均较为敏感,说明牧场并未大量用药,如染菌情况发现及时,可避免不必要的经济损失。
SPI-1编码的Ⅲ型分泌系统与细菌的侵袭力有关,inv、sip只是其编码的较为典型的基因;SPI-2在鼠伤寒沙门氏菌中很稳定,不易缺失,与沙门氏菌的全身性感染无关,但与沙门氏菌在细胞内存活及扩散有关,可以辅助沙门氏菌逃避巨噬细胞的杀伤作用;SPI-3的典型毒力基因是mgtCB,其主要介导沙门氏菌在宿主巨噬细胞和低Mg2+环境中的存活;ssb和soxSR分别位于SPI-4的上下游,主要负责编码与介导毒素分泌的Ⅰ型分泌系统类似的蛋白,并参与调控沙门氏菌在宿主巨噬细胞内环境中的适应、存活,因此ssb未表达并不一定影响SPI-4功能;SPI-5编码参与肠黏膜液体分泌和炎症反应的相关蛋白,但不参与全身性感染,sopB、sigD的表达与细胞炎性因子的分泌相关[9-12];fimW是Ⅰ型菌毛基因簇成员,Ⅰ型菌毛基因簇的表达受蛋白 FimW、FimY、FimZ以及imU编码的tRNA调控,由7个基因组成 (fimAICDHF),作用于多种细胞表面特异的α-D-mannose受体,有利于细菌的吸附[13],张成栋[14]研究证实Ⅰ型菌毛特异性介导鼠伤寒沙门氏菌粘附上皮细胞和骨髓源树突状细胞,灌胃感染小鼠表明,I 型菌毛能明显降低鼠伤寒沙门氏菌的毒力,而尾静脉侵袭小鼠发现结果恰好相反,并且细菌在体内扩散途径也相反。
虽然本试验得到的分离株毒力基因均被检出,但在小鼠致病性试验中发现其致病性并不强,可得出沙门氏菌的毒力基因与致病性强弱并无必然联系。有文献报道[15],沙门氏菌的耐药性与毒力有一定联系,因此,其耐药性、毒性以及致病性之间的关系需进一步研究。
另外从胎驴脑部可分离到沙门氏菌,该沙门氏菌如何通过血脑屏障进入脑部、哪些毒力基因在起作用以及作用机制等问题都需要进一步深入研究。
参 考 文 献:
[1]贾爱卿. 猪沙门氏菌的临床分离鉴定及耐药性消除研究[D]. 武汉:华中农业大学, 2006.
[2]赵蕊. 非伤寒沙门氏菌脑膜炎[J]. 传染病信息, 1995(2):67-68.
[3]冯培祥, 杨莉, 赵付伟, 等. 驴沙门菌的分离鉴定及药敏试验[J]. 中国兽医杂志, 2018, 54(8):81-84.
[4]田雅楠. 不同源肠炎沙门菌耐药表型与耐药基因型分析[D]. 扬州:扬州大学, 2017.
[5]刘新静. 河北省鸡沙门氏菌的分离鉴定及耐药性分析[D]. 泰安:山东农业大学, 2015.
[6]Lavy C B, Lavy V R, Anderson I. Salmonella septic arthritis of the shoulder in Zambian children[J]. Journal of the Royal College of Surgeons of Edinburgh, 1996, 41(3):197-199.
[7]Lalonde R G. Salmonella thomson outbreak in a Canadian newborn nursery[J]. Canadian Journal of Infectious Diseases, 1993, 4(4): 209-212.
[8]Kauffmann F. Untersuchungen über s. abortus bovis, s. sch-leissheim sowie zwei neue salmonella‐typen s. abony und s. tel-aviv.[J]. Acta Pathologica Et Microbiologica Scandinavica, 2009, 17(1):1-8.
[9]Golubeva Y A, Ellermeier J R, Cott J C, et al. Intestinal long-chain fatty acids act as a direct signal to modulate expression of the Salmonella pathogenicity island 1 type III secretion system[J]. Mbio., 2016, 7(1):e02170-15.
[10]Yin J L, Chen Y, Xie X L, et al. Influence of Salmonella enterica serovar pullorum pathogenicity island 2 on type Ⅲ secretion system effector gene expression in chicken macrophage HD11 cells[J]. Avian Pathology, 2017, 46(2):209-214.
[11]Amavisit P, Lightfoot D, Browning G F, et al. Variation between pathogenic serovars within Salmonella pathogenicity islands[J]. Journal of Bacteriology, 2003, 185(12): 3624-3635.
[12]Figueroa Ochoa I M, Verdugo Rodríguez A. Molecular mechanism for pathogenicity of Salmonella spv[J]. Rev. Latinoam. Microbiol., 2005, 47(1/2): 25-42.
[13]Saini S, Pearl J A, Rao C V. Role of FimW, FimY, and FimZ in regulating the expression of type Ⅰ fimbriae in Salmonella enterica serovar typhimurium[J]. Journal of Bacteriology, 2009, 191(9): 3003-3010.
[14]張成栋. Ⅰ型菌毛介导鼠伤寒沙门氏菌对小鼠的毒力及对抗原递呈细胞侵袭力的研究[D]. 武汉:华中农业大学, 2009.
[15]Foley S L, Lynne A M. Food animal-associated Salmonella challenges: pathogenicity and antimicrobial resistance[J]. J. Anim. Sci., 2008, 86(14): 173-187.
收稿日期:2019-07-08
基金项目:“十三五”国家重点研发计划项目“牛羊重要疫病诊断与检测新技术研究”(2016YFD0500900);现代农业(奶牛)产业技术体系科学家岗位项目(CARS-36);山东省农业科学院农业科技创新工程项目“主要畜禽疫病监测和预警”(CXGC2016A10)
作者简介:孙阳阳(1989—),女,山东淄博人,硕士,助理研究员,研究方向:分子生物学。E-mail:13688639022@163.com
通讯作者:杨宏军,男,山东济宁人,博士,研究员,研究方向:分子生物学。E-mail:longfei1997@sina.com
