AM真菌对箭筈豌豆响应豌豆蚜取食的影响
2019-12-20张伟珍段廷玉
张伟珍, 段廷玉
(兰州大学草地农业科技学院/兰州大学草地农业生态系统国家重点实验室/兰州大学农业农村部草牧业创新重点实验室,甘肃 兰州 730020)
豌豆蚜(Acyrthosiphonpisum)又称豆蚜,是半翅目蚜科昆虫[1]。该类昆虫在世界各地分布十分广泛,可危害包括豌豆(Pisumsativum)、苜蓿(Medicagosativa)、三叶草(Trifoliumsubterraneum)等在内的多种豆科作物及牧草,是豆科作物种植及牧草栽培的主要害虫之一[2]。豌豆蚜多聚集在豆科植物的的嫩茎、嫩叶及幼芽等部位,以其刺吸式口器刺穿植物表皮吸取汁液,造成植株体内营养流失,叶片卷缩、凋零,花蕾变黄脱落,严重时田间植株成片枯死,造成重大产量损失[3-4]。此外,豌豆蚜取食植物还可以传播多种植物病毒,是三叶草、苜蓿等植物病毒病的主要传播媒介之一[5]。
箭筈豌豆(Viciasativa)是双子叶植物纲蔷薇目豆科野豌豆属植物,一年生或越年生[6]。箭筈豌豆具有早发、速生、早熟、产种量高而稳定等优点,且其营养物质含量丰富,茎叶含粗蛋白22.81%、有机物含量81.56%,含氮2.30%、含磷0.20%、含钾1.58%,是一种优良牧草[7]。近年来绿肥产业兴起,箭筈豌豆作为西北干旱地区的一种重要的豆科绿肥作物,可与小麦、燕麦等进行轮作、套作或混播,对增加土壤有机质,改善土壤结构,提高土壤肥力具有重要作用[8-9]。虫害是牧草产业中除病害外另一个极其重要的限制因子,据调查,虫害不仅会导致牧草生长发育不良,严重的还会出现坏死斑点甚至全株死亡,降低牧草的适口性,严重影响家畜取食;同时,虫害还会引起牧草产量下降,营养价值降低,制约牧草生产,引起重大经济损失[10]。豌豆蚜是箭筈豌豆上的一种重要害虫,在甘肃夏河的箭筈豌豆栽培区中发生面积较广、虫口密度较大,且因其天敌数量少,极易造成虫害发生蔓延,应及早采取防治措施,以免对箭筈豌豆种植业造成损失。
丛枝菌根(arbuscular mycorrhizal,AM)真菌是球囊菌门(Glomeromycota)真菌,广泛存在于自然界中[11]。AM真菌、昆虫同时作用于植物体,可形成AM真菌-植物-昆虫互作体系[12-13]。已有相关研究发现,AM真菌可通过调控植物的生长、生理生化代谢以及基因表达等,进而调控植物与昆虫的互作效应[14-15]。一些球囊霉属的真菌可以诱导植物产生大量挥发性化合物,主要是萜烯类、醇类、酯类和少量烷烃类物质,通常这类物质是作为植物-昆虫营养关系中信息传递的媒介,可以影响到昆虫的取食偏好及种群动态[16]。AM真菌侵染植物后产生的毒性代谢物,如E-2-己烯-1-醇、芳樟醇、苯甲醛、香芹酚等,这些物质对害虫具有抑制或毒杀效果,可以保护植物,减少昆虫取食,提高植物抗虫性[17-18];另外AM真菌也可通过强大的菌丝网络在邻近植株间传递抗虫防御信号[19-20],因此在害虫防治方面应用前景十分广泛。本研究选用箭筈豌豆作为宿主植物,研究AM真菌对豌豆蚜生长、植株代谢的影响,以期为利用AM真菌减少豌豆蚜对箭筈豌豆的危害、促进其天敌和有益昆虫的发生、增创生态系统效益提供理论及技术参考。
1 材料与方法
1.1 试验材料
1.1.1供试植物 兰箭3号春箭筈豌豆(Viciasativacv. Lanjian No.3)。
1.1.2供试昆虫 豌豆蚜(Acyrthosiphonpisum),采集自兰州大学榆中苜蓿试验田,形态学鉴定,以豌豆幼苗作为寄主,于光照培养箱(每天光照时间为14 h,黑暗时间为10 h;温度为20±1℃;湿度为60% RH)中培养,用得到的2龄若蚜作为接种昆虫。
1.1.3供试土壤 试验用土由两部分组成,黑土和沙土,购自兰州花市。所有基质过2 mm筛,121℃高压灭菌两次,每次灭菌1 h,间隔24 h。再将黑土∶沙土以1∶3的比例混合。混合土壤基质全N为16.21 mg·kg-1,全P为17.18 mg·kg-1,pH为7.3。
1.1.4供试菌剂 供试AM真菌菌剂为扭形球囊霉(Glomustortuosum)。购买于北京市农林科学研究院植物营养与资源研究所,中国丛枝菌根真菌菌种资源保藏中心,宿主植物为三叶草(Trifoliumsubterraneum)。
1.2 试验设计
盆栽试验于2018年8月-10月在兰州大学榆中校区草地农业科技学院智能温室进行。2种AM真菌接菌处理:接菌(AM)与不接菌(NM)。3种接虫处理:接蚜虫(H+)、不接蚜虫(H-)和针刺模拟昆虫取食(M)。设置针刺模拟昆虫取食的处理,旨在避免因蚜虫过早死亡造成蚜虫取食频率较低,未对植株造成明显伤害,从而导致试验结果不明显。总共2×3=6种处理,每处理5盆,共30盆,各处理随机摆放。
AM真菌接种方法:需要接菌的处理,接种量为每盆100 g,接种菌剂为含有孢子、菌丝的土壤及其寄主植物的根段混合物。接种采用层播的方式,先称取1 000 g土壤基质加入花盆,再准确称取100 g菌剂,将其均匀平铺于花盆中的土壤上,然后再称400 g土壤基质,将其均匀地撒在菌剂上层。不接AM真菌的处理则用等量灭菌土壤基质代替AM真菌菌剂。用于接种的AM菌剂为用三叶草扩繁所得的孢子、菌根根段、根外菌丝及培养基质,每克菌剂含有>100个孢子。
催芽及播种:挑选大小一致、籽粒饱满、健康无病虫害的箭筈豌豆种子,将其置于10%的H2O2中浸泡5 min进行表面消毒,然后倾去H2O2,用无菌水对种子进行清洗,重复3遍即可。用灭菌镊子将种子均匀摆放于铺设了灭菌滤纸的培养皿中,置于25℃培养箱催芽培养。待芽长至1~2 mm即可播种,每盆6株,播种深度为1~2 cm。
蚜虫接种方法:在箭筈豌豆植株生长6周时进行接虫处理,用毛笔小心粘取蚜虫,将其移至箭筈豌豆叶片上,每盆接种10只。针刺模拟处理则在每盆植株随机选取10个叶片,用用昆虫针在植物叶片上进行针刺,造成10个直径约为0.25 mm的创伤。
试验管理:出苗后定期观察并记录植株生长指标。生长期间,根据天气状况定期称重浇水。接种蚜虫5 d后收获植株,测量箭筈豌豆的茎叶干重、根系干重,以及抗病相关酶活性、脱落酸、茉莉酸、水杨酸及胰蛋白酶抑制剂等生理生化指标。试验期间,温度为20~28℃,每周五温室定期喷施哒螨灵、吡虫啉、溴氰菊酯等药剂。
1.3 测定指标及方法
菌根侵染率采用染色镜检法进行测定[21]。茎叶干重和根干重采用称重法测定。超氧化物歧化酶(superoxide dismutase,SOD),过氧化物酶(peroxidase,POD),过氧化氢酶(catalase,CAT)及多酚氧化酶(polyphenol oxidase,PPO)等防御酶活性参照李合生的方法进行测定[22]。全N、全P含量参照马源等的方法测定[23]。脱落酸含量采用高效液相色谱法测定[24]。茉莉酸含量采用高效液相色谱法测定[25]。水杨酸含量采用高效液相色谱法测定[26]。胰蛋白酶抑制剂活性参照樊艳平等的方法测定[27]。
根长:由着生于茎干基部的根冠顶端到主根尖末端的长度。
根系面积:使用杭州万深检测科技有限公司生产的LA-S植物根系扫描仪进行扫描,并计算植株根系面积。
蚜虫存活率:从接虫开始,每隔12 h观察蚜虫的存活情况,共统计4 d,计算蚜虫的存活率。
1.4 数据处理与分析
试验数据录入Microsoft Excel 2010进行整理并计算,用JMP IN 4统计软件对数据进行单因素方差分析,用GraphPad Prism 5.01软件绘图。
2 结果
2.1 菌根侵染率
NM处理的箭筈豌豆根系中均未检测到菌根侵染结构,接种AM真菌的处理,在显微镜下观察到丛枝、泡囊及菌丝等菌根侵染结构,表明AM真菌接种成功。菌根侵染率分别为57.5%,57.7%和58.8%,三个处理间无显著差异(图1)。
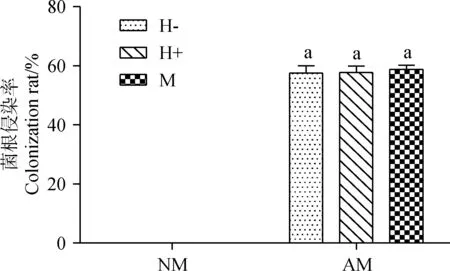
图1 不同处理下的菌根侵染率Fig.1 Colonization rate in different treatments注:NM表示不接种AM真菌处理,AM表示接种G. tortuosum;H-表示无接虫处理,H+表示蚜虫处理,M表示针刺模拟昆虫取食;不同小写字母表示不同处理间差异显著(P<0.05)。下同Note:NM=Inoculation with sterilized AM fungi,AM=Inoculation with G. tortuosum;H-=Don’t inoculate aphid;H+= Inoculation with aphid;M=Simulated insect feeding by prodding. Different low case letter above the bars means there are significant different across treatments at the 0.05 level. The same as below
2.2 植物生长情况
AM真菌对箭筈豌豆的生长产生了显著的促进效应(表1,图2)。与不接种扭形球囊霉(G.tortuosum)的处理相比较,接种扭形球囊霉的处理显著提高了箭筈豌豆的地上生物量、地下生物量、根长以及根系面积,促进了植株的生长(P<0.05)。相比对照,接种G.tortuosum后植株的茎叶干重提高约53.98%,根干重提高约179.69%,根长提高约24.34%,根系面积提高约38.85%。该试验结果表明,扭形球囊霉显著促进了箭筈豌豆的生长。试验发现,接虫处理及针刺模拟蚜虫取食未对箭筈豌豆的生物量及根系长度、面积产生影响,可能由于接虫处理于植株生长发育为健全植株后进行,且昆虫取食时间仅为3~4 d,所以未对植株的生长产生明显的抑制效应。
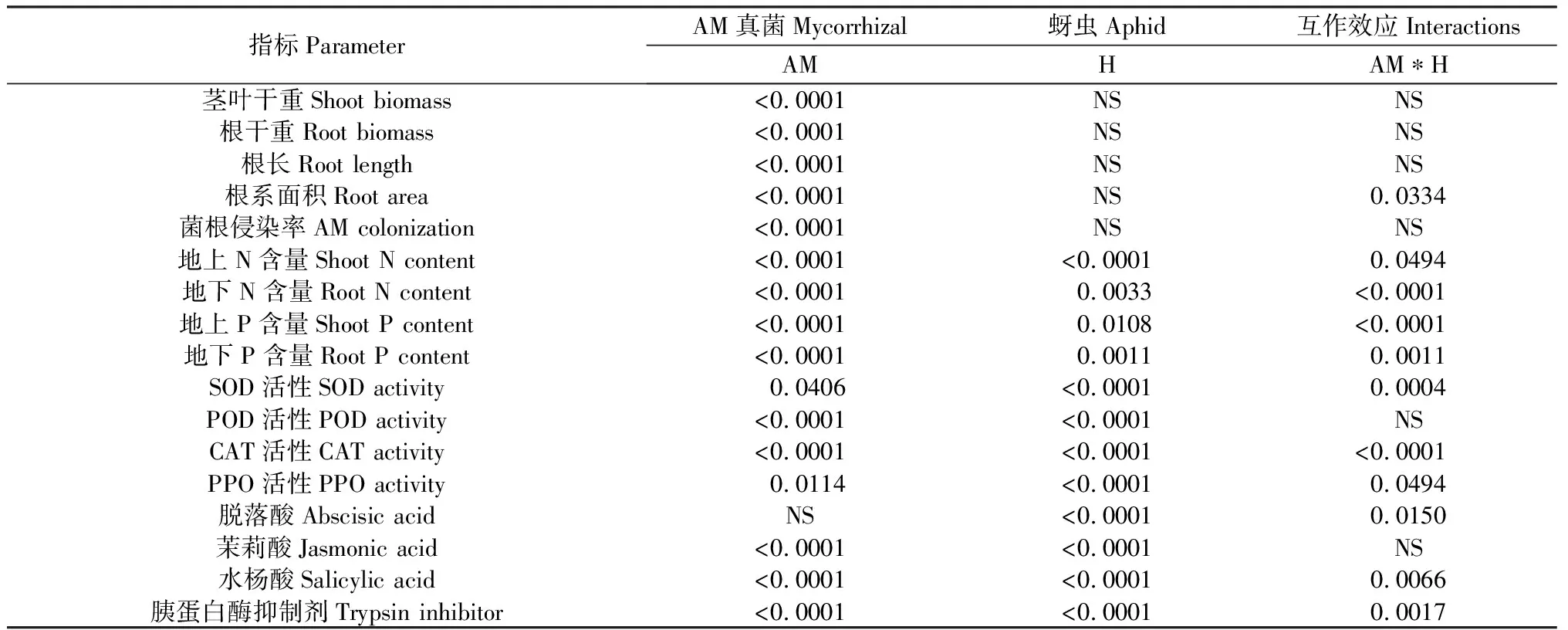
表1 AM真菌(AM),豌豆蚜(H)及两者互作效应方差分析Table 1 ANOVA results(P) of Vicia sativa inoculated with or without arbuscular mycorrhizal (AM) andAcyrthosiphon pisum (H) and their interactions (AM*H)
注:NS表示无显著影响(P>0.05)
Note:NS indicate no significant difference at the 0.05 level
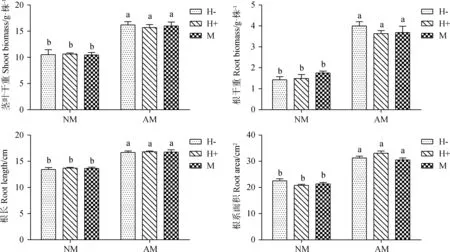
图2 AM真菌、豌豆蚜对箭筈豌豆生长指标的影响Fig.2 Effect of AM fungus and Acyrthosiphon pisum on the growth of Vicia sativa
2.3 蚜虫存活率
由图3可知,在接虫后12 h,接种扭形球囊霉的植株上的蚜虫已大幅度死亡,存活率仅为48%,而同一时间未接种AM真菌的植株蚜虫存活率为60%,明显高于AM真菌处理的植株。在随后的12 h内,AM真菌处理的植株上的蚜虫死亡速度持续增大,到接虫后36 h,蚜虫存活率仅为12%,同一时间未接种AM真菌的植株蚜虫存活率为32%。到接虫后第4 d,AM真菌处理的植株上的蚜虫全部死亡,而未接种AM真菌的植株上的蚜虫还有8%存活,且观察到有下一世代的幼虫出现。试验结果表明,AM真菌扭形球囊霉对箭筈豌豆上的豌豆蚜具有抑制作用,甚至可能对豌豆蚜具有毒害作用。
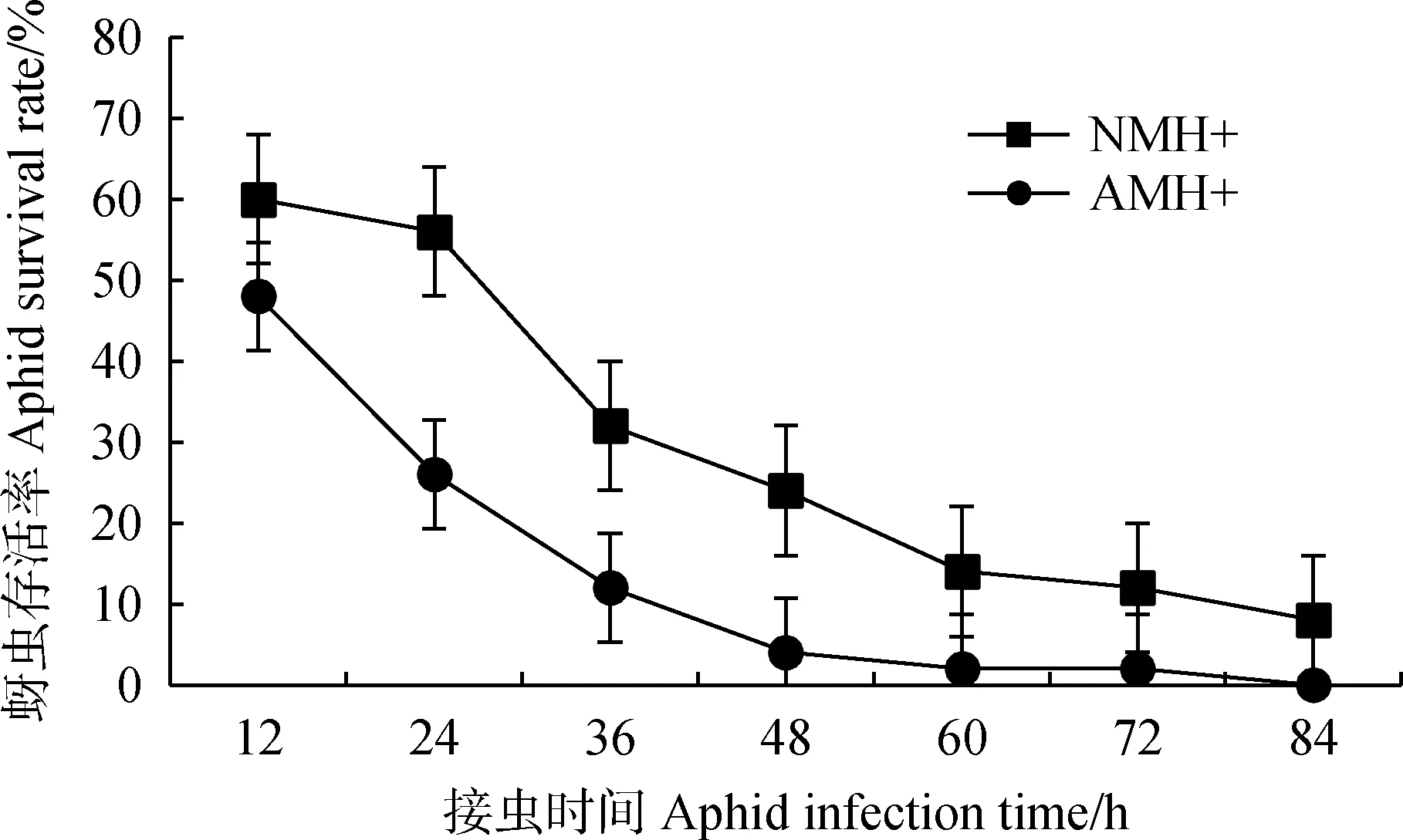
图3 AM真菌对豌豆蚜存活率的影响Fig.3 Effect of AM fungus on the survival rateof Acyrthosiphon pisum
2.4 防御酶活性
AM真菌对箭筈豌豆酶活性的影响结果与植物生长指标保持一致(图4)。接种AM真菌对超氧化物歧化酶(superoxide dismutase,SOD),过氧化物酶(peroxidase,POD)活性均产生正效应,AM真菌处理后这两种防御酶活性均显著高于未接菌处理,SOD活性较对照增加48.64%,POD活性较对照增加72.04%(P<0.05)。AM真菌对过氧化氢酶(catalase,CAT)及多酚氧化酶(polyphenol oxidase,PPO)活性的影响并不显著。蚜虫取食同样对四种防御酶活性产生显著影响,尤其是对CAT和PPO活性的影响更为显著,与对照相比,蚜虫取食后箭筈豌豆的CAT和PPO活性增加幅度高达20~30倍(P<0.05)。
图4 AM真菌、豌豆蚜对箭筈豌豆防御酶活性的影响Fig.4 Effect of AM fungus and Acyrthosiphon pisum on defense enzyme activity of Vicia sativa
2.5 植物养分含量
接种AM真菌后,箭筈豌豆的地上及地下N含量、地下P含量分别增加50.62%,113.07%和62.42%,均达到显著水平(P<0.05,图5)。但接种AM真菌后,箭筈豌豆的地上P含量反而较NM处理降低。不论是否接种AM真菌,接虫处理对地上及地下N含量、地下P含量均变现为负效应。但是对地上P含量的影响与此趋势不同,NM处理中,蚜虫取食降低了植株的地上P含量;而在AM真菌处理中,蚜虫取食及针刺则显著提高了地上P含量(P<0.01),比对照增加超过1.5倍。
2.6 信号物质(脱落酸、茉莉酸、水杨酸、胰蛋白酶抑制剂)
NM处理组及AM真菌处理组中,蚜虫取食均显著增加了植株的脱落酸含量,分别较对照增加55.53%和50.09(P<0.05)。在针刺模拟昆虫取食的处理组中,接种AM真菌显著降低了脱落酸含量,较未接种AM真菌的处理降低19.53%(P<0.05)(图6)。
与对照相比,接种AM真菌后植株的茉莉酸含量显著增加52.74%(P<0.05),水杨酸含量增加3.44%。蚜虫取食后,箭筈豌豆的茉莉酸和水杨酸含量分别增加32.80%和18.02%(P<0.05)(图6)。
接种AM真菌+蚜虫取食处理下,箭筈豌豆植株的胰蛋白酶抑制剂活性最高,与对照相比增加175.02%(P<0.05)。接种AM真菌后,其活性较对照增加95.95%(P<0.05)(图6)。
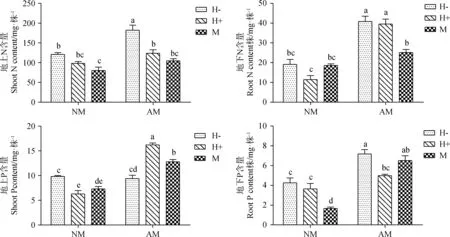
图5 AM真菌、豌豆蚜对箭筈豌豆N、P含量的影响Fig.5 Effect of AM fungus and Acyrthosiphon pisum on N and P content of Vicia sativa
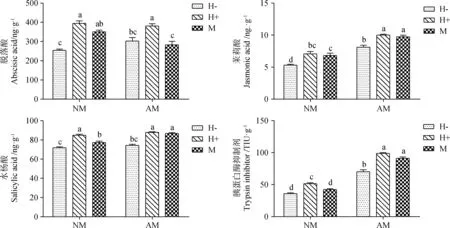
图6 AM真菌、豌豆蚜对箭筈豌豆信号物质的影响Fig.6 Effect of AM fungus and Acyrthosiphon pisum on the signal substance of Vicia sativa
3 讨论与结论
本研究探究了AM真菌扭形球囊霉对箭筈豌豆响应豌豆蚜的影响,结果表明G.tortuosum可以促进箭筈豌豆生长和N,P的吸收,提高植物防御性酶活性,增加茉莉酸、水杨酸等信号物质含量,增强胰蛋白酶抑制剂活性,降低蚜虫存活率,从而减轻豌豆蚜对箭筈豌豆的取食。已有相关研究发现,在昆虫-AM真菌-植物互作体系中,AM真菌可以促进植物生长及养分吸收,改善植物的营养状况,提高了植物整体健康水平,从而间接影响昆虫的生长和繁殖[28]。在对百脉根(Lotusjaponicus)[29]、梯牧草(Phleumpratense)[30]、水稻(Oryzasativa)[31]、香根菊(Baccharishalimifolia)[32]等进行的研究表明,接种AM真菌后,植物生物量增加,昆虫数量减少,昆虫的生长受到抑制。研究表明,AM真菌与昆虫互作效应因植物、AM真菌、昆虫而异,接种AM真菌对昆虫取食的影响不仅仅表现为促进效应[33-34],如Catherine和Bennett[35]研究了40种AM真菌与昆虫的互作关系,结果发现,其中有42.5%的AM真菌对昆虫趋性及取食有促进作用,有抑制作用的占30.0%,无影响的占25.0%,变异的占2.5%。也有大量研究发现,AM真菌与昆虫互作,可以有效抑制昆虫取食,降低危害程度[36]。究其原因,除影响植物整体健康水平之外,AM真菌也可通过改变植物体内的挥发性物质、防御性化合物的组分及浓度,调控植物生理生化机制,从而使宿主植物对昆虫产生驱避作用,减少害虫取食,降低对植物造成的伤害[37-38]。
AM真菌可调节植物信号物质,影响蚜虫取食及存活。AM真菌可以促进番茄(Lycopersiconesculentum)抗虫防御信号物质的合成,并且通过其菌丝网络传递抗虫信号,从而提高植株抗虫性[39];在本研究中,接种G.tortuosum后,箭筈豌豆植株的防御信号物质如茉莉酸、水杨酸的含量均较未接菌处理显著提高,脱落酸含量则显著降低。茉莉酸、水杨酸介导的信号传递途径均与植物抗性密切相关,二者都是植物对外界刺激(如昆虫取食)做出应答,进而诱导抗性基因表达的信号分子,可以促进宿主植物自身防御系统的快速建立,以响应外界胁迫[40-42]。Sabine等[43]也发现昆虫取食后,菌根化植株中蛋白酶抑制剂基因(PI-1和PI-II)显著上调表达,这是植物体内一种重要的抗虫基因;且接种AM真菌后,植株的的茉莉酸感知突变体基因LOXD和茉莉酸合成突变体基因PI-II不表达,茉莉酸过表达植株中的基因转录水平显著升高。因此,在昆虫-AM真菌-植物三者互作时,AM真菌可以调控植物相关防御基因表达,改变体内防御性化学物质的变化,从而影响昆虫的采食和生长。
本研究亦发现,接种G.tortuosum后,脱落酸含量降低,说明AM真菌的定殖减缓了昆虫取食对植物叶片造成的危害。接种AM真菌后,箭筈豌豆植株叶片中的胰蛋白酶抑制剂活性显著提高。胰蛋白酶抑制剂(trypsin inhibitor,TI)能够与生物体内的酶结合,降低酶作用底物分解速率,从而抑制胰蛋白酶水解活性,调节生物体内的生理生化代谢[44-46]。有研究表明,胰蛋白酶抑制剂可以作用于昆虫肠道,与胰蛋白酶结合,抑制其活性,昆虫对食物的消化受到严重影响,无法充分吸收和利用食物中的营养物质,导致昆虫营养不良甚至死亡[47-48]。
本研究虽然发现丛枝菌根真菌的定殖对豌豆蚜的发生具有一定程度的抑制作用,但试验仅在温室进行,且温室每周五定期喷施哒螨灵、吡虫啉、溴氰菊酯等药剂,虽然对试验植物进行了遮蔽,但很大程度上影响了蚜虫存活率。在实际生产中,田间气候条件复杂多变,AM真菌-植物-昆虫互作模式会因物种、作用时间、自然环境的复杂性等不同存在较大的差异;另外,一旦虫害爆发,采用生防菌剂远不如化学防治见效快,且研制生防菌剂需耗费大量人力、物力及资金,即使研发成功,如何进行产业化生产仍具有较高的应用技术难度。因此,在进行AM真菌-植物-昆虫互作的相关研究时应考虑环境等因素的影响,研究不同响应方式之间的联系,明确AM真菌与昆虫相互作用的方式和机制,分析AM真菌-植物-昆虫互作的复杂关系,趋利避害,利用自然界生物之间的关系,控制农业害虫的发生,是实现绿色、健康可持续许发展的重要途径。
