大叶铁线莲ISSR 反应体系的建立与优化
2019-12-19任夏萌李欣怡丁群英
任夏萌,李欣怡,丁群英
(西安文理学院生物与环境工程学院,陕西西安710000)
铁线莲是一类藤本植物,属于毛茛科(Ranunculaceae)铁线莲属(Clematis L.),其耐寒耐旱,并具有较高的观赏价值和药用价值[1]。铁线莲属植物广泛分布于除南极洲外的6 个大洲。据不完全统计,全世界约有355 种铁线莲属植物,我国因国土面积较大而占比较大,约有147 种,大多数种类分布于中部和西南部[2]。在陕西秦岭、巴山、乔山以及陕北等林区,皆发现过铁线莲属植物,平均海拔为400~3 500 m。铁线莲属植物只有少数是直立灌木或草本植物,大多都是多年生木质或草质藤本植物[3],其品种繁多,花型和花色皆丰富多彩,且开花期长,被誉为“攀援植物皇后”。在日本和西方国家的很多公园和家庭花园里,都能见到铁线莲属植物[4]。此外,该属植物在民间常被中医用作药物来利尿通淋、祛风止痛,具有明显的药用价值[5]。由于铁线莲属植物存在较大的市场效益,因此,越来越多的人开始研究铁线莲属植物。
遗传标记(Genetic Marker)是指可追踪染色体、染色体某一些节段、某个基因座在家系中传递的任何一种遗传特性。生物体任何可遗传的基因突变导致的表型差异都可以作为遗传标记[6]。遗传标记有5 种类型,包括形态学标记(Morphological Marker)、细胞学标记(Cytological Marker)、生物化学标记(Biochemical Marker)、免疫学标记(Immune Genetic Markers)以及分子标记(Molecular Marker)[7]。根据现有资料,发现遗传标记可用来分析铁线莲属植物的亲缘种属的相关性以及遗传变异多样性等问题[8]。
和文志等[9]对铁线莲属植物的遗传标记研究现状进行了总结,结果发现,除了生物化学标记,其余类型的标记在铁线莲属植物中均有相关研究,其中,分子标记因其不受外界影响、容易操作等优点,得到了广泛的应用。目前,对于其分子标记的研究,大部分都基于PCR 技术,如SSR 标记、RAPD 标记、RFLP 标记、AFLP 标记、ISSR 标记等。刘庆超等[10]对我国铁线莲属植物分子生物学方面的研究进行了系统介绍,指出我国目前已有的相关研究。普春霞等[11]利用RAPD 技术对12 种云南铁线莲属植物进行了RAPD 分析;孙正海等[12]对滑叶藤进行了ISSRPCR 体系的建立及其优化;张倩[13]对大叶铁线莲的化学成分进行了研究;刘慧杰等[14]对毛茛科分子系统发育进行了研究;和文志等[15]对基于ISSR 标记的铁线莲园艺品种进行了遗传多样性分析和指纹图谱构建。铁线莲ISSR 技术研究起步较晚,国内外有关铁线莲ISSR-PCR 体系优化的报道较少,这在极大程度上制约了铁线莲遗传分析、种质资源鉴定等研究的深入[16],因此,建立适合铁线莲的ISSRPCR 扩增体系至关重要。
ISSR(Inter-simple Sequence Repeat)分子标记技术是由加拿大蒙特利尔大学的ZIETKIEWICZ 等[17]于1994 年提出的,是一种基于SSR(Simple Sequence Repeat)发展起来的新型分子标记,其具有操作简单、快速、高效等优点,同时无需知道任何靶序列的SSR 背景信息,大大降低了操作难度和试验成本。由于其众多优点,因此越来越多被用于种质资源鉴定、亲缘关系分析以及分子育种等研究。
本研究以秦岭野生大叶铁线莲为试验材料,在单因素试验的基础上进行L9(34)正交试验,优化模板DNA、Taq 酶、Mg2+和dNTPs 等影响因素,从而优化大叶铁线莲ISSR-PCR 反应体系,旨在为铁线莲遗传多样性研究、亲缘关系研究以及遗传资源保护等工作提供数据基础。
1 材料和方法
1.1 试验材料
供试材料为秦岭大叶铁线莲,种植于西安文理学院生命与环境工程学院试验田。采取其幼嫩叶片,置于-20 ℃冰箱中保存备用。
1.2 试验方法
1.2.1 DNA 的提取及检测 根据植物基因组DNA提取试剂盒说明书,提取大叶铁线莲基因组DNA。随后以ddH2O 为空白对照,用NanoDrop 2000C 超微量分光光度计检测所提取的DNA 纯度(DNA 纯度=OD260/OD280),并通过1%的琼脂糖凝胶电泳检测所提取DNA 是否可用于后续反应[18]。
1.2.2 引物的筛选 试验所选引物为西安某生物公司的合成产品,同时参照加拿大哥伦比亚大学(UBC)所公布的引物。用合适量程的移液枪分别吸取12.5 μL 的2×Es Taq Master Mix PCR 反应液、2 μL DNA 模板、2 μL 引物(表1),加入到PCR 管中,并进一步用ddH2O 补足25 μL,共13 组反应。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性50 s,退火(温度取决于引物Tm 值)1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,最后4 ℃保存。PCR反应结束后,吸取10 μL 产物进行琼脂糖凝胶电泳,于5 V/cm 的电场中电泳40 min 后,再在紫外透射仪下观察结果,并记录。

表1 引物名称、序列及Tm 值
1.2.3 ISSR-PCR 反应单因素试验 试验选用引物11,选取4 个影响因素:Taq 酶浓度、模板DNA 浓度、dNTPs 浓度、Mg2+浓度,各设定5 个浓度梯度,以单因素优化法进行4 组试验(表2),PCR 扩增后产物进行琼脂糖凝胶电泳,随后使用紫外透射仪观察扩增效果,选出最优条件。PCR 反应程序:94 ℃预变性5 min;94 ℃变性50 s,47 ℃退火1 min,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min,最后4 ℃保存。

表2 大叶铁线莲ISSR-PCR 单因素试验水平
1.2.4 ISSR-PCR 反应正交试验 根据单因素试验结果,对PCR 反应体系中的模板DNA 浓度、dNTPs浓度、Taq 酶浓度,Mg2+浓度各设定3 个梯度,设计四因素三水平的正交试验(表3),PCR 扩增后产物进行琼脂糖凝胶电泳,使用台式紫外透射仪观察扩增效果。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性50 s,47 ℃退火1 min,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min,最后4 ℃保存。
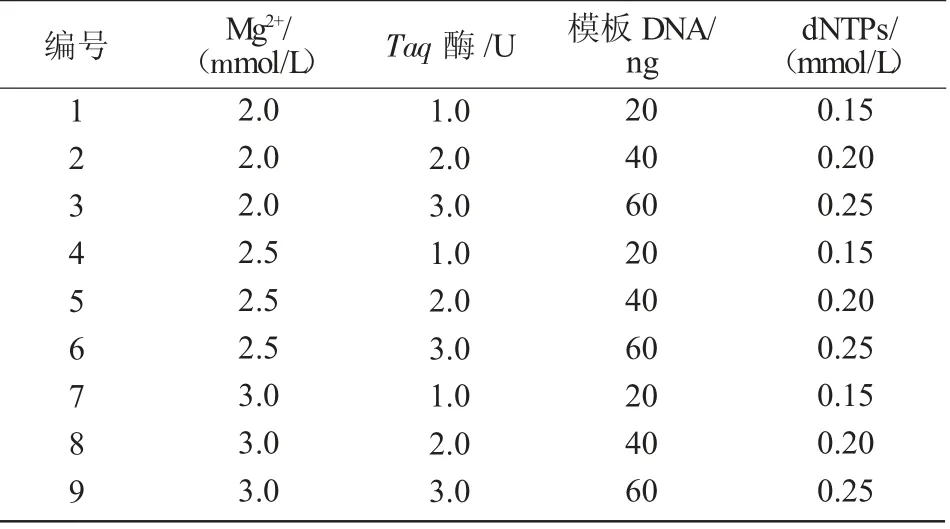
表3 大叶铁线莲ISSR-PCR 正交试验
2 结果与分析
2.1 DNA 的制备
选择生长状态良好、幼嫩的叶片为材料,在提取时能够获得合适的基因组DNA,得到的大叶铁线莲基因组DNA 电泳图谱如图1 所示。从琼脂糖凝胶电泳的结果来看,条带清晰,背景明亮,所提取的基因组DNA 质量较好,无RNA 和蛋白质污染,基本满足ISSR-PCR 反应条件。通过NanoDrop 2000C 超微量分光光度计的检测,提取的基因组DNA 浓度为20 ng/μL,OD260/OD280值为1.65,达到了ISSR-PCR 反应的基本条件。

2.2 引物的筛选
引物共有13 条,其扩增后的产物经琼脂糖凝胶电泳结果如图2 所示,发现11 号引物条带清晰,无拖尾现象,条带数量足够,可以用于后续反应。
2.3 ISSR-PCR 反应体系优化
2.3.1 基因组DNA 浓度对ISSR-PCR 反应体系的影响 模板浓度过低时,条带易于变得模糊;模板浓度过高时,条带背景亮度较大。扩增后琼脂糖凝胶电泳图谱如图3 所示,5 种基因组DNA 加入量分别为20,40,60,80,100 ng。由图3 可知,当基因组DNA 加入量大时背景亮度增大,但差距不明显,从经济角度考虑选择40 ng 为最优条件。

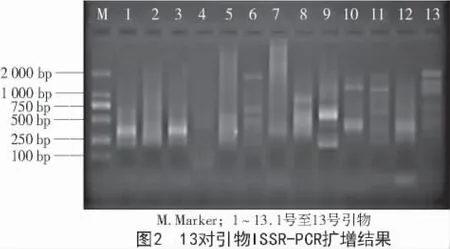
2.3.2 Taq 酶浓度对ISSR-PCR 反应体系的影响Taq DNA 聚合酶用量过少则会引起扩增量不足,过多会导致非特异性产物增加。扩增后琼脂糖凝胶电泳图谱如图4 所示,在5 个浓度梯度中,2 U 浓度时背景清晰,所以选择2 U 为最优条件。
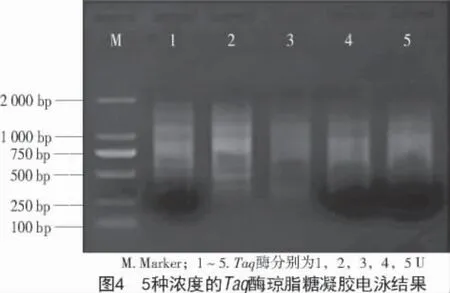
2.3.3 dNTPs 浓度对ISSR-PCR 反应体系的影响dNTPs 是扩增反应的原料,参与新链DNA 的合成,它只有在一个最优值时反应才有最大效率,否则会抑制产物的形成。扩增后琼脂糖凝胶电泳图谱如图5 所示,共有0.10,0.15,0.20,0.25,0.30 mmol/L 等5 组浓度梯度。由图5 可知,dNTPs 加入量大时背景亮度增大,但差距不明显,从经济角度考虑选择0.2 mmol/L 为最优条件。
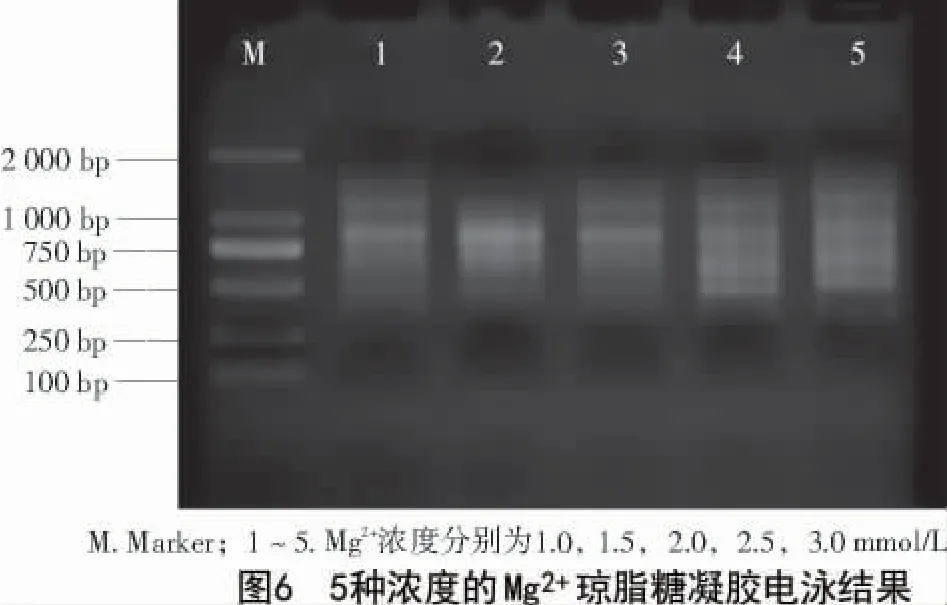
2.3.4 Mg2+浓度对ISSR-PCR 反应体系的影响Mg2+作为Taq DNA 聚合酶的催化剂,显著影响着酶的活性,进而直接影响PCR 结果,过高的Mg2+浓度会降低反应的特异性,而过低的Mg2+浓度会影响PCR产量,甚至导致PCR 扩增失败。扩增后琼脂糖凝胶电泳图谱如图6 所示,共有1.0,1.5,2.0,2.5,3.0 mmol/L等5 组浓度梯度,当浓度为3.0 mmol/L 时扩增效果最好,所以选择3.0 mmol/L 为最优条件。
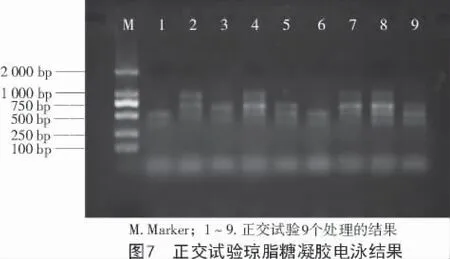
2.3.5 ISSR-PCR 反应正交试验 基于单因素试验基础,设计四因素三水平的正交试验(表3),试验结果如图7 所示。根据所扩增条带的强弱、清晰度、重复性等进行1~9 分计分,最佳组合记为9 分,最差组合记为1 分。9 个处理的评分结果依次为1,6,1,8,5,2,6,9,3,按照参考文献[19]进行计算,获得的最佳反应体系为处理8。
由表4 可知,处理8 的模板DNA 含量为40 ng,Mg2+浓度为3.0 mmol/L,dNTPs 浓度为0.2 mmol/L,Taq DNA 聚合浓度为2 U。

表4 ISSR-PCR 最佳反应体系
3 结论与讨论
DNA 样品的质量与浓度对后续ISSR-PCR 反应的结果有着直接的影响,DNA 样品的质量与浓度对后续ISSR-PCR 反应的结果有着直接的影响。高质量的基因组DNA 有助于更好更快地优化ISSR-PCR 反应体系,因此,在提取时应选择生长良好及幼嫩的大叶铁线莲叶片为提取材料,采摘后应迅速放入-20 ℃冰箱中保存(防止基因组DNA 降解,同时为后续提取工作做好准备)。其次,采用康为世纪公司的植物基因组DNA 提取试剂盒(Plant Genomic DNA Kit)提取基因组DNA,其优点有:采用先进的硅胶膜技术和简单的离心程序,无需乙醇沉淀,适合于简单快速地分离得到高纯度DNA。需要注意的是,在提取时需加入少量β- 巯基乙醇,防止DNA 褐化,且操作过程应在通风橱进行。本研究表明,提取过程结束后,经过琼脂糖凝胶电泳和分光光度计检测,提取的基因组DNA 在质量和浓度上均符合要求,提取的基因组DNA 中RNA 和蛋白质较少,测得OD260/OD280值为1.65,表明DNA 样品无蛋白质和RNA 污染,符合后续PCR 反应要求。
在ISSR-PCR 反应中,引物的作用是起始DNA复制,因为Taq DNA 聚合酶没有起始复制的功能只有延伸的功能,所以需要一段引物来与DNA 模板结合起始复制。当引物浓度太低时,不易与模板DNA 结合,不产生扩增产物或者扩增产物较少;当浓度太高时,很容易引起非特异性扩增或碱基错配,并且引物之间还可能形成二聚体或多聚体[20]。本试验共有13 条引物可供选择,将13 条引物分别进行PCR 反应(25 μL 体系中加入12.5 μL 的2×Es Taq Master Mix PCR 反应预混液,2 μL 引物,2 μL DNA 模板,再用ddH2O 补足25 μL),PCR 产物进行琼脂糖凝胶电泳,然后根据电泳图谱选择一条引物用于后续反应,其中11 号引物产生的条带清晰,背景明亮,最终选择了11 号引物用于后续的ISSRPCR 反应体系优化。
在PCR 反应体系中,参与反应的物质有Taq DNA 聚合酶、模板DNA、4 种dNTPs、引物和Mg2+。本试验选择了Mg2+、模板DNA、dNTPs、Taq DNA 聚合酶4 种物质的浓度进行优化。模板DNA 作为直接参加反应的物质对PCR 的影响就是底物对于反应的影响,模板浓度过低时,会导致产物稳定性下降,且条带易于变得模糊;模板浓度过高时,可能会有杂质混入反应体系,容易出现拖尾现象,所以选择适中的浓度进行ISSR 分析。
dNTPs 的主要功能是在PCR 的延伸步骤中,以碱基互补原则,在Taq 聚合酶的作用下连接待扩增的模板,从而达到复制模板的目的。dNTPs 作为反应的底物,参与新链DNA 的合成,只有在一个最优值时,反应才有最大效率,否则会抑制产物形成。
在一定浓度下,Taq 聚合酶浓度越高反应速率越快,相同时间产生的产物也就越多,但是当浓度达到一定值时,酶浓度不再影响反应速率。所以从经济角度考虑,在相同扩增效果下选择较低的Taq聚合酶浓度。
本试验通过单因素优化法和正交试验对Mg2+,模板DNA、dNTPs、Taq DNA 聚合酶4 种物质的浓度进行筛选,最终确定适合于大叶铁线莲ISSR-PCR反应的体系为:在25 μL 反应体系中,最佳体系为1.0 μL 模板DNA、2.0 μL Mg2+、2.0 μL dNTPs、1.0 μL引 物 以 及0.2 μL Taq DNA 聚 合 酶 和18.8 μL ddH2O。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性50 s,47 ℃退火1 min,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min,最后4 ℃保存。使用该体系进行ISSR-PCR 反应,扩增后均可出现清晰条带,结果为今后的研究提供了保障。
