柠条木质素降解菌的筛选及其降解条件优化
2019-12-14崔家荣段开红
崔家荣 段开红


摘要 [目的]将柠条转化为可被牲畜高效利用的优良饲料。[方法]采用柠条作为单一碳源的筛选培养基、苯胺蓝筛选培养基从牲畜粪便以及柠条腐质中分离筛选出对柠条木质素具有降解作用的菌株D-11。[结果]经微生物形态学和16S rDNA鉴定,D-11为地衣芽孢杆菌,同时对D-11降解条件进行优化。菌株D-11的最佳降解条件如下:最佳氮源为蛋白胨;温度为28~32 ℃;pH为7;添加诱导剂Mn2+的浓度为0.6 mmol/L。在最优条件下,菌株D-11对柠条木质素降解率为18.21%,半纤维素的降解率为16.11%,纤维素的降解率为13.19%。[结论]采用菌株D-11对柠条进行发酵降解,使其转化为可被牲畜利用的优良饲料。
关键词 柠条;木质素;木质素降解菌;筛选;发酵降解;降解条件优化
中圖分类号 S816.6文献标识码 A
文章编号 0517-6611(2019)19-0107-03doi:10.3969/j.issn.0517-6611.2019.19.031
Abstract [Objective] To convert Caragana korshinskii into a good feed efficiently utilized by livestock.[Method]C.korshinskii was used as a single carbon source for screening medium and aniline blue screening medium was used to separate and screen out lignin degrading strain D11 from livestock manure and C.korshinskii humus.[Result] Strain D11 was identified by microbial morphology and 16S rDNA as Bacillus licheniformis,and the degradation conditions of D11 were optimized.The optimal degradation conditions of strain D11 were as follows:optimal nitrogen source was peptone,temperature was 28-32 ℃,pH was 7,the concentration of added inducer Mn2+ was 0.6 mmol/L.Under the optimal conditions,the degradation rate of strain D-11 to C.korshinskii lignin was 18.21%, the degradation rate of hemicellulose was 16.11%,the degradation rate of cellulose was 13.19%.[Conclusion] Strain D-11 can be used to ferment and degrade C.korshinskii,which can be transformed into an excellent feed utilized by livestock.
Key words Caragana korshinskii;Lignin;Lignindegrading bacteria;Screening;Fermentation and degradation;Optimization of degradation conditions
柠条是多年生豆科灌木,作为一种非竞争性资源,在我国北方地区具有数量大、分布广、价格低廉的特点,由于其枝繁叶茂、营养丰富,含有10多种生物活性物质,尤其是氨基酸含量丰富[1],因此也是良好的饲用植物,但其木质纤维素含量高,且收获干燥后茎秆粗硬,并具有脱叶刺也成为影响牲畜对其高效利用的关键问题[2]。笔者从微生物丰富的粪便及其柠条腐殖质中分离筛选出具有高效降解柠条木质素的菌株,将柠条中难以被牲畜直接消化利用的木质素,通过生物处理的方式降解为可被生物利用的小分子物质,提高柠条的饲料营养价值和利用率,来发挥柠条潜在的饲用价值。
1 材料与方法
1.1 样品来源及处理方法 试验所用样品采自市区周边郊区农户的牲畜粪便、腐质柠条,分别装入无菌袋带回并保存于4 ℃冰箱中。
1.2 培养基
①初筛培养基。柠条粉10 g(柠条磨粉,过40目筛,65 ℃烘16 h),NH4NO3 1.0 g,K2HPO4 0.5 g,KH2PO4 0.5 g,NaCl 0.2 g,MgSO4 0.2 g,CaCl2 0.2 g,微量MnSO4·H2O,琼脂粉20 g,蒸馏水1 L。②基本培养基(BM)。酵母膏10 g,葡萄糖20 g,琼脂20 g,蒸馏水1L。③苯胺蓝筛选培养基。配制浓度为1.0%的苯胺蓝(Azure-B)母液,在制作平板时,每100 mL 基本培养基(BM)中加入1.0 mL 母液即可。④LB培养基。胰蛋白胨10 g,酵母浸膏5 g,NaCl 10 g,琼脂20 g,蒸馏水1 L。⑤液体发酵培养基。柠条粉10 g,蒸馏水1 L,自然pH,121 ℃灭菌30 min。
1.3 方法
1.3.1 降解木质素菌的筛选。
1.3.1.1 初筛。分别称取各样品10 g,捣碎后无菌水振荡活化12 h,取上清液稀释成10-4、10-5、10-6 浓度梯度的稀释液,取0.1 mL 涂布到初筛培养基平板上,置于30 ℃恒温箱中恒温培养1~3 d,挑取能够在初筛培养基上生长的细菌菌株在LB 培养基上进行划线分离、纯化,最后保存在LB 斜面培养基上。
1.3.1.2 复筛。将初筛得到的菌株扩培,转接到BM培养基中,置于37 ℃恒温培养48 h后,每株菌做2个平行。10 000 r/min、4 ℃离心5 min,取上清液点样于Azure-B 平板的微孔,每孔点样100 μL。37 ℃避光培养2 d后,观察并记录脱色圈的有无及大小。
1.3.2 木质素酶活力的测定方法。因为所筛菌株未检测漆酶活性,所以仅对木质素过氧化物酶和锰过氧化物酶进行测定。制得菌株粗酶液后,按照Klopman等[3]和Heinfling等[4]的测定方法分别对木质素过氧化物酶(Lip)和锰过氧化物酶(Mnp)活力进行测定。
1.3.3 菌株液体发酵培养。
将保存在LB斜面上的菌株转接到LB液体培养基中活化培养后,转接到液体发酵培养基中,以10%的接种量接种于液体发酵培养基中,30 ℃下恒温振蕩培养15 d。
1.3.4 柠条发酵产物中木质纤维素各组分含量的测定。
发酵产物在121 ℃下灭菌30 min,过滤后收集残渣,并在烘箱中55 ℃ 烘干至恒重,参照Van Soest等[5]的木质纤维素测定方法对柠条发酵物中的木质素、纤维素和半纤维素含量进行测定,以未发酵柠条粉为对照,计算出柠条中各组分的相对降解率。以上试验重复3次。
1.3.5 菌种鉴定。
将分离纯化的菌株在LB液体培养基中培养3~5 d。利用引物27F和1492R扩增所筛选微生物16S rDNA,送交测序公司测序后,将序列与NCBI网站登录序列进行比对。根据比对结果及形态特征确定所筛选菌株的种属。
2 结果与分析
2.1 降解木质素菌株的筛选
从样品中共分离到木质素降解菌31株,采用苯胺蓝平板法初筛到具有水解透明圈的菌株12株。选取初筛菌株中水解圈直径较大的前5株菌株进行液体发酵,测定发酵上清液的水解圈大小,同时结合木质素降解酶活力的测定结果进行复筛(表1)。从表1可以看出,以上菌株在发酵培养基上产酶活力以菌株D-11、Y-1、S-3 较高。选取D-11 菌株进行种属鉴定及后续研究。
2.2 菌株D-11的16S rDNA 序列分析及系统发育树分析
将木质素降解菌株D-11的16S rDNA序列经测序获得的序列在NCBI网站中进行BLAST搜索和序列比对,结果显示所获得序列的同源性很高的序列大多来自芽孢杆菌属(Bacillus)。根据16S rDNA序列比对结果以及系统发育树的遗传距离分析(图1),初步鉴定菌株D-11为地衣芽孢杆菌(Bacillus licheniformis strain)。
2.3 D-11菌株对柠条木质素的降解率测定
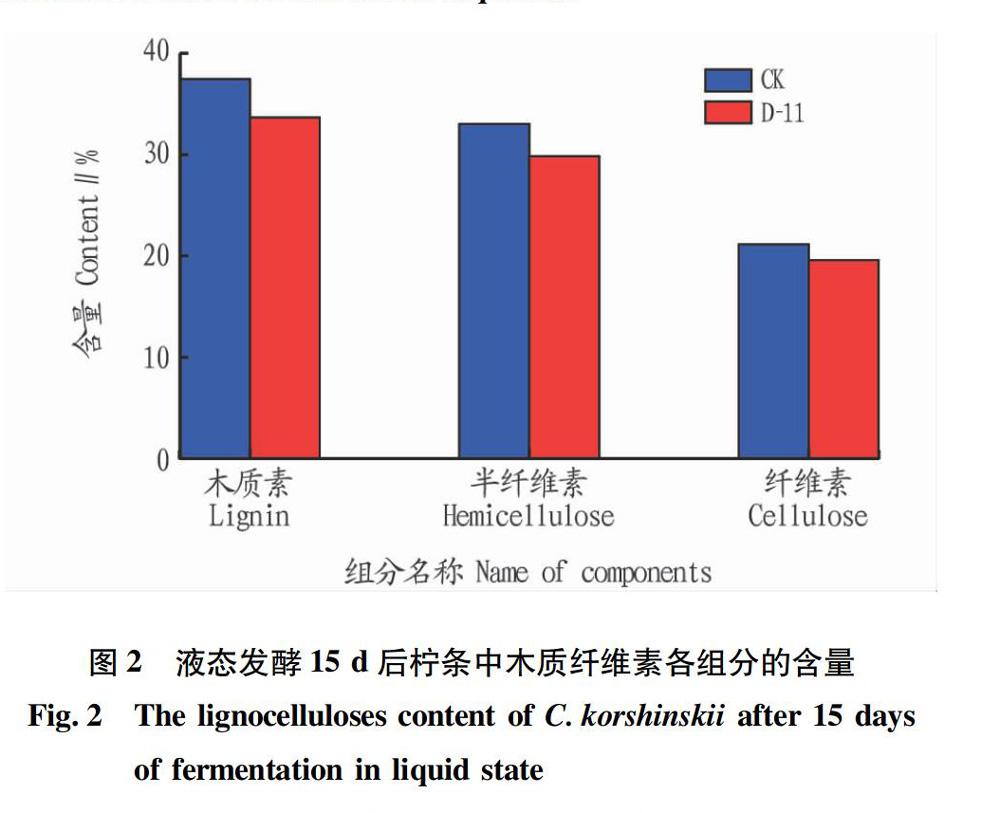
对未发酵柠条粉和发酵15 d后柠条粉中木质素、纤维素和半纤维素含量进行测定,结果见图2。从图2可以看出,柠条粉经菌株D-11发酵15 d后,对木质素的降解率最高,达到10.12%;半纤维素和纤维素的降解率分别为9.63%和7.37%。这说明D-11对柠条木质纤维素中各组分均具有一定的降解能力,尤其以木质素的降解能力最好,与纤维素和半纤维素相比降解效果最为明显。
2.4 木质素降解条件的优化
2.4.1 氮源的影响。
以柠条固定碳源,为发酵培养基中分别添加0.05%尿素、蛋白胨、硫酸铵以及硝酸钠作为不同的氮源,接种D-11培养15 d后测定其各木质素降解率,结果见表2。从表2可以看出,选取的4种氮源中,D-11菌株对蛋白胨的利用较好,其降解能力较其他氮源总体上有所提升,使用硫酸铵以及硝酸钠为氮源是对于木质素降解率的提高不大,而以尿素为氮源时,其降解能力均有一定程度的下降。因此,蛋白胨为菌株D-11的适宜氮源。
2.4.2 温度的影响。
从图3可以看出,各组分降解能力所对应的最适温度范围比较宽泛。木质素与纤维素降解的最适温度为32 ℃,但纤维素的降解在28~35 ℃内变化不大;半纤维素的最适降解温度为28 ℃,但在升温至32 ℃过程中木质素降解率的下降幅度并不大。各组分的降解能力在超过36 ℃时有明显下降,究其原因可能是温度的升高使降解酶的酶活发生变化,从而降低了木质素的降解率。
2.4.3 pH的影响。
木质素降解能力受培养液pH的影响较大。从图4可以看出,当培养液的pH为7时,木质素、纤维素与半纤维素的降解能力均达到峰值。这说明中性环境对于D-11的产酶以及木质素的降解更为有利,过高或者过低的pH都可能使菌株的生长发育产生了一定的消极影响,同时极端pH也会使降解所需酶失活变性,从而影响了木质素的降解效率。D-11对于木质素的降解在pH 为7时达到1293%,而纤维素的降解率在pH为6~8时变化幅度不大。
2.4.4 Mn2+浓度的影响。
菌株D-11的所产Mnp的酶活相对于S-3较弱,同时Mnp活性较为依赖Mn2+的浓度,所以添加一定浓度的Mn2+可以提高Mnp的活力,从而提高木质素的降解能力。从图5可以看出,木质素与纤维素降解率随Mn2+浓度的增加而升高,但当Mn2+浓度低于0.8 mmol/L时对木质素与纤维素的降解有一定的促进作用,但对半纤维素降解的影响较小,当Mn2+浓度大于0.8 mmol /L 时菌株D-11对木质纤维素的降解能力整体呈下降趋势。这说明过量的Mn2+可能会变成毒性离子,会影响菌株的正常生长,将促进作用转变为抑制作用。
3 讨论
目前,木质素的生物质降解利用主要集中在真菌与复合菌剂的研究,然而真菌虽然在降解效果上较为理想[6],但其培养周期长,保存运输不便以及在饲料青贮过程中容易引起饲料变质等问题也限制了其在生物质降解利用方面的推广。在针对木质素降解菌的研究中发现许多可以降解木质素的细菌,Bugg等[7]与Tuomela等[8]从造纸厂废水中筛选出几株芽孢杆菌,并在其细胞提取物中都分离出活性较高的木质素降解酶。另外,Bandounas等[9]也成功分离出几株可以降解碱性卡夫木质素的芽孢杆菌。这些研究结果表明芽孢杆菌可能是木质素降解中起到关键作用的微生物。该研究通过筛选成功分离到一株具有单独降解柠条木质素能力的地衣芽孢杆菌D-11,这对于柠条木质素降解的研究具有一定的理论指导意义。
该研究采用单因素试验对氮源、温度、pH以及诱导剂等影响木质素降解的主要因素进行优化,从而提高菌株D-11 对3种生物质的降解能力, 在优化条件下菌株D-11对柠条木质素发酵15 d的降解率为18.21%,低于李红亚等[10]采用细菌液态发酵玉米秸秆16 d后24% 的木质素降解率。筛选菌株的木质素降解率较低可能是由于多年生的平茬柠条木质化程度高,远远大于一般作物秸秆中的木质素含量,使相比更一般作物秸秆更难被降解;同时,该研究仅对部分发酵条件进行优化,可能未达到菌株的最佳发酵条件。王仁佑等[11]研究表明金属离子添加可以促使微生物的生长而提高产酶量,而且可以通过添加表面活性剂改变菌株细胞膜的通透性来提高胞外酶的分泌,促使微生物酶活的增加,提高木質素降解能力[12]。因此,该研究下一步的研究重点是继续优化发酵培养条件,考量其他诱导剂以及表面活性剂对菌株产酶和降解能力的影响,同时会研究多种微生物分部处理的生物预处理方法,加快降解速率并侧重于实现木质素的选择性降解,从而达到柠条纤维素回收利用的目的,提高发酵饲料的营养价值。
4 结论
从柠条作为唯一碳源的筛选培养基和苯胺蓝筛选培养基中分离出木质素降解菌株D-11,经过16S rRNA序列分析鉴定为地衣芽孢杆菌,对其采用优化的降解条件:氮源为蛋白胨;温度28~32 ℃;pH 为7;添加Mn2+的浓度为0.6 mmol/L进行柠条发酵,其木质素降解率为18.21%,半纤维素的降解率为16.11%,纤维素的降解率为13.19%,其中木质素降解率较优化前提高了79.94%。该研究结果为后续对柠条木质素的降解研究提供更多试验依据。
参考文献
[1]朱德文.农作物秸秆用作动物饲料——可行性与限制因素分析[J].饲料研究,2003(2):34-36.
[2] 温学飞,李明,黎玉琼.柠条微贮处理及饲喂试验[J].中国草食动物,2005,25(1):56-57.
[3] KLOPMAN G,TU M H,FAN B T.Prediction of the metabolism of polycyclic aromatic hydrocarbons [J].Theor Chem Acc,1999,102:33-38.
[4] HEINFLING A,MARTINEZ M J,MARTINEZ A T,et al.Transformation of industrial dyes by manganese peroxidases from Bjerkandera adusta and Pleurotus eryngii in a manganeseindependent reaction[J].Appl Environ Microbiol,1998,64(8):2788-2793.
[5] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition [J]. Journal of dairy science,1991,74(10):3583-3597.
[6] 陈忠华.真菌降解木质素的研究进展及发展前景[J].黑龙江畜牧兽医,2009(9):28-29.
[7] BUGG T D H,AHMAD M,HARDIMAN E M,et al.The emerging role for bacteria in lignin degradation and bio-product formation [J].Curr Opin Biotechnol,2011,22(3):394-400.
[8] TUOMELA M,VIKMAN M,HATAKKA A,et al.Biodegradation of lignin in a compost environment:A review [J].Bioresour Technol,2000,72(2):169-183.
[9] BANDOUNAS L,WIERCKX N J P,WINDE J H D,et al.Isolation and characterization of novel bacterial strains exhibiting lignin lytic potential [J].BMC Biotechnol,2011,11:1-11.
[10] 李红亚,李术娜,王树香,等.产芽孢木质素降解菌MN-8的筛选及其对木质素的降解[J].中国农业科学,2014,47(2):324-333.
[11] 王仁佑,刘剑潇,黄红丽,等.鼠李糖脂对两株木质素降解菌产酶能力的影响[J].湖南大学学报(自然科学版),2008,35(10):70-74.
[12] STOLZ A.Molecular characteristics of xenobioticdegrading sphingomonads [J].Appl Microbiol Biotechnol,2009,81:793-811.
