外源5-氨基乙酰丙酸对紫花苜蓿生理特性的影响
2019-12-12李丹丹梁宗锁杨宗岐韩蕊莲
李丹丹,梁宗锁,杨宗岐,韩蕊莲
(西北农林科技大学草业与草原学院,陕西 杨凌 712100)
紫花苜蓿(Medicago sativa),多年生豆科牧草,原产于伊朗,其营养价值高,适口性好,素有“牧草之王”和“饲料皇后”的美称[1-2]。紫花苜蓿主要分布在中国的西北、北部和东北部半干旱地区且在农业生产中具有十分重要的价值和地位[3]。大量研究表明,干旱、低温等逆境胁迫会严重影响紫花苜蓿的质量和产量[4-5]。5-氨基乙酰丙酸(5-aminolevulinic acid,ALA)在植物代谢过程中发挥着重要的作用,是许多物质合成的前提。有研究发现,喷施适度的ALA能够提高番茄(Solanum lycopersicum)[6]、甘草(Glycyrrhiza uralensis)[7]、金荞麦(Fagopyrum dibotrys)[8]、栀子(Gardenia jasminoides)[9]等幼苗的光合作用以及抗逆性。已有研究探究了干旱胁迫对3个苜蓿品种(农牧806、雷达克、保定苜蓿)紫花苜蓿生理生化的影响,结果发现“农牧806”相对于其他两个紫花苜蓿品种而言抗旱性较弱。因此,本研究选取生长3个月的紫花苜蓿“农牧806”为试验材料,通过喷施0、5、10、15、20、25 mg·L-1的ALA进行处理,24 h后分别测定紫花苜蓿生理生化指标,探讨ALA对紫花苜蓿幼苗光合色素、抗氧化酶活性、活性氧系统以及渗透调节物质含量的影响,为紫花苜蓿栽培种植提供理论基础。
1 材料与方法
1.1 试验材料
紫花苜蓿“农牧806”种子购买自北京克劳沃草业有限公司。
1.2 试验设计
试验于2018年9月4日至12月23日进行,将紫花苜蓿“农牧806”种子先用0.5%次氯酸钠溶液消毒20 min,随后用蒸馏水冲洗干净,分别撒播在育苗盘上,表面覆土,定时浇水,当幼苗培养至3叶期后,移苗至盛有混匀介质(泥炭土∶珍珠岩∶蛭石 = 3∶1∶1)的营养盆(12 cm × 13 cm)中,定时浇水,每周灌溉一次1/2 Hogland营养液,室内温度控制在26 ℃,光照14 h·d-1,育苗3个月后,挑选生长一致的紫花苜蓿幼苗,开始试验处理。
喷施不同浓度(0、5、10、15、20、25 mg·L-1)ALA对紫花苜蓿“农牧806”进行处理,0为对照(CK),喷至叶片不滴水为止(每株喷施10 mL)。整个试验过程保持不断通气。ALA处理24 h后,取各处理叶片进行生理生化测定,每个处理3个重复。
1.3 试验方法
光合色素含量测定:采用Wellburn等[10]的方法在95%的乙醇中进行提取,室温下避光静置样品发白,然后在665、649和470 nm波长处测定吸光值。
可溶性蛋白含量(soluble protein,SP)测定:采用文献[11]方法测定。
丙二醛(Malondialdehyde,MDA)含量测定:采用硫代巴比妥酸法测定[12],并在532、600 nm处测定吸光值。
抗氧化酶活性测定:超氧化物歧化酶(superoxide dismutase, SOD)活性采用Ries等[13]方法测定;过氧化物酶(peroxidase, POD)活性采用Nakano等[14]方法测定;过氧化氢酶(catalase, CAT)活性采用Chance等[15]方法测定;抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性采用维生素C氧化法[16]。
过氧化系统测定:-OH含量根据Liu等[17]的方法测定;H2O2含量根据Willekens等[18]的方法测定。
1.4 数据处理
所有数据均采用SPSS18.0进行方差分析,利用ANOVA中LSD和Duncan's多重比较测验,各处理间的显著性差异检验水平为P < 0.05。采用GraphPad Prism6软件作图。
2 结果与分析
2.1 喷施ALA对紫花苜蓿幼苗叶片中光合色素含量的影响
喷施低浓度(5~10 mg·L-1)的ALA可以促进紫花苜蓿“农牧806”幼苗叶片中光合色素的合成(图1)。喷施10 mg·L-1ALA后,紫花苜蓿幼苗叶片光合色素Chl a、Chl b、Chl a + b、Car较对照(CK,0 mg·L-1)分别显著提高12.29%、36.21%、18.69%和11.46%(P < 0.05)。而随着ALA浓度的增加,紫花苜蓿叶片中光合色素含量显著降低(P < 0.05),25 mg·L-1ALA处理后,紫花苜蓿幼苗叶片Chl a、Chl b、Chl a + b、Car含量降至最低,分别降低了54.11%、13.64%、56.51%和58.66%。

图 1 喷施5-氨基乙酰丙酸(ALA)对紫花苜蓿幼苗叶片光合色素含量的影响Figure 1 Effect of exogenous ALA (5-aminolevulinic acid) on the contents of photosynthetic pigments in alfalfa seedling leaves
2.2 喷施ALA对紫花苜蓿幼苗叶片中抗氧化酶活性的影响
与对照(CK)相比,紫花苜蓿“农牧806”叶片中SOD、POD、CAT活性在喷施外源ALA后,随ALA浓度的增加,SOD、POD、CAT活性呈现出先升高后降低的趋势(图2)。喷施10 mg·L-1ALA后,紫花苜蓿幼苗叶片中APX、CAT和POD活性达到了最高,与对照相比,APX、CAT和POD活性分别显著增高了11.46%、225%、38.21% (P < 0.05),SOD在ALA浓度为5 mg·L-1时活性最高,比对照显著增高了83.69%。而随着ALA浓度的增加,紫花苜蓿叶片中抗氧化酶活性逐渐降低,喷施25 mg·L-1ALA后,紫花苜蓿幼苗叶片中APX和SOD活性降至最低,比对照分别显著降低了58.66%和78%。
2.3 喷施ALA对紫花苜蓿幼苗叶片中H2O2和-OH含量的影响
与对照相比,喷施ALA后,紫花苜蓿幼苗叶片中H2O2和-OH含量随着ALA浓度的增加表现出先降低后升高的趋势,在10 mg·L-1时降至最低,H2O2和-OH含量与对照相比分别显著降低了6.20%和7.83% (P < 0.05) (图3)。而随着ALA浓度的增加,紫花苜蓿“农牧806”叶片中H2O2和-OH含量逐渐升高,H2O2含量在ALA浓度为25 mg·L-1时达到最高,与对照相比增加了3.87%。-OH含量则在ALA浓度为20 mg·L-1时其含量最高,但仍低于对照。
2.4 喷施ALA对紫花苜蓿幼苗叶片中MDA含量的影响
与对照相比,喷施ALA后,紫花苜蓿幼苗叶片中MDA含量随着ALA浓度增加表现出先降低后升高的趋势,并在10 mg·L-1ALA浓度下降至到最 低,比 对 照 显 著 降 低12.01% (P < 0.05) (图4)。而随着ALA浓度的增加,紫花苜蓿幼苗叶片中MDA含量逐渐升高,25 mg·L-1时,MDA含量达到最大值,与对照相比升高了9.19%。

图 2 喷施5-氨基乙酰丙酸(ALA)对紫花苜蓿幼苗叶片APX、SOD、POD、CAT活性的影响Figure 2 Effect of exogenous ALA (5-aminolevulinic acid) on the activities of APX, SOD, POD, and CAT in alfalfa seedling leaves
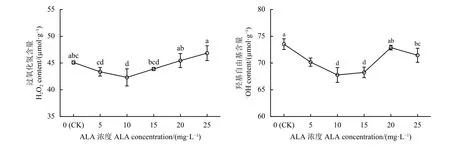
图 3 喷施5-氨基乙酰丙酸(ALA)对紫花苜蓿幼苗叶片H2O2和-OH含量的影响Figure 3 Effect of exogenous ALA (5-aminolevulinic acid) on the contents of H2O2 and -OH in alfalfa seedling leaves
2.5 喷施ALA对紫花苜蓿幼苗叶片中可溶性蛋白含量的影响
喷施ALA后,紫花苜蓿“农牧806”叶片中可溶性蛋白含量与对照相比升高,并在5 mg·L-1ALA浓度增加至最大,比对照增加了3.02% (图5)。随着ALA浓度增加“农牧806”叶片中可溶性蛋白含量逐渐降低,ALA浓度为20 mg·L-1时其含量降至最低,与对照相比降低了8.97%。
3 讨论
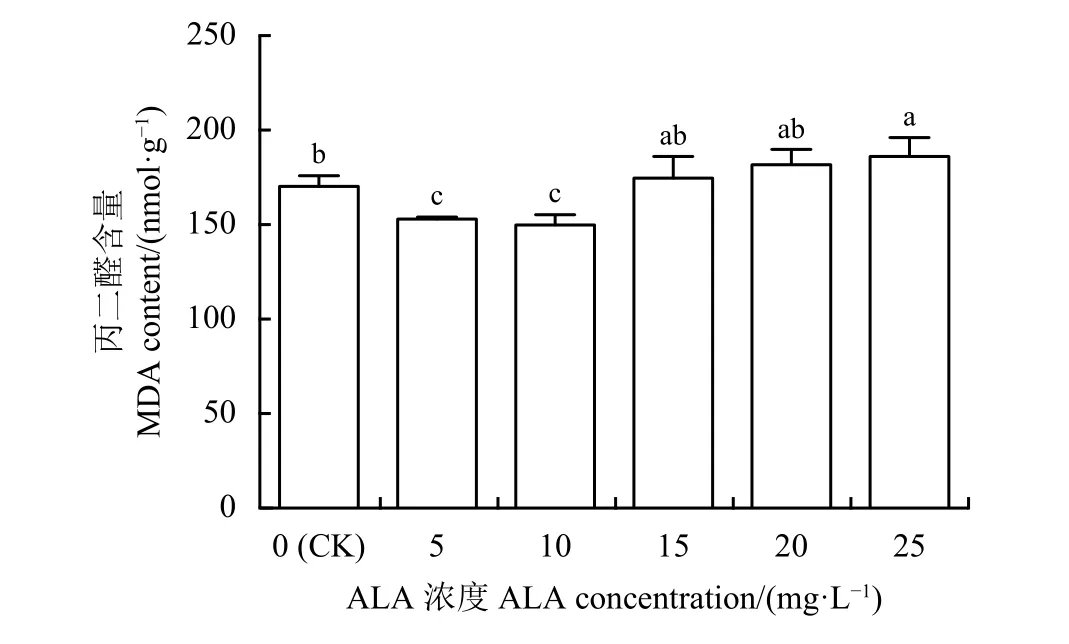
图 4 喷施5-氨基乙酰丙酸(ALA)对紫花苜蓿幼苗叶片丙二醛含量的影响Figure 4 Effect of exogenous ALA (5-aminolevulinic acid)on the MDA content of alfalfa seedling leaves

图 5 喷施5-氨基乙酰丙酸(ALA)对紫花苜蓿幼苗叶片可溶性蛋白含量的影响Figure 5 Effect of exogenous ALA (5-aminolevulinic acid)on the soluble protein content of alfalfa seedling leaves
ALA 是叶绿素等卟啉化合物生物合成的关键前体,植物遭受逆境胁迫时,ALA参与植物的细胞代谢及生理过程[19]。研究表明,ALA是植物叶绿素合成的一个部分,可以提高植物的光合速率[20-21]。张春平等[22]研究发现,喷施不同浓度的ALA处理后,NaCl胁迫下黄连(Coptis chinensis)幼苗叶片中光合色素的含量显著提高。本研究表明,喷施低浓度(5~10 mg·L-1) ALA可以促进紫花苜蓿幼苗叶片中Chl a、Chl b、Chl a + b、Car的合成,而喷施高浓度(15~25 mg·L-1) ALA会抑制紫花苜蓿叶片中光合色素合成。产生这一现象的原因可能是由于外源ALA提高了紫花苜蓿叶片的净光合速率和气孔导度,促进了紫花苜蓿叶片中光合色素的积累。这与卢克欢等[23]提出的ALA可以调节植物叶绿素合成的观点相一致。
当植物长期处于逆境中时,植物中的抗氧化系统发挥作用,使得植物细胞中活性氧产生与清除能够保持平衡;而当逆境胁迫加重、细胞失水达到一定程度时,细胞中产生的活性氧超出清除系统的能力,植物就会产生氧化损伤[24]。本研究结果表明,喷施低浓度的外源ALA (5~10 mg·L-1)后,紫花苜蓿“农牧806”叶片中APX、CAT、POD和SOD的活性显著升高,而H2O2、-OH含量则与抗氧化酶活性变化相反,其含量显著降低。与对照相比,喷施10 mg·L-1ALA后,紫花苜蓿“农牧806”叶片中APX、CAT、POD和SOD的活性达到最大值。而喷施高浓度ALA (15~25 mg·L-1)后,紫花苜蓿“农牧806”叶片中APX、CAT、POD和SOD的活性与对照相比显著降低,H2O2、-OH含量则显著升高,这表明高浓度的ALA不利于紫花苜蓿的生长。这与偶春等[9]的研究结果相一致。
MDA是膜脂过氧化最重要的产物之一,当植物处于不利环境中时,MDA含量可作为组织中自由基形成的可靠指标,通过植物体内MDA含量的变化了解组织中膜脂过氧化程度,以间接测定植物的抗逆性程度[25]。本研究表明,喷施低浓度的ALA后,紫花苜蓿幼苗叶片中MDA含量降低,随着ALA浓度的增加,MDA含量逐渐升高。说明适度的ALA处理能够减轻紫花苜蓿幼苗叶片中膜脂过氧化的产生,从而可以缓解逆境对紫花苜蓿细胞膜造成的伤害。
可溶性蛋白是植物体内重要的渗透调节物质之一。有研究表明,当植物受到非生物因子胁迫时,可溶性蛋白含量会增加来提高细胞液的渗透压,保护和调节植物的正常生长[9]。本研究发现,低浓度的ALA处理诱导了紫花苜蓿渗透调节物质的合成,导致紫花苜蓿“农牧806”幼苗叶片中可溶性蛋白含量升高。这与孙阳等[26]、周贺芳等[27]研究发现,喷施ALA可显著增加玉米(Zea mays)、甜瓜(Cucumis melo)等幼苗叶片内可溶性糖和可溶性蛋白含量。本研究与他人的研究结果相似。
4 结论
不同浓度的外源ALA对紫花苜蓿幼苗叶片的光合色素、抗氧化酶活性、过氧化系统、渗透调节物质影响不同。喷施适度的ALA(5~10 mg·L-1)可以提高紫花苜蓿“农牧806”幼苗叶片中Chl a、Chl b、Chl a + b、Car、SP的含量以及APX、SOD、POD、CAT的活性而降低过氧化系统(H2O2、-OH)以及MDA的含量。喷施高浓度(15~25 mg·L-1)的ALA抑制紫花苜蓿幼苗叶片中光合色素的合成,不利于紫花苜蓿“农牧806”的生长。
