常压室温等离子体诱变选育低产挥发酸酿酒酵母
2019-12-04刘延琳
陈 雪,冯 莉,秦 义,2,刘延琳,2*
(1.西北农林科技大学 葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
冰葡萄酒俗称冰酒,指在气温低于-7 ℃条件下,葡萄经过自然冷冻、采摘、压榨、浓缩后酿造的葡萄酒[1-2]。其酒色如金,具有花香、柑橘和蜂蜜等类香气,口感圆润,久有余香[3-4],但在冰酒的生产过程中存在挥发酸(volatile acid,VA)含量高的问题,国际和加拿大的法律规范允许冰酒中最高VA含量为1.3 g/L[1],我国国标GB/T 25504—2010《冰葡萄酒》要求冰酒中VA含量≤2.1 g/L。乙酸是葡萄酒中挥发酸的主要组成成分[5],对葡萄酒风味具有不良影响。多数冰酒的挥发酸超标,影响冰酒的香气,破坏冰酒的质量。
冰葡萄汁经冷冻浓缩后含糖量和含酸量高,致使在冰酒的酿造过程中,酿酒酵母(Saccharomyces cerevisiae)细胞失水收缩,生长和糖代谢速率变缓。甘油可防止水流出,对酵母具有保护作用,所以在高渗透压环境下,酵母激活高渗甘油(high osmolarity glycerol,HOG)途径,高产甘油[6]。而酵母为维持体内的氧化还原平衡,会合成更多的挥发酸[7],降低冰酒的香气,对酒的质量存在负面影响[8]。有研究表明,菌株、发酵温度[9]及培养基[10]等因素都会影响挥发酸的产量,但酵母菌种对冰酒挥发酸含量的影响最大[11]。因此,选育低产挥发酸的酿酒酵母具有重要应用推广价值。CORDENTE A G等[12]获得一株低产乙酸的YAP1突变菌株;何娟等[13]对冰酒中分离的酵母菌进行基因分型,为筛选本土优良冰酒酵母打下基础。但在冰酒中应用的酿酒酵母的选育研究尚鲜有报道。因此,选育低产挥发酸的酿酒酵母对冰酒的酿造具有重要意义。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术具有突变率高、突变遗传较稳定、操作简便等优点[14],广泛应用于微生物育种[15-16]。因此,本研究以发酵性能优良却高产挥发酸的酿酒酵母NX4为原始菌株,采用ARTP诱变技术选育低产挥发酸酿酒酵母,并对其遗传稳定性及耐受性进行分析。同时,应用该突变菌株酿造冰葡萄酒,对其理化指标、感官品质及挥发性风味物质进行分析,以期获得具有推广价值的优良酿酒酵母菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母NX4:从宁夏广夏三基地赤霞珠自然发酵过程中分离,保存于西北农林科技大学葡萄酒学院;商业菌株F15:法国LAFFORT公司。
1.1.2 试剂
葡萄糖、果糖、2-脱氧葡萄糖(2-deoxyglucose,2-DG)、2,4-二硝基苯酚(2,4-dinitrophenol,2,4-DNP)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,3,5-DNS)、2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)(分析纯):北京索莱宝科技有限公司;K-GCROLGK甘油检测试剂盒:爱尔兰Megazyme公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母浸粉1%,葡萄糖2%,蛋白胨2%,121 ℃灭菌20 min。固体培养基加琼脂2%。
2-DG培养基[17]:酵母浸粉1%,蛋白胨2%,葡萄糖8%,2-DG 0.015%,琼脂2%。
2,4-DNP培养基[18]:葡萄糖2%,无氨基酸酵母氮源(yeast nitrogen base without amino acids,YNB)0.67%,2,4-DNP 0.002 2%,琼脂2%。
TTC培养基[19]下层:酵母浸粉1%,蛋白胨2%,葡萄糖2%,琼脂2%;上层:TTC 0.05%,葡萄糖0.5%,琼脂1.5%,115 ℃灭菌30 min。
冰酒模拟汁[1]:葡萄糖200 g/L,果糖200 g/L,L-苹果酸4.5 g/L,柠檬酸0.3 g/L,酒石酸4.5 g/L,硫酸铵2 g/L,YNB(不含硫酸铵)1.7 g/L,Tween 80 1 mL/L,油酸5 mg/L,pH值3.2,0.22 μm滤膜过滤除菌。
威代尔冰葡萄汁:总糖含量350.2 g/L,总酸(以酒石酸计)含量15.7 g/L,pH值2.9。添加250 mg/L(NH4)2SO4补充氮源,同时加250 μL/L二氨基二环己基甲烷灭菌,静置过夜。
1.2 仪器与设备
MANDELA ARTP诱变仪:北京艾德豪克国际技术有限公司;LC-10ATVP液相色谱仪:日本岛津公司;SBA-40E生物传感分析仪:山东省科学院生物研究所;QP2010Plus气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:日本岛津公司。
1.3 方法
1.3.1 常温室压等离子体诱变
将菌株NX4接种于YEPD固体培养基上,30 ℃条件下培养2 d。挑取单菌落于YEPD液体培养基中,30 ℃培养16 h。用无菌生理盐水将培养至对数期的酿酒酵母NX4制备成菌悬液(1×107CFU/mL),分别在ARTP仪下诱变处理0、5 s、15 s、20 s、40 s、60 s、80 s、100 s、120 s后,稀释涂布于YEPD固体培养基上,30 ℃条件下培养2 d。对平板进行菌落计数,以未处理为对照计算致死率,获得致死曲线,进而确定最佳诱变处理时间。
1.3.2 低产挥发酸突变菌株的筛选
平板初筛:诱变后的菌悬液稀释涂布于2-DG、2,4-DNP和TTC培养基平板,30 ℃条件下培养2 d,挑取2-DG、2,4-DNP培养基平板上的大菌落和TTC培养基平板上的白色菌落,保存。
冰酒模拟汁发酵复筛:将初筛获得的突变菌株接种于10 mL冰酒模拟汁中,接种量5×105CFU/mL,于20 ℃、100 r/mim条件下培养10 d,采用高效液相离子排阻色谱法测定乙酸含量。将初筛获得的突变菌株接种于300 mL冰酒模拟汁中,20 ℃条件下发酵,当酒精度达到9%vol~14%vol时,测定发酵液的基本理化指标(挥发酸含量、残糖量、总酸含量、酒精度)。
1.3.3 遗传稳定性的测定
将最终筛选得到的突变菌株进行传代培养,取5代和10代菌体接种于冰酒模拟汁中,20 ℃条件下发酵20 d,测定挥发酸含量。
1.3.4 耐受性的测定
将最终筛选得到的突变菌株分别接种于含不同酒精度(12%vol、14%vol、16%vol、18%vol)、SO2(400 mg/L、500 mg/L、600 mg/L)、葡萄糖(300 g/L、400 g/L、500 g/L)的YEPD培养基,接种量为5×106CFU/mL,25 ℃静置培养,每隔4 h观察产气,发酵3 d后测定OD600nm值,考察突变菌株的酒精、SO2及糖耐受性。将最终筛选得到的突变菌株接种于YEPD培养基,接种量为5×106CFU/mL,于20 ℃、14 ℃、8 ℃和4 ℃条件下恒温静置培养,每隔4 h观察产气,发酵3 d后测定OD600nm值,考察菌株的低温耐受性。
1.3.5 威代尔冰葡萄汁发酵
将复筛获得的突变菌株、原始菌株NX4及商业菌株F5分别接种于800 mL威代尔冰葡萄汁中,接种量5×105CFU/mL,18 ℃静置发酵。当酒精度达到9%vol~14%vol时,添加SO2至终质量浓度为50 mg/L,4 ℃终止发酵,测定冰葡萄酒的基本理化指标。4 ℃陈酿6个月后测定挥发性风味物质,并对其进行感官评价。
1.3.6 测定方法
乙酸含量[20]:采用高效液相离子排阻色谱法进行测定。残糖、总酸和挥发酸含量:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定,总酸以酒石酸计,挥发酸以醋酸计。酒精度:采用生物传感分析仪测定。甘油:参照文献[21]的方法测定。
感官评分:选取15名经过培训的品尝员,参照GB15037—2006《葡萄酒》从外观、香气、口感、品质4方面对冰葡萄酒进行感官评分,满分100分。
挥发性物质:采用搅拌棒萃取法提取发酵液中的香气物质,采用GC-MS方法测定,具体方法参照文献[22]。
2 结果与分析
2.1 常温室压等离子体诱变时间的确定
酿酒酵母NX4经ARTP诱变处理后的致死曲线见图1。由图1可知,当诱变时间为65 s时,致死率为92.73%,在85%~95%之间,因此,确定最佳诱变处理时间为65 s。

图1 常温室压等离子体诱变后酿酒酵母NX4的致死率曲线Fig.1 Lethal rate curve of Saccharomyces cerevisiae NX4 induced by atmospheric and room temperature plasma
2.2 低产挥发酸酿酒酵母的筛选
诱变后的酿酒酵母NX4在2-DG培养基、2,4-DNP培养基和TTC培养基的生长情况见图2,挑选2-DG培养基、2,4-DNP培养基平板上的大菌落和TTC平板上的白色菌落共260株保存。

图2 常温室压等离子体诱变后酿酒酵母NX4在2-DG(a)、2,4-DNP(b)和TTC平板(c)上的菌落形态Fig.2 Colony morphology of Saccharomyces cerevisiae NX4 induced by atmospheric and room temperature plasma on 2-DG (a),2,4-DNP (b) and TTC plate (c)
初筛得到的突变菌株经10 mL冰酒模拟汁发酵后,从中筛选出9株低产乙酸的突变菌株,分别为菌株T2-5、T2-20、T2-30、T2-42、T3-38、T3-47、2DG136、DNP2-72 和T3-10,其乙酸产量见表1。由表1可知,突变菌株的乙酸产量为2.20~2.45 g/L,较原始菌株NX4(2.90 g/L)降低15.52%~25.5%。
9株筛选菌株经过300 mL冰酒模拟汁发酵后,测定发酵液的基本理化指标,结果见表2。由表2可知,突变菌株T2-5的挥发酸产量最低,为2.40 g/L,较原始菌株NX4降低23.1%。与原始菌株NX4相比,其总酸含量降低9.4%,酒精度和残糖量无显著差异(P<0.05)。因此,选择突变菌株T2-5为目标菌株进行进一步研究。

表1 低产乙酸突变菌株的筛选结果Table 1 Screening results of low-yield acetic acid mutant strains

表2 冰酒模拟汁发酵样的基本理化指标Table 2 Basic physical and chemical indexes of ice wine simulation juice fermentation samples
2.3 突变体菌株T2-5的遗传稳定性
突变菌株T2-5经连续传代培养后,选取传代5次和10次的菌株发酵冰酒模拟汁,测定挥发酸含量,结果见图3。
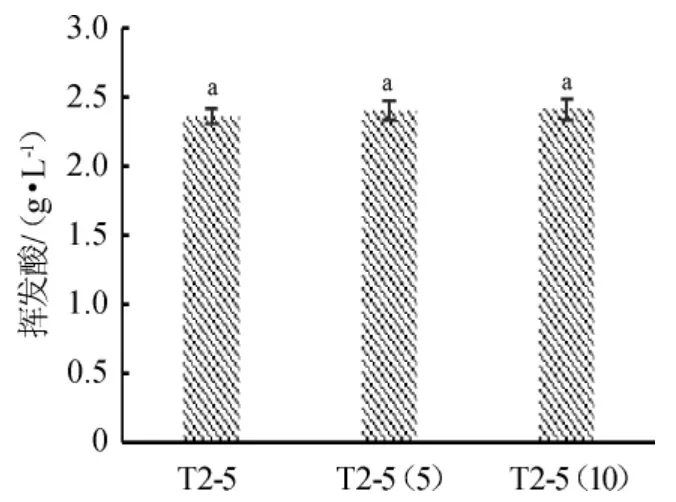
图3 突变菌株T2-5的遗传稳定性Fig.3 Genetic stability of mutant strain T2-5
由图3可知,突变菌株T2-5传代5次和10次后挥发酸产量无显著差异(P>0.05)。结果表明,突变菌株T2-5具有良好的遗传稳定性。
2.4 突变体菌株T2-5的耐受性
突变菌株T2-5的酒精、SO2、糖和温度耐受性测定结果见表3及图4。由表3及图4可知,原始菌株NX4的酒精耐受性显著高于突变菌株T2-5(P<0.05),SO2耐受性无明显差异(P>0.05)。突变菌株T2-5在糖含量为300 g/L时,菌体量显著高于原始菌株NX4(P<0.05);而在糖含量为400 g/L和500 g/L时,菌体量较原始菌株NX4低,但产气较快,表明其具有较好的糖耐受性。突变菌株T2-5在低温耐受性上弱于原始菌株NX4,但差异不显著(P>0.05)。结果表明,突变菌株T2-5具有较低的酒精耐受性,利于冰酒发酵到适宜酒精度后发酵终止,其所具有的高糖耐受性,有利于顺利启动冰酒发酵。

表3 以产气特征为评价指标突变菌株T2-5的耐受性Table 3 Tolerance of mutant strain T2-5 using gas production characteristic as evaluation index

图4 以OD600nm值为评价指标突变菌株T2-5的酒精(A)、二氧化硫(B)、糖浓度(C)和温度(D)耐受性Fig.4 Alcohol (A),SO2(B),sugar content (C) and temperature (D) tolerance of mutant strain T2-5 using OD600nmvalue as evaluation index
2.5 冰葡萄酒制备
2.5.1 冰葡萄酒的基本理化指标
分别采用突变菌株T2-5、原始菌株NX4及商业菌株F15发酵威代尔冰葡萄汁制备冰葡萄酒,测定冰葡萄酒的基本理化指标,结果见表4。由表4可知,与原始菌株NX4相比,突变菌株T2-5发酵的冰葡萄酒的挥发酸含量降低26.4%,其他指标均无显著差异(P>0.05)。与商业菌株F15相比,基本理化指标均无显著差异(P>0.05)。

表4 冰葡萄酒的基本理化指标Table 4 Basic physical and chemical indexes of ice wine
2.5.2 冰葡萄酒的感官评价
冰葡萄酒陈酿6个月后,选取15位感官品尝员对其进行感官评价,结果见表5。由表5可知,突变菌株T2-5发酵的冰葡萄酒呈浅金黄色,澄清;香气浓郁度中等,具有典型的花香、蜂蜜、蜜桃、柠檬、甜瓜等热带水果香气,淡淡的饼干味,香气持久;口感适中平衡,品质好。其感官评分最高,为77.14分,优于其他两个冰葡萄酒样。

表5 冰葡萄酒的感官评分Table 5 Sensory evaluation score of ice wine
2.5.3 冰葡萄酒中挥发性物质的测定
冰葡萄酒中挥发性物质的测定结果见表6。由表6可知,从3种冰葡萄酒共检出29种挥发性物质,包括高级醇类、酯类、酸类、萜烯类和醛酮类等物质。
与菌株F15酿造冰葡萄酒相比,菌株T2-5酿造冰葡萄酒检出的香气种类较多。菌株T2-5酿造冰葡萄酒具有更多的乙酸己酯、棕榈酸乙酯、辛酸、壬酸、肉豆蔻酸等酸类以及萜烯类和醛酮类香气物质。
与菌株NX4酿造冰葡萄酒相比,菌株T2-5酿造冰葡萄酒的甜果类香气略高,高级醇类、酯类香气物质的含量略低,但差异不大,主要包括异戊醇、乙酸异戊酯、乙酸己酯、乙酸庚酯、己酸乙酯、庚酸乙酯等香气物质,使得菌株T2-5酿造冰葡萄酒在菠萝、香蕉、玫瑰花等香气上浓郁度略降低,这与感官品尝结果一致。在酸类香气上,菌株T2-5酿造冰葡萄酒明显低于菌株NX4酿造,主要包括辛酸、壬酸、癸酸、9-癸烯酸等香气物质。菌株T2-5酿造冰酒具有更为优雅的淡淡的奶油香气,出现酸败、粗糙不适的香气缺陷风险很小。同时菌株T2-5酿造冰酒具有更高浓度的1-辛烯-3-醇、苯乙醇、玫瑰醚、十一醛等香气物质,弥补玫瑰类、具有更浓郁的薰衣草等清甜类的花香。

表6 冰葡萄酒中挥发性风味物质的测定结果Table 6 Determination results of volatile flavor compounds in ice wine

续表
3 结论
酿酒酵母NX4经ARTP诱变后,利用平板初筛、冰酒模拟汁发酵复筛获得一株低产挥发酸的突变菌株T2-5,其具有良好的遗传稳定性,更高的糖耐受性和更低的酒精耐受性,利于在冰酒中应用。与原始菌株NX4相比,利用该突变菌株酿造的冰酒挥发酸含量降低26.4%,感官评分较高(77.14分),香气浓郁度有所降低,但持久性增强,具有典型的花香、蜂蜜、蜜桃、柠檬、甜瓜等果香,口感更丰富圆润,品质有所提高。其中高级醇类、酯类物质浓度略低,酸类明显降低,同时,具有更高浓度的1-辛烯-3-醇、苯乙醇、玫瑰醚、十一醛等香气物质。
