力竭对训练小鼠肝线粒体蛋白质组表达的影响
2019-11-29简晓依刘祥梅成丹李苗芳赵素萱
简晓依, 刘祥梅, 成丹,李苗芳,赵素萱
湖南师范大学体育学院, 湖南 长沙 410012
肝脏是人体内最大的腺体和功能最复杂的器官之一,诸多研究表明其可因力竭运动损伤.运动对肝脏结构和功能产生影响的重要原因之一是肝线粒体的结构和功能变化,适当运动有利于大鼠肝线粒体产生ATP,力竭运动影响ATP合成[1~3].蛋白质是人体结构的重要组成部分和生命活动的直接执行者,线粒体蛋白质组的研究分析将提供洞察其功能变化有价值的信息,对探究运动影响机体的过程和机制有重要作用.已有的研究证明,三周游泳训练与安静控制组小鼠肝线粒体蛋白质组差异表达明显,特别是热休克蛋白60(HSP60)、乙醛脱氢酶2(ALDH2)和细胞色素b-c1复合体1(QCR1)表达上调,有保护线粒体和加强能量代谢电子传递过程的作用,这与适宜运动益于肝脏关系密切[4].而基于蛋白质组差异表达研究力竭运动对训练机体肝线粒体影响的报导尚未查到,本研究采用2-DE电泳凝胶图像分析三周训练及训练后力竭小鼠的肝线粒体蛋白质差异表达,质谱鉴定典型差异表达蛋白点,试图探讨有训练机体力竭运动后肝线粒体功能变化机制和为肝脏保健提供依据.
1 材料与方法
1.1 实验动物与运动方案
健康雄性ICR小鼠,体重30±2 g,购自湖南斯耐克景达实验动物有限公司,许可证号SCXK(湘) 2011-0003.以国家标准啮齿类动物饲料分笼饲养,自由饮食饮水.室温20±2 ℃,相对湿度40 %~55 %,每天光照12 h.小鼠静养与观察三日,按体重分层随机分为训练组(TB)和训练力竭组(TA),每组10只.
两组小鼠放入深80 cm、直径55 cm桶内游泳,水温28±2 ℃、水深40 cm,计时并注意观察状态.第一周不负重30 min,第二周尾根部2 %负重40 min,第三周3 %负重40 min.每周五天,下午进行,共进行三周.训练结束休息2天,TA组小鼠尾根部负重3 %力竭游泳,记录游泳至力竭时间.力竭判断标准:小鼠沉入水中10 s,放在平面时呼吸深急,神情疲倦,垂头俯卧,刺激后无反应,无法完成翻正反射.
1.2 仪器设备和试剂
EPS 3500电源,IPGphor等电聚焦电泳系统购自Amersham公司;聚丙烯酰胺凝胶电泳使用垂直平板电泳系统,购自bio-rad公司.其他仪器,如冷冻离心机,722分光光度计,电动跑台,脱色小摇床,真空自动吸引器均来自国产.脲素,二硫苏糖醇(DTT),硫脲,NP-40,载体两性电解质(Parmalyte 3~10),PMSF,CHAPS,Tris,SDS,碘乙酰胺,溴酚蓝,丙烯酰胺,N.N′-亚甲双丙烯酰胺,N′,N′,N′,N′-四甲基乙二胺(TMDEM),过硫酸胺(AP)购自Bio-rad公司;硫代硫酸钠来自Fluka公司;IPG buffer pH 3~pH 10和固相pH梯度等电聚焦干胶条(Immobiline dry strip pH 3~pH 10、长度18 cm)购自Pharmacia公司;其他试剂为国产分析纯.胞浆和线粒体蛋白提取试剂盒、非干扰型蛋白浓度定量试剂盒(SK3071)及质谱检测仪器与试剂由生工生物工程(上海)股份有限公司提供.
1.3 取材与样品制备
TB组训练结束休息2天,TA组力竭游泳24 h后,称取体重和麻醉,在冰上剖开腹腔,迅速取右肝前叶,放入预冷的冰生理盐水中清洗,滤纸吸干水分,严格按照胞浆和线粒体蛋白提取试剂盒和非干扰型蛋白浓度定量试剂盒(SK3 071)的操作说明提取肝线粒体蛋白,组内合并上清对蛋白定量,TB组蛋白浓度为30 μg/μL,TA组为29 μg/μL.各组提取液每管依蛋白质浓度1 mg 分装,保存在-80 ℃超低温冰箱备用.
1.4 固相pH梯度-SDS双向凝胶电泳及图谱分析
一维电泳:每组样品蛋白保证每个胶条有1 mg的蛋白质分子的含量,分别加入水化液至350 μL [水化液为urea 12 g(终浓度8 mol·L-1),CHAPS 0.5 g,IPG Buffer(pH 3.0~pH 10.0) 500 μL,1 %溴酚蓝50 μL,加双蒸水至25 mL],把在室温中平衡10 min的固相pH梯度干胶条放入加有上述样品液的样品槽.电压时间积为4 189 Vh, 30 V低电压水化13 h,500 V 1 h,1 000 V 1 h,最后稳定在8 000 V 5 h等电聚焦,温度设置为20 ℃.等电聚焦结束后进行两次各15 min的平衡.
二维电泳:平衡结束后胶条转入二向SDS聚丙烯酰胺凝胶电泳,先进行4.8 %的浓缩胶电泳,电压为25 mA,时间约1 h,接着进行10 %分离胶电泳,电压为50 mA,时间约4 h.
电泳结束取下胶板,采用考马斯亮蓝G-250染色,运用清华紫光D3000图像扫描仪扫描凝胶.每组各重复电泳三次,都选取第一张胶为参考胶进行匹配.以TB组的蛋白质2-DE代表图谱作为参考胶,借助图像分析软件Bio-rad PDquest分析比较图谱的蛋白质斑点差异.
1.5 MS(质谱)鉴定
胶板平铺于玻璃板,采用取点器将5倍以上差异表达蛋白质点切下,去离子水反复冲洗10 min,置于EP管中,移液枪吸尽水分.由生工生物工程(上海)股份有限公司酶解后MALDI-TOF-TOF质谱检测.检测结果通过Mascot查询ncbi蛋白质数据库鉴定蛋白质,物种为小鼠.
2 结果
2.1 2-DE凝胶电泳扫描及图谱分析结果
在相同条件下电泳分离TB和TA组小鼠肝线粒体蛋白,所得2-DE凝胶经扫描和图谱分析,检测出蛋白质斑点数为TB组323±84个和TA组307±106个,匹配率分别为58±45 %和59±48 %.TA组和TB组差异表达蛋白质点263个,2倍以上差异点80个,其中上调点48个,下调点32个.差异表达5倍以上蛋白点6个,上调和下调点各3个(图1、表1).
2.2 MS质谱鉴定结果
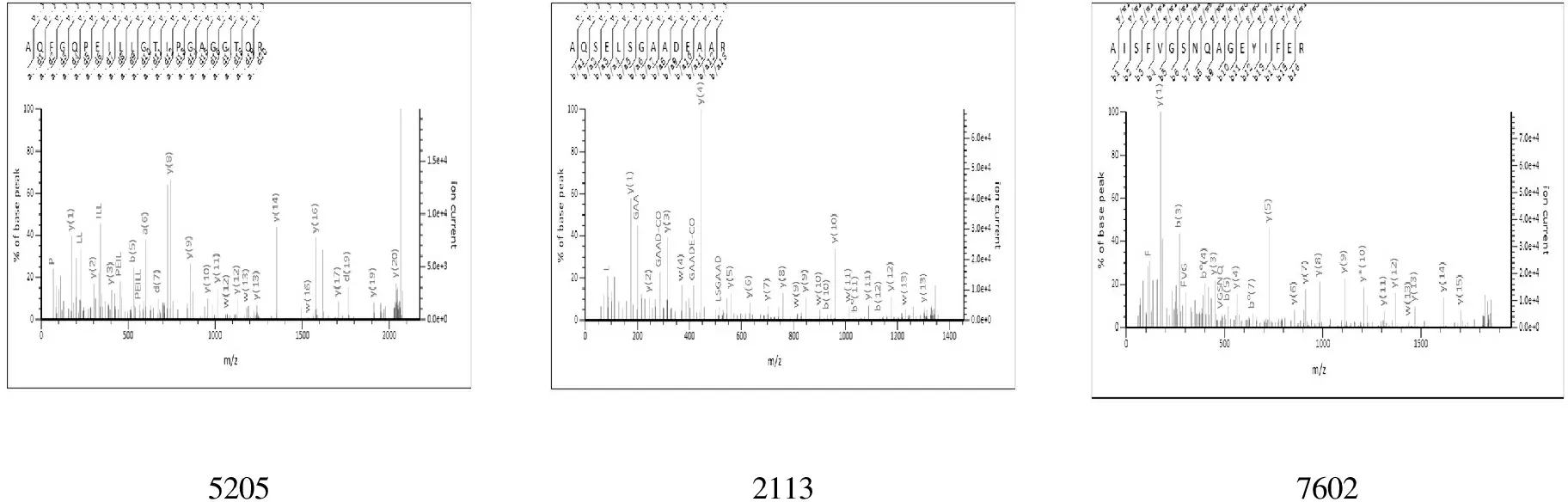
5倍以上差异点获成功鉴定的有5205号点、2113号点和7602号点,均为TA组比TB组下调的肝线粒体蛋白.5 205号点为烯酰辅酶A水合酶(Enoyl-CoA hydratase,ECHM),其138号肽段氨基酸序列为其特定序列158~178(K.AQFGQPEILLGTIPGAGGTQR.L),得分为139.2113号点为磷酸合成酶亚基δ(ATP synthase subunit delta,ATPD),其55号肽段氨基酸序列为其特定序列137~150(K.AQSELSGAADEAAR.A),得分为119.7 602号点为甲基丙二酸半醛脱氢酶(Methylmalonate-semialdehyde dehydrogenase[acylating],MMSA),其102号肽段氨基酸序列为其特定序列256~272(K.AISFVGSNQAGEYIFER.G),得分为149(图2、表2).

TB组TA组圆圈:上调 方块:下调
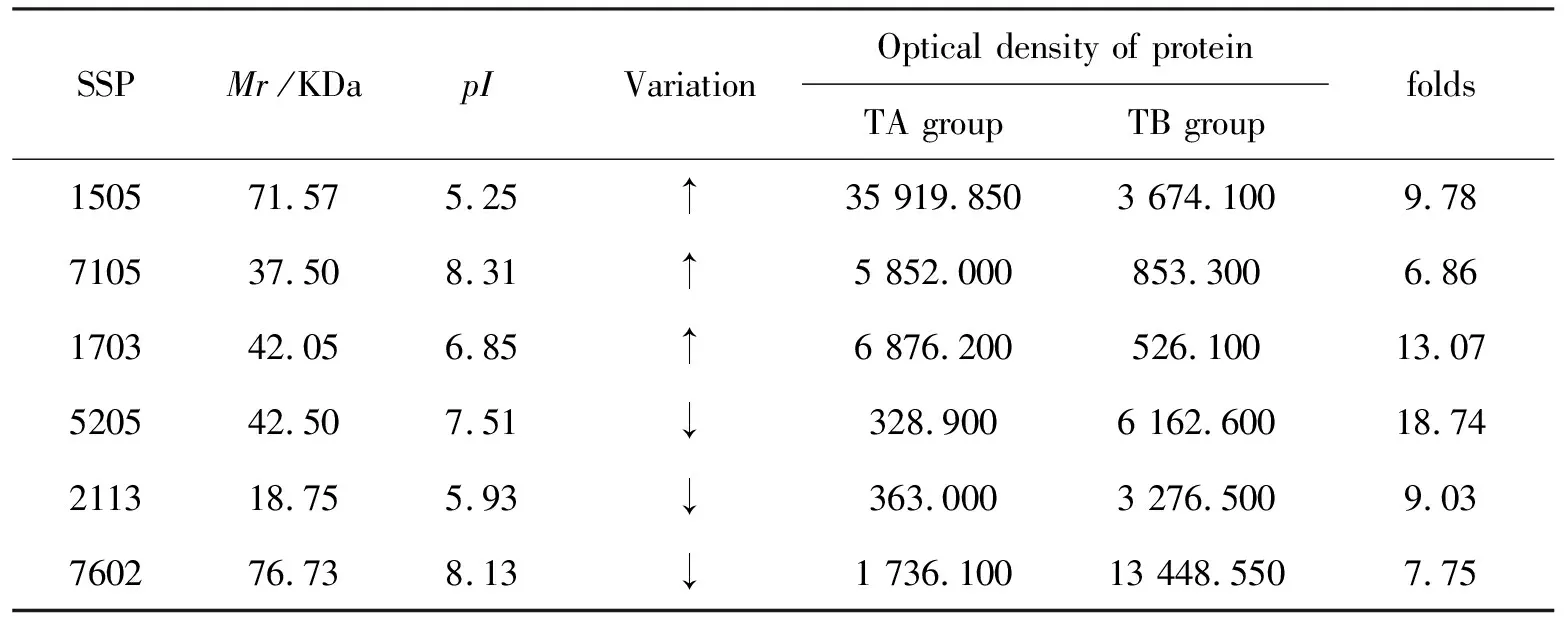
图1 TA和TB组凝胶扫描图谱及5倍差异表达蛋白点位置Fig.1 The Gel scanning Image of two groups and the location of 5 folds protein points
520521137602

图2 鉴定蛋白的特定氨基酸序列图Fig.2 The specific amino acid sequence diagrams of the identification protein
3 分析与讨论
目前,有关衰老、某些病理状况和治疗处理因素导致的肝线粒体蛋白质组表达变化有研究报道[5~8],促进了我们对生理病理和影响因素作用下肝脏结构和功能变化机制的深入理解.我们的研究证明,适宜运动有益于肝脏,与肝线粒体蛋白质组HSP60、ALDH2和QCR1显著上调关系密切[4].而本实验的训练小鼠进行力竭运动后24 h,肝线粒体差异表达的蛋白点263个,2倍以上差异点80个,5倍以上差异点6个,将影响机体肝线粒体功能.本实验质谱成功鉴定出了下调5倍以上的三个蛋白,它们为线粒体物质能量代谢相关的重要酶或亚基ECHM、ATPD、MMSA,对其表达变化分析能为力竭机体肝线粒体功能变化和肝脏保健提供理论依据.
5205号是烯酰辅酶A水合酶(Enoyl-CoA hydratase,ECHM/ECHS1/ECHA),也称脂酰辅酶A水合酶,为生物体内普遍存在和位于线粒体基质的脂肪酸β-氧化途径中的重要酶[9].线粒体中脂肪酸的氧化是能量提供的重要途径,尤其葡萄糖代谢水平下降的时候.而脂肪酸β-氧化是脂肪酸分解的主要途径,能很有效地供应机体所需的大量能量,其过程涉及多种相关酶,经重复脱氢、水合、再脱氢、硫解基本反应循环.ECHS1每个蛋白含有261个氨基酸亚基,是催化β氧化的关键酶和第二个限速步骤,对体内能量提供重要作用[10].它使反式烯脂酰辅酶A的双链上加上一分子水形成L(+)β-羟脂酰辅酶A,并催化3-顺-烯酰-CoA转化成3-反-烯酰-CoA或2-反-烯酰-CoA,使核黄素腺镖呤核苷酸(FAD)转变为还原型黄素腺嘌呤二核苷酸(FADH2),然后进入脂肪酸-β氧化.ECHS1在机体脂质代谢中发挥的作用非常重要,功能障碍会抑制线粒体中脂肪酸β氧化,进而导致肝内脂质沉积[11~13].NAFLD(非酒精性脂肪性肝病)是一种以肝细胞内脂质沉积为特征的疾病,发生的关键取决于脂质氧化、分解代谢及转运是否处于动态平衡,一旦这个平衡被打破可造成脂代谢紊乱.有研究证实,SHBs转染Hep G2细胞靶向下调ECHS1可在核酸水平使ACC、CPT1A表达上调,细胞培养液中转氨酶水平、细胞内胆固醇及甘油三酯含量均上调,关系到肝脏中脂质的蓄积[14].肝脏中脂肪堆积容易形成脂肪肝,有学者运用定量蛋白质组学技术发现NAFLD大鼠模型和患者的肝组织中ECHS1表达水平显著下降[15].钟小兰等发现束缚所致肝郁证的动物肝组织ECHM表达下调,认为机体代谢降低及肝细胞去分化的加强影响了该酶的诱导和对氧的消耗[16].有氧耐力训练能提高机体有氧代谢供给能力,袁爱国报道4周、8周和12周中等强度运动负荷训练的大鼠左心室肌ECHM均出现上调[17].理论上肝线粒体ECHM也应因运动训练上调,但相关研究报道尚未查到.本研究的训练小鼠一次力竭后24 h,肝线粒体ECHM的表达比单纯训练小鼠显著下调18.74倍.我们认为力竭消耗大量能源,使葡萄糖耗竭和糖代谢供能水平下降,机体脂肪酸β氧化供能成为主要途径,同时蛋白质的分解过程增强,脂肪酸β氧化过程的重要酶因而消耗、破坏增多和再合成减少导致了这一结果.提示有训练机体因力竭运动可使肝内脂肪酸β氧化障碍,而容易出现肝脏脂代谢异常,若膳食营养不合理尤其含脂量高,可能使肝内脂质蓄积产生脂肪肝病.因此,运动员应在剧烈运动比赛和体力过度消耗后特别注意膳食低脂.
2113号是磷酸合成酶亚基δ(ATP synthase subunit delta,ATPD).线粒体内膜有复合酶NADH还原酶、琥珀酸氧化还原酶、细胞色素C氧化还原酶、细胞色素C氧化酶和ATP合成酶,称为复合酶Ⅰ、Ⅱ、Ⅲ、Ⅳ和V.线粒体内膜上进行的氧化磷酸化和能量转化等通过呼吸链酶NADH呼吸链(主要有复合物Ⅰ、Ⅲ和Ⅳ)和FADH2呼吸链(主要有复合物Ⅱ、Ⅲ和Ⅳ),最终在ATP合成酶作用下细胞内热能代谢产物氧化生成水和能量,这一过程中任何复合酶质量改变都可能引起线粒体功能障碍.ATP合成酶是线粒体内膜突出于基质中的水溶性蛋白,参与ADP磷酸化与ATP合成,是合成ATP的关键蛋白.合成ATP的酶主要是F1F0型,由2个亚单位水溶性的F1和镶嵌在内膜上的脂溶性疏水蛋白复合体F0构成[18,19].F1部分由3α、3β、1γ、1δ和1ε共9个亚基组成,F0部分由a、b和c亚基组成.不同来源的ATP合成酶基本上有相同的多亚基组成和结构,F1的α和β亚基上均有核苷酸结合位点,其中β亚基的结合位点具有催化ATP合成或水解活性,为ATP合成酶功能催化亚基.F1中3个α和3个β亚基交替排列成“瓣状”圆球体结构,γ亚基与ε亚基结合在一起形成“转子”,位于α3和β3的中央,共同旋转以调节三个β亚基催化位点开放和关闭.Fo多拷贝的c亚基形成一个环状结构,a和b二聚体排列在c亚基环状外侧,a、b、δ亚基共同组成“定子”.在合成ATP的过程中,“转子”通过Fo形成一个跨膜质子通道,在氢离子流的推动下旋转,依次与三个β亚基作用,调节β亚基催化位点构象,“定子”在一侧将α3、β3与Fo连接,将跨膜质子动力势能转换成力矩,推动“转子”旋转,ADP与磷酸基团被催化结合成ATP[20].Rose等发现健康男青年单腿耐力训练后腿部肌肉线粒体F(1)-ATP合酶表达增加约两成,周锦琳等发现中等强度负荷运动后股四头肌H+-ATP酶活性增加约36 %[21,22].袁爱国报道,中等强度运动后大鼠左心室肌的ATP合酶α亚基表达显著上调,可提高心肌能量代谢水平[23].ATPD是磷酸合成酶F1部分的δ亚基,关系“定子”组成,运动对ATPD影响的研究报道尚未查到.本研究发现力竭使训练小鼠肝线粒体的ATPD表达量下调9.03倍,可能δ亚基严重不足,“定子”结构将形成减少和不稳定,将使α3、β3与Fo连接受限,跨膜质子动力势能转换成力矩推动“转子”旋转将受影响,ADP与磷酸基团被催化结合成ATP的效率降低,这可能是肝线粒体ATP生成减少和功能受影响的重要机制,并可能是力竭机体处于疲劳或功能性障碍状态的原因.
7602号是线粒体甲基丙二酸半醛脱氢酶【酰基】(Methylmalonate-semialdehyde dehydrogenase, MMSDH/ALDH6A1),分子量58.396 KDa,等电点8.44,为由535个氨基酸残基构成的四聚体酶蛋白.其位于线粒体基质空间,在肝脏、肾脏和心脏中高表达,在肌肉和脑组织中低表达,属于乙醛脱氢酶超家族,是唯一需要辅酶A的一类醛脱氢酶(ALDH)-ALDH6A1[24].MMSDH参与缬氨酸和胸腺嘧啶分解代谢分解:缬氨酸代谢产生(S)-3-羟基酸(HIBA),由3-羟基异丁酸脱氢酶氧化成(S)-甲基丙二酸半醛(methylmalonate semialdehyde,MMSA);胸腺嘧啶代谢生成(R)-氨基异丁酸(AIBA),然后脱氨基成(R)-甲基丙二酸半醛.MMSA的S和R两种异构体经MMSDH催化不可逆氧化脱羧,以丙二酸半醛(malonate semialdehyde,MSA)再不可逆氧化脱羧,分别成为乙酰辅酶A(acetyl-CoA)和丙酰辅酶A(propionyl-CoA,PPCoA),这些反应处于缬氨酸和嘧啶代谢途径的末端,是缬氨酸代谢过程中的关键酶之一[25~27].ALDH6A1通过代谢丙二酸半醛转变成乙酰辅酶A,包括脂质过氧化醛如丙二醛[24].柠檬酸循环是糖进行有氧氧化第三阶段的重要环节,影响氧化磷酸化的彻底氧化.MMSDH作为缬氨酸代谢过程中的关键酶之一,催化MMSA氧化脱羧形成的PPCoA在柠檬酸循环中转变成琥珀酰辅酶(succinyl CoA),琥珀酰辅酶作为磷酸化底物彻底分解产生琥珀酸和ATP.甲状腺切除的肾阳虚模型大鼠的肝线粒体蛋白质组与正常大鼠间具有差异,其中MMSDH属于显著表达上升蛋白,研究者认为是糖脂代谢障碍促使蛋白质氨基酸分解代谢加速的反映[28].运动机体MMSDH的研究报道有4周有氧运动后大鼠心房肌的表达上调6.3倍,说明4周有氧运动可能通过其表达加强心肌细胞线粒体的三羧酸循环,促进ATP的生成,改善心肌细胞能量需求以提高心肌抗氧化损伤的能力,从而发挥心肌延迟保护作用[29].本研究显示,力竭运动使训练小鼠肝线粒体MMSDH表达下调7.75倍,依据以上其与蛋白质氨基酸、丙二醛、柠檬酸代谢的关系分析可知:(1)力竭使训练小鼠能源耗竭,并且肝线粒体内缬氨酸代谢过程中的关键酶减少,蛋白质氨基酸分解代谢供能难以为继;(2)力竭使MMSA氧化脱羧形成的PPCoA减少,势必使肝线粒体柠檬酸循环速率降低,糖有氧氧化第三阶段障碍;(3)力竭运动产生大量的脂质过氧化醛如丙二醛,其转化消除形成障碍将导致其在体内堆积.因此,虽然适当运动利于肝线粒体ATP产生和减少脂质过氧化物的堆积,但力竭运动将使训练机体能源耗竭、肝线粒体涉及到蛋白质氨基酸的能量代谢酶的质与量改变和脂质过氧化损害增加,最终极度疲劳,这是力竭疲劳的重要机制之一.
4 结论
力竭将使训练小鼠的肝线粒体蛋白质组发生差异表达,能量代谢酶烯酰辅酶A水合酶、甲基丙二酸半醛脱氢酶和磷酸合成酶亚基表达明显下调.这三种酶或亚基的表达下调关系到肝脏线粒体糖、脂、蛋白代谢障碍和影响ATP生成,并可能伴随脂质过氧化代谢产物丙二醛及脂质在肝内堆积,这是力竭运动损害机体肝和肝线粒体功能,促使机体力竭疲劳的重要机制,并有可能增加罹患脂肪型肝病风险.
