超声波辅助提取鹅肝蛋白质及其物化性质和结构
2019-11-28王怡婷杨恒张新笑张坤王道营邹烨徐为民
王怡婷 杨恒 张新笑 张坤 王道营 邹烨 徐为民


摘要:鹅肝是肉制品加工过程中一种极为普遍的副产物,由于其含有十分丰富的营养,常常会被作为食物。但是只有小部分鹅肝被人们食用,大部分鹅肝被加工处理为动物饲料或是直接丢弃,从而造成了很严重的资源浪费。以鹅肝为原料,采用三羟甲基氨基甲烷(Tris)-HCl缓冲液中为提取剂,采用超声辅助法提取鹅肝蛋白质,并与常规水浴提取作比较。通过对比二者圆二色谱、傅里叶红外光谱、凝胶电泳等结果,研究超声辅助提取对鹅肝蛋白质结构的影响。结果表明,与常规水浴提取鹅肝蛋白质相比,超声处理引起部分蛋白质水解和折叠,导致其表面疏水性显著提高,蛋白质结构发生了改变。通过对鹅肝蛋白质进行凝胶电泳的测定,结果表明,超声辅助提取鹅肝蛋白质并没有改变鹅肝蛋白质的亚基组成。同时对溶解度、起泡性和乳化性质这些物化性质进行测定,发现鹅肝蛋白质在超声辅助提取下的物化性质明显提高。通过对鹅肝蛋白质性质的研究,希望能为鹅肝蛋白质的深加工提供一定的科学依据和理論基础,进一步提高鹅肝的利用率。
关键词:鹅肝蛋白质;超声辅助;物化性质;结构特性
中图分类号: TS251.1文献标志码: A
文章编号:1002-1302(2019)18-0240-07
收稿日期:2018-05-24
基金项目:国家现代农业(肉鸡)产业技术体系建设专项(编号:CARS-41);江苏省农业科技自主创新资金[编号:CX(16)1007];江苏省农业科学院基础研究基金[编号:ZX(16)2041]。
作者简介:王怡婷(1996—),女,江苏常熟人,主要从事农产品加工研究。E-mail:842358674@qq.com。
通信作者:邹 烨,博士,助理研究员,主要从事动物源食品加工与质量控制研究。E-mail:zouye@jaas.ac.cn。
鹅肝是一种营养丰富、附加值较高的肉制品加工副产物,是世界三大美食之一,同时也是一种极佳的滋养品[1]。鹅肝中富含营养素,如蛋白质、维生素、脂肪等,同时还含有人体所需的各种矿质元素,如铁、锌、铜、钾、磷、钠、硒等。鹅肝中的硒具有抗动脉粥样硬化的作用,同时硒对黄曲霉毒素B1的致癌性有破坏作用,可提高机体免疫力[2]。目前,我国的鹅肝一部分直接被食用,一部分用来加工成动物饲料,只有少量被深加工为鹅肝酱,因此造成大量鹅肝优质蛋白质资源的浪费。肝脏中的蛋白质被完全不同于肌肉蛋白质,肝脏蛋白质种类繁多,特性各异,有水溶性、盐溶性和不溶性蛋白质等,这也是肝脏蛋白质完全提取出来的难点。因此急需寻找合适、高效、环保的方法将鹅肝蛋白质提取出来。
目前,微波辅助提取法在蛋白质提取中被广泛使用。该方法通过高频电磁波穿透介质到达目标蛋白质内部,微波热能不断被细胞吸收,使得细胞内温度升高,细胞壁无法承受细胞内部带来的压力,进而破坏了细胞壁和细胞膜,使得有效成分在溶剂中的溶解速度加快,通过进一步分离和过滤,最终获得所需提取物[3]。超声波是一种安全高效的技术,超声辅助提取作为一种新型的非热物理加工技术,适用于不同来源的生物活性物质提取,特别是在蛋白质提取等食品领域具有广泛的应用前景,它在促进食品中有效成分的提取方面具有独特的优势,具有促进酶解、提高提取率、溶剂用量少和蛋白质提取率高等优点[4-5]。到目前为止,关于超声波对鹅肝蛋白质物化性质和结构特性的研究报道较少。因此,本研究采用超声辅助提取鹅肝蛋白质,并进一步对其理化性质进行分析,以期为肉制品加工副产物鹅肝蛋白质在食品等领域的潜在利用价值研究提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料
鹅肝蛋白质冻干品,由江苏省农业科学院农产品加工研究所畜禽产品加工研究室提供。
1.1.2 主要试剂
1-苯氨基-8-萘磺酸盐(ANS)、β-巯基乙醇[西格玛奥德里奇(上海)贸易有限公司];蛋白标记(上海源叶生物科技有限公司);磷酸氢二钠、磷酸二氢钠、尿素、氢氧化钠(西陇化工股份有限公司);考马斯亮蓝、三羟甲基氨基甲烷、甘氨酸、十二烷基硫酸钠(SDS,南京荣胜达实验仪器有限公司);盐酸(扬州沪宝化学试剂有限公司);三氯乙酸(TCA,上海凌峰化学试剂有限公司)。
1.1.3 试验仪器
FL-4600荧光分光光度计(日本日立高新技术公司);UV-6100型分光光度计(上海美普达仪器有限公司);Uncen MR台式冷冻离心机(英国Hero Lab公司);M124A电子天平(意大利倍尔公司);便携式pH计[美国奥豪斯仪器(上海)有限公司];T25 D S25高速粉碎机(德国IKA公司);STA-449C差示量热扫描仪(德国耐驰公司);Jasco-715圆二色谱仪[佳司科(上海)贸易有限公司];真空冷冻干燥机(德国Christ公司);HH-8数显恒温水浴锅、HJ-8(DF-1)集热式磁力搅拌器(江苏省常州国华电器有限公司)。
1.2 试验方法
1.2.1 鹅肝蛋白质的提取工艺
鹅肝脱脂。取一定量新鲜鹅肝(10 g)进行匀浆(8 819 r/min,30 s),在匀浆后的新鲜鹅肝中加入体积分数为10%的异丙醇脱脂,静置一段时间后,8 819 r/min 离心15 min,收集沉淀,干燥。
常规水浴提取。取10 g脱脂鹅肝,加入60 mL Tris-HCl(0.02 mol/L,pH值为8.0)缓冲液,在30 ℃下,磁力搅拌70 min。接着于8 819 r/min离心15 min。最后将上清液真空冷冻干燥44 h,得到常规水浴提取的鹅肝蛋白质。
超声辅助提取。取10 g脱脂鹅肝,加入60 mL Tris-HCl(0.02 mol/L,pH值为8.0)缓冲液,在超声波提取仪中提取一定时间(70 min,240 W,100 Hz,30 ℃)。接着于8 819 r/min 离心15 min。最后将上清液真空冷冻干燥44 h,得到超声辅助提取的鹅肝蛋白质。
1.2.2 鹅肝蛋白质性质的测定
1.2.2.1 鹅肝蛋白质的凝胶电泳测定
制备12%分离胶和5%浓缩胶,在常规水浴提取和超声辅助提取的鹅肝蛋白质中加入上样缓冲液,沸水浴10 min,于9 661 r/min离心3 min。取15 μL上清液上样。采用蛋白marker(10~180 ku)作为对照,加入1 L电泳缓冲液,电泳先在电流为16 mA的条件下进行15 min,然后再在32 mA下进行1 h。电泳结束后,采用考马斯亮蓝染色20 min,通过脱色液进行脱色,直至可以清楚辨别条带为止。
1.2.2.2 鹅肝蛋白质的傅里叶红外光谱测定
将常规水浴提取的鹅肝蛋白质和超声辅助提取的鹅肝蛋白质用傅立叶红外光谱分析仪进行测定。扫描条件:扫描范围为650~4 000 cm,扫描264次,分辩率为4 cm。
1.2.2.3 鹅肝蛋白质的差式扫描量热(DSC)测定
称取3~6 mg鹅肝蛋白质样品,用差示量热扫描仪进行扫描。在氮气环境下进行测定;扫描温度为20 ℃,扫描速度为5 ℃/min。
1.2.2.4 鹅肝蛋白质的圆二色谱测定
采用圆二色谱仪测定样品溶液的远紫外光谱变化。在1 mm厚的样品池中注入浓度为0.25 mg/mL的鹅肝蛋白质液样品。通过分光偏振计在20 ℃下于190~250 nm之间记录左旋和右旋圆偏振光吸收差,带宽为1.0 nm,扫描速率为100 nm/min。将磷酸盐缓冲液光谱作为空白从平均值中减去,获得每个样品的校正光谱,试验平行3次。
1.2.2.5 鹅肝蛋白质的荧光光谱测定
使用10 mmol/L磷酸盐缓冲液(pH值为7.0)制备0.2 mg/mL常规提取和超声辅助提取的鹅肝蛋白质溶液,用熒光分光光度计对这2种溶液进行测定。激发波长为290 nm,发射波长范围为300~460 nm,狭缝宽度为2.5 nm。
1.2.2.6 鹅肝蛋白质的扫描电镜测定
采用扫描电子显微镜对冷冻干燥后的常规水浴提取的鹅肝蛋白质和超声辅助提取的鹅肝蛋白质样品进行观测和摄图,对鹅肝蛋白质样品进行离子溅射仪真空干燥、金粉喷镀处理,将电镜加速电压调整为20 kV。
1.2.2.7 鹅肝蛋白质的表面疏水性
称取4 mg常规水浴提取的鹅肝蛋白质样品和超声辅助提取的鹅肝蛋白质样品,加入4 mL 0.01 mol/L磷酸盐缓冲液(pH值为7.0),配制成鹅肝蛋白质溶液。加入16 μL 8 mmol/L ANS磷酸盐缓冲液(pH值为7.0),混匀之后在室温下放置2 min。通过荧光分光光度计在激发波长371 nm、发射波长467 nm、扫描速率240 nm/min、狭缝宽度10 nm下测定荧光强度。以荧光强度为横坐标对鹅肝蛋白质浓度作图,外推至鹅肝蛋白质浓度为0,曲线的初始斜率即为鹅肝蛋白质的表面疏水性。
1.2.2.8 鹅肝蛋白质的自由巯基(SH)和总巯基的测定
自由巯基。取10 mg/mL鹅肝蛋白质液样品0.5 mL,然后迅速加入2.5 mL三羟基甲基氨基甲烷-甘氨酸-8M尿素(Tris-Gly-8M Urea)溶液和0.02 mL二硫代二硝基苯甲酸(DTNB)溶液(4 mg/mL),25 ℃保温反应25 min,在波长412 nm 下测定吸光度(D412 nm),以蒸馏水作为空白对照。作3次平行试验,取其平均值,并按式(1)进行计算:
自由巯基含量(μmol/g)=73.53D412 nm×D/C。(1)
式中:C为蛋白质样品的浓度,mg/mL;D为稀释因子,在对游离巯基的测定中D取6.04。
总巯基/二硫键(SS)。将0.2 mL鹅肝蛋白质液样品(10 mg/mL)、1.0 mL Tris-Gly-10M Urea溶液和0.02 mL β- 巯基乙醇混合均匀,在25 ℃水浴锅中保温反应1 h,然后在混合液中加入12%三氯乙酸溶液10 mL,接着继续在水浴锅中保温反应1 h。保温反应结束后用离心机于6 236 r/min 离心10 min,弃去上清液,用12%三氯乙酸溶液将沉淀物洗涤。在沉淀物中依次加入3.0 mL Tris-Gly-8M Urea、0.03 mL DTNB溶液,25 ℃保温反应25 min。最后在波长412 nm 下测其吸光度(D412 nm),以蒸馏水作为空白对照。作3次平行试验,取其平均值,并按式(2)进行计算:
总巯基含量(μmol/g)=73.53D412 nm×D/C。(2)
式中:D取15。
二硫键含量按式(3)计算:
二硫键含量(μmol/g)=(总巯基含量-游离巯基含量)/2。(3)
1.2.2.9 鹅肝蛋白质的溶解性测定
制备pH值分别为2.0、4.0、6.0、8.0、10.0、12.0的鹅肝蛋白质溶液。配制6份5 mg/mL鹅肝蛋白质液样品各25 mL于锥形瓶中,然后用适当浓度的HCl与NaOH溶液调节鹅肝蛋白质溶液的pH值。水浴摇床振荡(室温,1 247 r/min,30 min),最后于5 218 r/min 离心30 min。在595 nm下,用考马斯亮蓝法测定上清液蛋白质浓度。
1.2.2.10 鹅肝蛋白质的起泡性测定
配制4种不同浓度的鹅肝蛋白质溶液各50 mL,溶液浓度分别为0.1%、0.5%、1.0%、2.0%,将溶液pH值调为7.0,在30 ℃下磁力搅拌1 h,接着将溶液全部转移至100 mL量筒内,测定此时溶液的高度(h1),然后将溶液用匀质机在8 819 r/min下匀质30 s,立即测定搅拌后的高度(h2);再分别测量60 min后样品的高度(h3),计算起泡性和泡沫稳定性。
起泡性=h1h2×100%;(4)
起泡稳定性=h3h2×100%。(5)
1.2.2.11 鹅肝蛋白质的乳化性质测定
通过分光光度法测定常规水浴提取和超声辅助提取的鹅肝蛋白质的乳化性质。用鹅肝蛋白质样品和0.1 mol/L磷酸盐缓冲溶液配制鹅肝蛋白质溶液(1 g ∶20 mL)30 mL。接着加入玉米油,使混合液总体积为40 mL。将混合液用均质机于8 819 r/min均质1 min。乳状液静置待用。
取50 μL底部乳状液,加入4 950 μL 0.1%十二烷基硫酸钠溶液将鹅肝蛋白质稀释100倍。接着在500 nm处用分光光度计测定0 min时的吸光度D0(500 nm)和10 min时的吸光度D10(500 nm),以0.1%十二烷基硫酸钠溶液作空白对照,计算乳化活性指数(EAI)和乳化稳定性指数(ESI):
EAI(m2/g)=2×2.303C(1-)×10 000×D0(500 nm)×100;(6)
ESI(min)=10×D0(500 nm)D0(500 nm)-D10(500 nm)。(7)
式中:C为样品浓度;为大豆油的体积分数,%。
1.3 数据统计
上述所有试验均进行3次重复,结果表示为平均值±标准差。采用SPSS 18.0统计软件进行处理,Turkey检验用于2组间的数据分析,P<0.05表示2组之间具有显著性差异,采用Origin 9.0软件作图。
2 结果与分析
2.1 鹅肝蛋白质的凝胶电泳分析
通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析得到常规水浴提取和超声辅助提取的鹅肝蛋白质及其分离组分的亚基组成情况。由图1可知,常规水浴提取的鹅肝蛋白质与超声辅助提取的鹅肝蛋白质的所有条带基本相同,鹅肝蛋白质的亚基相對分子量主要集中在36~72 ku、17~30 ku。这个研究结果与Zhang等用超声处理提取花生蛋白质的电泳结果[6]是相似的,蛋白质条带均完整,且未发现额外碎的条带出现,说明鹅肝蛋白质的亚基组成并没有因超声处理而发生改变[7]。
2.2 鹅肝蛋白质的傅里叶红外光谱分析
傅里叶红外光谱法是分析蛋白质二级结构的一种常用方法。蛋白质的肽键是一种酰胺键,它在红外区有特征吸收峰,其中酰胺Ⅰ带对蛋白质结构分析最为重要,酰胺Ⅰ带在某种程度上可以反映蛋白质的二级结构,酰胺Ⅰ带上具有1个对蛋白质结构变化最为敏感的最大吸收峰(波数为1 648 cm-1),因此可通过红外光谱对鹅肝蛋白质的二级结构进行分析[8]。由图2可知,常规提取的鹅肝蛋白质和超声提取的鹅肝蛋白质在波数为1 500~1 700 cm-1之间具有相同特征的最大吸收峰。与常规提取的鹅肝蛋白质相比,超声提取的鹅肝蛋白质的二级结构变化更为明显。任晓峰采用双频超声处理玉米醇溶蛋白质在波数为1 648 cm-1 处具有相同特征最大吸收峰的结果与本研究结果是一致的,表明采用超声处理对鹅肝蛋白质的二级结构产生了重要影响[9]。
2.3 鹅肝蛋白质的差式扫描量热分析
鹅肝蛋白质经超声处理后,分子内部的氢键被打开,蛋白质结构遭到破坏,DSC可以用来测量蛋白质结构破坏过程中热焓值的变化趋势[10]。由图3可知,常规水浴提取的鹅肝蛋白质与超声辅助提取的鹅肝蛋白质都存在2个特征峰,超声辅助提取的鹅肝蛋白质没有因为超声波的处理而失去特征峰,并且超声辅助提取的鹅肝蛋白质热变性温度低于常规水浴提取的鹅肝蛋白质,说明超声提取的鹅肝蛋白质没有变性。由表1可知,常规水浴提取的鹅肝蛋白质的峰值温度为(128.1±4.8) ℃,热焓值为(39.8±1.9) ℃;超声辅助提取的鹅肝蛋白质的峰值温度为(115.0±3.3) ℃,热焓值为(30.1±1.6) ℃。与常规提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白质峰值温度降低了10.23%,热焓值下降了24.4%,二者间均具有显著性差异。可能的原因是蛋白质溶液中的聚集体因为经过了超声处理变得松散,在热变性过程中,蛋白质分子对温度的敏感程度增加,蛋白质的高级结构遭到破坏[11]。结果表明,超声处理可以使鹅肝蛋白质的热稳定性降低。
2.4 鹅肝蛋白质的圆二色谱分析
圆二色谱能够反映蛋白质主链肽键的构象,是检测蛋白质结构是否发生变化的重要指标,其远紫外图像(190~250 nm)能够提供蛋白质二级结构(α-螺旋、β-折叠、β-转角、无规卷曲)含量的信息(图4)[12-13]。由表2可知,与常规提取的鹅肝蛋白质相比,超声处理后鹅肝蛋白质的二级结构β-折叠的比例下降了31.7百分点,α-螺旋、无规卷曲的比例略有上升,分别上升了6.0、9.9百分点,β-转角的比例增加了15.7百分点。这与杨勇等采用超声处理绿豆蛋白质,α-螺旋含量下降,β-折叠、β-转角和无规卷曲含量增加的研究结果[14]相一致。冯景丽等利用超声处理酪蛋白质,导致α-螺旋和β-转角含量下降,这可能是由于经超声处理后,蛋白质分子内部氢键发生变化,导致部分蛋白质松散[15]。结果表明,超声处理会破坏鹅肝蛋白质的二级结构。
2.5 鹅肝蛋白质的荧光光谱分析
荧光光谱可以通过测定蛋白质中部分能产生荧光的氨基酸残基(色氨酸、酪氨酸、苯丙氨酸)来推测其蛋白质构象的变化趋势,是表征蛋白质分子构象发生变化的另一种手段[16],通过荧光强度和峰位的变化可以反映蛋白质局部三级结构的变化[17]。由图5可知,常规提取的鹅肝蛋白质和超声提取的鹅肝蛋白质在波长330~340 nm处的荧光强度最高,荧光强度的最高峰没有发生变化。与常规提取的鹅肝蛋白质相比,采用超声辅助提取的鹅肝蛋白质荧光强度明显提高,并且荧光强度有不同程度的变化趋势,可能是由于鹅肝蛋白质经超声处理后,蛋白质内部分子伸展,其分子间作用力遭到破坏,暴露出部分色氨酸基团,从而使荧光强度发生了一定的改变[18]。贾俊强等通过超声处理麦胚清蛋白质后,其荧光强度明显提高[19]。采用超声辅助提取可以改变鹅肝蛋白质三级结构的构象,这可能与超声处理时产生的剪切力有关[20]。
2.6 鹅肝蛋白质的扫描电镜分析
由图6可知,常规水浴提取的鹅肝蛋白质呈块状堆积结构。与常规水浴提取的鹅肝蛋白质致密的网状结构相比,经超声处理的鹅肝蛋白质结构变得疏松,出现很多微孔。这些微观结构的变化可能是由于鹅肝蛋白质分子间氢键和范德华力被超声波的空化作用产生的局部微射流及震荡波所产生的剪切力破坏了,从而使蛋白后表面暴露出更多的巯基和疏水性基团,最终导致蛋白质结构被破坏,粒径减小,使得蛋白质聚集体发生分散,形成更加宽松的层状结构[21],这与冯景丽等采用超声处理酪蛋白质表面微观结构变得片层化和“空洞”化是一致的[15]。鹅肝蛋白质结构经过超声处理会产生巨大的变化,其表面微观结构会发生明显变化。
2.7 鹅肝蛋白质的疏水性分析
表面疏水性是蛋白质的重要特性之一,研究表明,表面疏水性是影响蛋白质功能特性的重要因素,对保持蛋白质稳定构象及其生物活性具有重要作用[22]。荧光探针法是目前蛋白质表面疏水性测定中应用最广泛的一种方法,它具有蛋白质用量少和操作简单、便捷等特点[23]。ANS荧光探针在水溶液中单独存在时,荧光量子产量较低,随着ANS与蛋白质结合,荧光强度显著增强,通过这一特性可以表征鹅肝蛋白质的表面疏水性[24]。由图7可知,与常规水浴提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白质表面疏水性增加,表明超声处理破坏了鹅肝蛋白质的结构,在水溶液中暴露出疏水性氨基酸,更多的鹅肝蛋白质与ANS相结合,荧光强度增强,其表面疏水性显著提高[25]。贾俊强等发现,通过超声频率为1 800 W 的超声波处理后小麦胚芽球蛋白质溶液的表面疏水性得到了提高[26]。通过超声辅助提取,可以使蛋白质结构发生变化,蛋白质伸展时,其表面疏水性可以得到提高[8]。
2.8 鹅肝蛋白质的自由巯基和总巯基分析
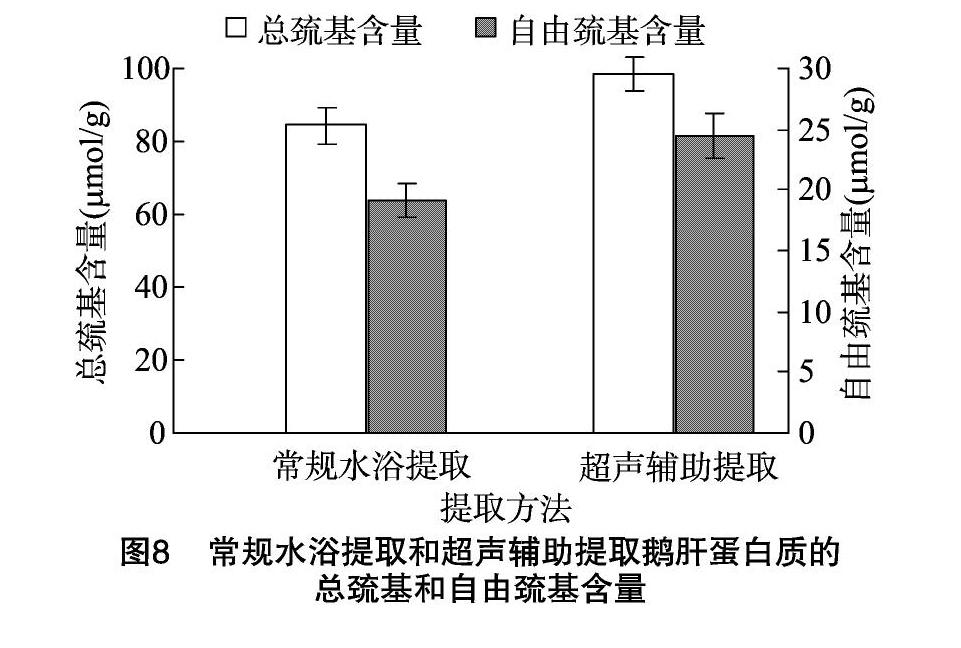
巯基含量的变化程度有助于判断蛋白质结构变性的程度[27]。如图8所示,与常规提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白质的自由巯基和总巯基含量都有明显增加。有可能由于超声处理使鹅肝蛋白质溶液中分子间的二硫键断裂,使原本的二硫键断裂成巯基,破坏了鹅肝蛋白质的高级结构,最终造成鹅肝蛋白质分子空间结构伸展[28]。此外还可能由于鹅肝蛋白质溶液的复杂性,其蛋白质溶液是混合物
而不是纯蛋白质溶液[25]。
2.9 鹅肝蛋白质的溶解度分析
溶解度是衡量蛋白质变性和聚集的重要指标之一,是蛋白质的重要功能性质之一[29]。由图9可知,鹅肝蛋白质的pH值-溶解度曲线基本符合“V”形。鹅肝蛋白质的溶解度在等电点(pH值为4.0)时,溶解度最小,这是由于鹅肝蛋白质在等电点时呈中性,分子间缺少静电排斥力,从而造成蛋白质沉淀,溶解度降低[30]。当pH值呈酸性时鹅肝蛋白质的溶解度先减小后增大,pH值呈碱性时溶解度逐步升高,并且pH值呈碱性时的溶解度高于pH值呈酸性时的溶解度。这是由于超声处理下,蛋白质结构发生改变,形成可溶性蛋白质聚集物,蛋白质粒径减小,从而产生增加了蛋白质与水的相互作用[31]。与常规提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白质的溶解度明显提高。这与王小英等采用超声提取大豆分离蛋白质的溶解度显著增加的结果[32]是一致的。但杨勇等用超声辅助提取绿豆分离蛋白质的结果[14]显示,溶解性没有出现明显的变化,这可能是由于超声处理使绿豆分离蛋白质内部结构松散的同时聚集了绿豆分离蛋白质。
2.10 鹅肝蛋白质的起泡性分析
蛋白质起泡性在食品工业中具有重要作用,在饮料、咖啡等中有着广泛应用[33]。由图10可知,随着蛋白质浓度的增大,鹅肝蛋白质起泡性明显提高。与常规水浴提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白质的起泡性明显提高。这与杨勇等采用超声处理绿豆分离蛋白质后起泡性增加[14]是一致的。这可能是由于超声处理的机械效应和空化作用改变了鹅肝蛋白质结构,暴露出更多的疏水性基团和亲水性基团,其表面活性增大,从而减弱了水的表面张力[33]。由图11可知,随着蛋白质浓度的增加,起泡稳定性明显提高。与常规提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白质溶液在浓度为0.1%、1.0% 时,起泡稳定性有所上升;当鹅肝蛋白质溶液浓度为0.5%、2.0%时,起泡稳定性有所下降。试验结果表明,超声处理能提高蛋白质的起泡性,但对不同浓度鹅肝蛋白质起泡稳定性的影响程度不同。
2.11 鹅肝蛋白质的乳化性质分析
蛋白质的乳化性质在蛋糕、饮料等食品工业中具有重要作用[34]。由图12可知,与常规提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白质的乳化性及乳化稳定性有了明显提高。这可能是由于通过超声处理,导致鹅肝蛋白质分子内部空间结构遭到破坏,展开了部分蛋白质分子,其结构更加松散,使得疏水性基团具有亲水亲油性,最终提高了蛋白质的乳化性质[35],也可能是超声波产生的瞬时高温改变了蛋白质的溶解度、粒径等[34]。毕爽等研究显示,经过低、中超声功率超声处理的黑豆蛋白质的乳化性及乳化稳定性显著提高[36]。本试验表明,超声处理能够提高鹅肝蛋白质的乳化性及乳化稳定性。
3 结论
SDS-PAGE结果显示,超声处理没有改变鹅肝蛋白质的亚基组成。超声处理对鹅肝蛋白质的二级和三级结构有明显影响。圆二色谱及傅里叶红外光谱结果表明,超声处理导致鹅肝蛋白质二级结构发生改变,使其荧光强度显著降低,蛋白质的各二级结构相对含量发生变化,主要表现在β-折叠含量显著下降,α-螺旋、无规则卷曲、β-转角含量提高。鹅肝蛋白质的荧光光谱及DSC结果显示,超声处理导致鹅肝蛋白质三级结构发生变化;表面疏水性结果显示,超声处理使鹅肝蛋白质伸展,表面疏水性明显提高。与常规提取的鹅肝蛋白质相比,超声辅助提取的鹅肝蛋白質具有较高的溶解性、起泡性、乳化性及乳化稳定性等功能特性。超声辅助提取的鹅肝蛋白质与常规提取的鹅肝蛋白质相比,起泡性明显提高,其起泡稳定性的效果根据鹅肝蛋白质溶液的浓度不同有所减弱或提高。
参考文献:
[1]侯会绒. 一种新型风味鹅肝酱的研制[J]. 肉类工业,2013(12):17-20.
[2]詹 珺,杨 超,李玉飞,等. 浅谈肥鹅肝的营养价值[J]. 食品工程,2013(1):60-61.
[3]任 虹,朱晓霞,韩东桓,等. 微波辅助提取花生红衣多酚及其抗氧化活性研究[J]. 中国食品学报,2013,13(7):25-33.
[4]王 立,卞 欢,吴海虹,等. 超声辅助酶解鹅肝蛋白的动力学和热力学及酶解物抗氧化性能[J]. 江苏农业学报,2017,33(6):1395-1401.
[5]Zou Y,Wang L,Li P P,et al. Effects of ultrasound assisted extraction on the physiochemical,structural and functional characteristics of duck liver protein isolate[J]. Process Biochemistry,2017,52:174-182.
[6]Zhang Q T,Tu Z C,Xiao H,et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92(1):30-37.
[7]Jackson M,Mantsch H H. Halogenated alcohols as solvents for proteins:FTIR spectroscopic studies[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,1992,1118(2):139-143.
[8]齐宝坤,赵城彬,江连洲,等. 不同热处理温度下大豆11S球蛋白Zeta电位、粒径和红外光谱分析[J]. 食品科学,2018,39(24):61-65.
[9]任晓锋. 扫频超声预处理对玉米醇溶蛋白特性及其酶法制备ACE抑制肽的影响[D]. 镇江:江苏大学,2014.
[10]李 玥. 大米淀粉的制备方法及物理化学特性研究[D]. 无锡:江南大学,2008.
[11]李德富,周玉玲,穆畅道,等. 超声波对溶液中胶原蛋白聚集体和三股螺旋结构的影响[J]. 皮革科学与工程,2009,19(5):14-17,22.
[12]叶进富. 蛋白质zeta电位与离子交换层析分离的相关性研究[D]. 杭州:浙江大学,2006.
[13]Serpone N,Colarusso P. Sonochemistry Ⅰ. Effects of ultrasounds on heterogeneous chemical reactions-a useful tool to generate radicals and to examine reaction mechanisms[J]. Research on Chemical Intermediates,1994,20(6):635-679.
[14]杨 勇,毕 爽,王中江,等. 超声波处理对绿豆蛋白结构及功能特性的影响[J]. 食品工业科技,2016,37(9):69-73.
[15]冯景丽,贾 峰,王金水,等. 超声波处理对酪蛋白结构特性的影响[J]. 中国乳品工业,2015,43(6):20-23.
[16]Song J,Tao W Y,Chen W Y. Ultrasound-accelerated enzymatic hydrolysis of solid leather waste[J]. Journal of Cleaner Production,2008,16(5):591-597.
[17]刘 斌,马海乐,李树君,等. 超声波处理对脱脂麦胚分离蛋白结构的变化研究[J]. 光谱学与光谱分析,2011,31(8):2220-2225.
[18]Li S Y,Yang X E,Zhang Y Y,et al. Effects of ultrasound and ultrasound assisted alkaline pretreatments on the enzymolysis and structural characteristics of rice protein[J]. Ultrasonics Sonochemistry,2016,31:20-28.
[19]賈俊强,马海乐,赵伟睿,等. 超声波处理对麦胚清蛋白结构和功能性质的影响[J]. 过程工程学报,2009,9(1):107-112.
[20]Zhou C S,Ma H L,Yu X J,et al. Pretreatment of defatted wheat germ proteins(by-products of flour mill industry)using ultrasonic horn and bath reactors:effect on structure and preparation of ACE-inhibitory peptides[J]. Ultrasonics Sonochemistry,2013,20(6):1390-1400.
[21]Wang Z,Lin X,Li P,et al. Effects of low intensity ultrasound on cellulase pretreatment[J]. Bioresource Technology,2012,117(10):222-227.
[22]吴海波,齐宝坤,江连洲,等. 大豆分离蛋白热性质及其空间构象对表面疏水性的影响[J]. 中国粮油学报,2014,29(10):42-46.
[23]Haskard C A,Li-Chan E C. Hydrophobicity of bovine serum albumin and ovalbumin determined using uncharged (PRODAN) and anionic (ANS—) fluorescent probes[J]. Journal of Agricultural and Food Chemistry,1998,46(7):2671-2677.
[24]余晶梅. 荧光探针法和疏水相互作用层析法分析蛋白表面疏水性[D]. 杭州:浙江大学,2014.
[25]金 建. 基于计算机模拟与超声辅助酶法制备高生物利用度玉米蛋白的研究[D]. 镇江:江苏大学,2015.
[26]贾俊强,马海乐,赵伟睿,等. 超声波处理对小麦胚芽球蛋白理化和功能性质的影响[J]. 农业机械学报,2009,40(8):105-110.
[27]Wang X S,Tang C H,Li B S,et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids,2008,22(4):560-567.
[28]Chandrapala J,Zisu B,Kentish S,et al. The effects of high-intensity ultrasound on the structural and functional properties of α-Lactalbumin,β-Lactoglobulin and their mixtures[J]. Food Research International,2012,48(2):940-943.
[29]胡 昊. 利用高場强超声波增强大豆蛋白凝胶性及凝胶缓释效果[D]. 武汉:华中农业大学,2014.
[30]孙燕婷,黄国清,肖军霞,等. 超声处理对大豆分离蛋白溶解性和乳化活性的影响[J]. 中国粮油学报,2011,26(7):22-26.
[31]Arzeni C,Martinez K,Zema P,et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering,2012,108(3):463-472.
[32]王小英,李 娜. 超声处理对大豆蛋白溶解性及蛋白组分的影响[J]. 中国油脂,2009,34(4):31-34.
[33]罗 娟. 超声波对枯草芽孢杆菌液态发酵豆粕及其产物功能特性的影响[D]. 镇江:江苏大学,2016.
[34]Yu J M,Ahmedna M,Goktepe I. Peanut protein concentrate:Production and functional properties as affected by processing[J]. Food Chemistry,2007,103(1):121-129.
[35]刘国琴,李 琳,李 冰,等. 超声和超高压处理对大豆分离蛋白特性影响的研究[J]. 河南工业大学学报(自然科学版),2005,26(3):1-4.
[36]毕 爽,齐宝坤,隋晓楠,等. 超声处理对黑豆蛋白结构和功能性质的影响[J]. 中国食品学报,2016,16(6):153-160.
