鲫鱼肠道蜡样芽孢杆菌的分离鉴定及生物学特征
2019-11-28陈丰黄亚冬孙敬锋吕爱军胡秀彩石洪玥邢克智
陈丰 黄亚冬 孙敬锋 吕爱军 胡秀彩 石洪玥 邢克智


摘要:从健康鲫鱼(Carassius auratus)肠道中分离纯化出1株细菌,命名为CS4,通过形态学观察、生理生化特性、16S rDNA测序以及系统发育分析等方法鉴定为蜡样芽孢杆菌(Bacillus cereus),并对其致病性及药物敏感性等生物学特征进行研究。结果表明,菌株CS4具有β溶血性(完全溶血),对健康鲫鱼感染9 d的半数致死量为4.6×106 CFU/g。该菌株对复方新诺明、利福平、呋喃唑酮、头孢孟多、阿莫西林等16种抗生素耐药;对红霉素、诺氟沙星、庆大霉素、丁胺卡那、林可霉素等17种抗生素敏感。笔者从健康鲫鱼肠道中分离到致病性较强的蜡样芽孢杆菌,表明该菌是一种重要的条件性致病菌,研究结果对防治由蜡样芽孢杆菌引起的鱼类疾病具有实际意义。
关键词:鲫鱼;蜡样芽孢杆菌;分离鉴定;致病性;药敏试验
中图分类号: S941.4文献标志码: A
文章编号:1002-1302(2019)18-0191-04
收稿日期:2018-06-04
基金项目:国家自然科学基金(编号:31272692);天津市北辰区科技创新专项(编号:KJCX-XDZ-KTP-2016-005);天津市大学生创新创业训练计划(编号:201610061044)。
作者简介:陈 丰(1993—),男,福建霞浦人,硕士研究生,研究方向为水产动物疾病学。E-mail:chenfeng08091204@163.com。
通信作者:孙敬锋,博士,教授,研究方向为水产动物病害及免疫学。E-mail:sun_jf@163.com。
动物肠道菌群是一个复杂且庞大的微生态系统[1],不同动物肠道菌群的组成结构多种多样,并且不同类群的微生物数量和分布各不相同[2]。在鱼体中,肠道菌群既参与营养物质的吸收与消化,又具有免疫防御、维持机体健康等功能,对鱼类生长发育起到重要作用[3]。鱼类生活的环境和鱼类消化道中存在着大量的微生物,在鱼类生长发育过程中,鱼类消化道逐渐形成了一个由好氧菌、兼性厌氧菌和厌氧菌组成的动态正常菌群。但当出现机体抵抗力下降、饵料或养殖环境恶化等应激状态时,肠道微生物区系平衡被破坏,病原菌或条件致病菌就会异常增殖,导致鱼类产生各种疾病[4]。
芽孢杆菌(Bacillus)是鱼类肠道正常菌群的重要组成部分,其中一些种类,如枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)作为益生菌在水产养殖过程中被广泛应用[5-6]。近年来,蜡样芽孢杆菌(B. cereus)作为益生菌的应用也逐渐增多[7-9]。然而,不少研究者从患病鱼病灶或实质内脏器官中分离到蜡样芽孢杆菌,并证明其具有致病性,如陈红莲等从斑点叉尾的肝、脾、肾中分离别蜡样茅孢杆菌[10];贺胜英等从大鲵的鳃、肝、肾中分离到蜡样芽孢杆菌,并证明是引起发病的病原菌[11]。目前,也有研究者从鱼类肠道中分离到非致病性蜡样芽孢杆菌菌株,并可作为益生菌应用[12],但未见从鱼类肠道中分离到致病性蜡样芽孢杆菌的报道。本研究从鲫鱼肠道中分离出1株致病性蜡样芽孢杆菌,并對其进行分类鉴定及生物学特征研究。这对蜡样芽孢杆菌引起的鱼类疾病的防治及其作为益生菌时的安全性评估具有重要意义。
1 材料与方法
1.1 细菌的分离培养及形态学观察
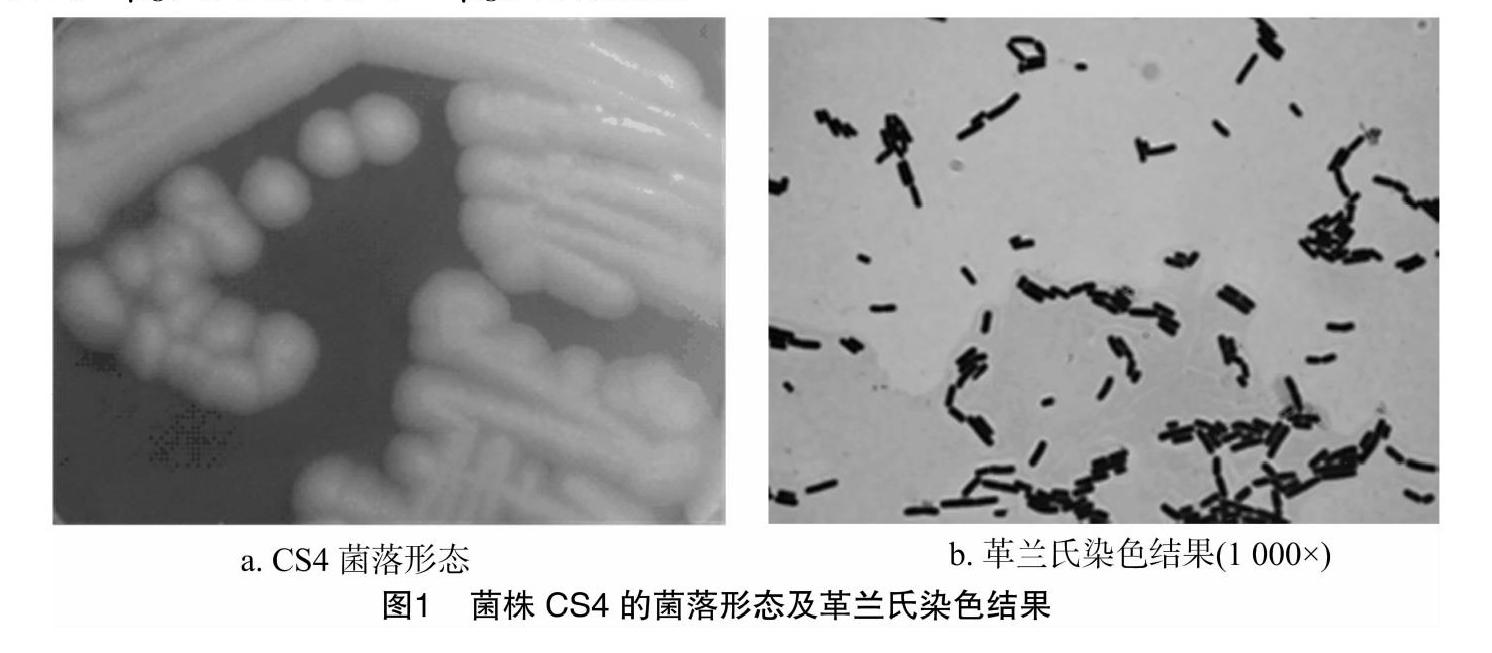
健康鲫鱼,体长15 cm,体质量450 g,从天津市某大型水产批发市场购得。用医用乙醇棉球擦拭鱼体表之后,用无菌解剖器具对鱼体进行解剖,取鱼中后肠,用无菌生理盐水冲洗肠道内容物,剪开肠道,刮取肠内膜于组织匀浆器中,加入1 mL 无菌生理盐水进行组织匀浆,然后把匀浆液按10-1~10-4稀释。取100 μL均匀涂布于LB固体培养基上,于37 ℃恒温培养24 h后,重复划线接种培养2~3次,得到纯的菌株,使用革兰氏染色试剂盒(北京索莱宝科技有限公司)染色,镜检,选取1株具有芽孢的革兰氏阳性杆菌进一步纯化保存,命名为CS4。
1.2 生理生化特征
参考文献[13-14],对分离菌株进行生理生化特征测定,包括明胶液化、尿素、硝酸盐还原、硫化氢、淀粉水解、甘露醇、果糖、乳糖、木糖、葡萄糖、麦芽糖、伏-普(V-P)试验等。
1.3 16S rDNA基因序列分析
参考Queipo-Ortuo等的方法[15]提取DNA模板,以细菌通用引物进行16S rDNA基因的PCR扩增。通用引物如下:27F,5′-AGAGTTTGATCCTGGCTCAG-3′;1 492R,5′-TACGGCTACCTTGTTACGACTT-3′,由生工生物工程(上海)股份有限公司合成。PCR扩增反应体系(25 μL)包括Mix 10 μL,上、下游引物各1 μL,DNA模板2 μL,超纯水11 μL。PCR扩增反应程序:94 ℃预变性5 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1 min,循环30 次;72 ℃延伸10 min。扩增反应完成后,取5 μL PCR扩增产物,利用1.0%琼脂糖凝胶电泳进行检测。菌株16S rDNA的PCR扩增产物测序由生工生物工程(上海)股份有限公司完成。测得的序列在GenBank数据库中进行BLAST(http://www.ncbi.nlm.nih.gov/blast/)同源性比对分析。利用软件MEGA 5.0中的邻接(Neighbor-Joining)法构建系统发育树。
1.4 致病性检测
1.4.1 溶血性试验
参考杨志平等的方法[16]对菌株CS4进行溶血性试验。
1.4.2 攻毒试验
