不同磷浓度条件下地表球囊霉对黄瓜枯萎病抗性和抗氧化酶活性的影响
2019-11-28王倡宪王艳张志
王倡宪 王艳 张志


摘要:试验采用盆钵培养的方法于黄瓜育苗时接种地表球囊霉(G. versiforme),并分别浇灌磷浓度为0、31、93 mg/kg 的营养液,于苗龄为4周时,采用灌根法接种尖孢镰刀菌(Fusarium oxysporum f. sp.)分生孢子悬液,以明确不同磷浓度条件下G. versiforme对黄瓜幼苗枯萎病的防效及相关酶活性的影响。结果表明,磷浓度为31 mg/kg时,G. versiforme可明显提高黄瓜幼苗对枯萎病的抗性,接种病原菌后9 d时,菌根化幼苗的病情指数较相应对照降低10百分点;同时,接种G.versiforme的幼苗叶片中蔗糖含量为其相应对照的1.4倍。幼苗接种病原菌后,与各自相应的对照相比,接种G.versiforme处理叶片中多酚氧化酶(PPO)活性较高,过氧化物酶(POD)活性相对稳定,且峰值出现时间较晚。
关键词:黄瓜;地表球囊霉;磷浓度;枯萎病;抗病性;抗氧化酶
中图分类号: S436.421.1+3文献标志码: A
文章编号:1002-1302(2019)18-0129-03
收稿日期:2018-08-03
基金项目:黑龙江省教育厅科学技术研究项目(编号:12511403)。
作者简介:王倡宪(1974—),女,内蒙古包头人,博士,副教授,主要从事植物根际营养的教学与科研工作。E-mail:wangcxsz08@163.com。
黄瓜(Cucumis sativus L.)作为我国主要栽培蔬菜种类之一,近年来,种植面积和产量均呈现增加趋势,与此同时,土传病害逐年加重是黄瓜栽培过程中存在的一个古老而又现实的问题[1-3]。其中,由尖孢镰刀菌黄瓜专化型(Fusarium xysporum f.sp.cucumerinum)病原菌引起的枯萎病易发难防,危害严重,目前,该病以化学农药防治为主,而由此引起的瓜果质量下降与环境污染问题已成为人们日益关注的焦点[4]。
隶属于球囊霉门的丛枝菌根(arbuscular mycorrhizal,AM)真菌广泛分布于农业生态系统中,该类真菌可以和包括黄瓜在内的约90%维管植物形成菌根共生体,互惠型共生体建成后,AM真菌对寄主的生长发育及抗逆性的提高均表现出积极效应[5-6]。近年来,有关AM真菌对黄瓜枯萎病防效及其机制的研究陆续展开,但是,结果却不尽相同,主要是由于AM真菌的防效与AM真菌种类、寄主、土壤环境等诸多因素有关,其中,介质中的磷水平是影响共生体发育的最根本因素[7-13]。鉴于此,本试验探索不同磷浓度条件下AM真菌对黄瓜枯萎病的抗性及不同处理下黄瓜叶片中与抗性相关酶活性的变化,以明确AM真菌对黄瓜枯萎病的防效及适宜磷浓度,并为深入研究相关机制奠定理论基础。
1 材料与方法
1.1 试验材料
黄瓜:津绿3号,由天津科润黄瓜研究所提供。播种前将充分吸水的种子在10% H2O2中浸泡10 min进行表面消毒,然后用蒸馏水洗净药液,在55 ℃条件下水浴浸种,浸种时不断搅拌,持续20 min,使种子吸水膨胀,供给种子萌发所需基本水量,并起到种子表面消毒的作用,取出后于28 ℃恒温箱中黑暗催芽。
育苗基质及容器:将灭菌的草炭与蛭石以1 ∶1的体积比混合均匀。营养钵(上口径8.5 cm,底径6.0 cm,高7.5 cm)用福尔马林密封1周进行消毒处理,待气味散尽后备用。
AM菌剂:以玉米为寄主,以草炭为基质扩繁2个月,混合接种剂中含有地表球囊霉(G.versiforme,缩写为G.v)真菌的孢子、菌丝和被侵染根段。
病原菌(Fusarium oxysporum f.sp.,略寫为F.o,由中国农业科学院植物保护研究所提供)孢子悬液:先将病原菌在马铃薯葡萄糖琼脂(PDA)培养基上25 ℃黑暗培养3 d,然后从菌落边缘挑取2块直径为3~4 mm的菌块于灭菌的马铃薯-葡萄糖培养液中28 ℃、50 r/min培养2周,用消毒的双层纱布滤掉菌丝,将剩余的培养液于4 ℃、9 000 r/min 下离心3次,收集孢子悬液,用血球板计数,最后用10 mmol/L MgSO4·7H2O调节孢子浓度至5×104 CFU/mL。病原菌孢子悬液制备过程中的所有器皿及制备后的病原菌残余物均须灭菌处理。
1.2 试验设计
本试验共设6个处理。AM真菌:接种G.v(M)、不接种G.v的对照(NM);磷水平:P0(0 mg/kg)、P1(31 mg/kg)、P2(93 mg/kg)。
6个处理分别表示为:(1)MP0;(2)MP1;(3)MP2;(4)NMP0;(5)NMP1;(6)NMP2。每处理设15次重复。磷以Ca(H2PO4)2·H2O的形式加入Hoagland营养液中,调节营养液pH值为6.5。
1.3 试验实施
试验采用生物模拟培养的方法于人工气候室进行。每盆装基质90 g,播种2粒黄瓜种子,出苗后留1株,其中接种AM真菌处理将菌剂与基质混匀装盆,每盆菌剂用量为10 g,不接种的对照加入等量的灭菌菌剂和10 mL菌种滤液,以保证其他微生物的种类一致。从播种开始,1周后出苗,第2周开始隔日浇灌1/4强度不同P浓度营养液,第3周真叶展开,浇灌1/2强度不同磷浓度的营养液。出苗4周后采用灌根法接种病原菌,每盆接种20 mL病原菌孢子悬液,接种后即停止浇灌营养液。
1.4 分析测定
分别于接种病原菌后1、3、5、7、9 d随机取3株黄瓜幼苗进行叶片中多酚氧化酶(PPO)、过氧化物酶(POD)活性测定,同时取根样调查根系发病情况,最后1次取样测定植株生物量并计算病情指数;植株叶片全氮、全磷含量用FIA分析仪测定;菌根侵染率用网格交叉法测定[14];PPO活性采用儿茶酚比色法、POD活性采用愈创木酚比色法[15]测定。
2 结果与分析
2.1 不同磷浓度条件下,AM真菌对植株生长及抗病性的影响
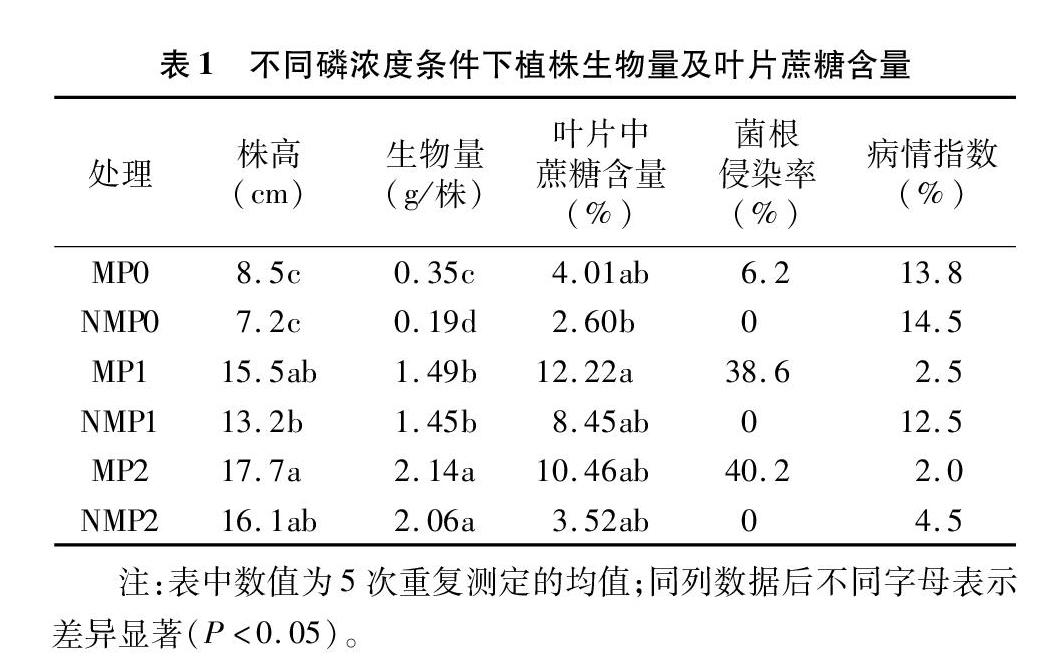
从表1可以看出,植株长势及生物量随介质中磷浓度的增加而增加,并且以磷浓度为93 mg/kg时植株生物量最高。3种磷浓度条件下,只有无磷处理条件下接种AM真菌的植株生物量显著高于其相应的对照,磷浓度为31、93 mg/kg 时,接种AM真菌幼苗的生物量与其各自相应对照间差异均未达到显著水平,表明在无磷营养胁迫条件下,AM真菌具有显著的促生效应,随着介质中磷浓度的升高,AM真菌的促生效应降低。蔗糖作为植株体内光合作用的主要运输产物,它在植株叶片中含量的高低间接反映了植株体内的能量储备状况及植株根系可获得能量物质的潜力。3种磷浓度条件下,接种AM真菌处理植株叶片中蔗糖含量与各自相应的对照间均无显著差异,磷浓度为31 mg/kg 时,接种AM真菌的幼苗叶片中蔗糖含量显著高于无磷条件的对照,该处理幼苗叶片中的蔗糖含量为其相应对照的1.4倍。接种病原菌后较高的磷浓度(93 mg/kg)下,G.V.依然可以侵染黄瓜幼苗根系,且菌根侵染率高达40.2%。高磷处理条件下植株叶片中蔗糖含量低于中等磷浓度处理可能是寄主中可利用碳源供给AM真菌所致。有研究认为,在足够的磷供应条件下,如果菌根侵染率不因磷浓度升高而有所下降时,AM真菌会诱导光合产物从寄主转运至AM真菌[16]。取样调查根系发病情况时发现,无磷条件下,3 d取样时,非菌根化植株即有10%的侧根坏死,而接种AM真菌处理到接种后5 d才有零星的侧根坏死,但到接种后9 d取样时,2处理间的受害程度基本一样严重,这主要是由无磷条件下植株长势相对较弱,容易受到病原菌的侵害所致。在中等磷条件下,AM真菌的抗病效应较为明显。而在高磷条件下,AM真菌对植株的抗病性基本无影响,这主要由于在该条件下,无论接种与否,植株生长相对较为健壮,不易感染病害。
2.2 不同磷浓度条件下,AM真菌对叶片中多酚氧化酶、过氧化物酶活性的影响
2.2.1 多酚氧化酶活性
不同磷浓度条件下,接种病原菌后植株叶片PPO活性变化见图1,可以看出,在无磷处理条件下, 菌根化植株叶片中PPO活性在接种病原菌后3 d即达到第1个峰值,且显著高于对照,到接种病原菌后的7 d出现第2个酶活性高峰,而不接种的对照到接种病原菌后的7 d才达到其仅有的一个峰值,接种后第3天和第7天此时的酶活分别为同时期对照酶活性的8.3倍和1.9倍。当营养液中磷水平上升为31 mg/kg 时,菌根化植株叶片中PPO活性的变化趋势与其相应的对照基本一致,即到接种病原菌后7 d,叶片中PPO活性均达到仅有的一个峰值,但接种病原菌后一直以接种AM真菌处理PPO活性较高;当磷浓度增加至93 mg/kg 时,接种AM真菌处理叶片中PPO活性于接种病原菌后7 d达峰值,此时的酶活性为相应对照的3.4倍,尽管对照酶活性于接种病原菌后3 d就达到其仅有的一个峰值,但此时的酶活性与接种AM真菌处理的酶活性相等。
综合上述接种病原菌后植株在不同磷浓度条件下叶片中PPO酶活性变化趋势可以推断,植株受到病原入侵時,菌根化植株对外源病原菌的侵入表现得更为敏感,而非菌根化植株的反应较为迟钝。即在无磷条件下,接种病原菌后菌根化幼苗叶片中PPO活性较高且峰值出现得较早,而非菌根化植株体内PPO活性较低且峰值出现得较晚,且在3种磷浓度条件下,以无磷条件下菌根化植株对病原菌的侵入更为敏感,这可能是在低磷条件下菌根共生体的形成受到了影响所致。
2.2.2 过氧化物酶活性 在无磷处理条件下,接种病原菌后非菌根化植株叶片中POD活性变幅一直明显大于菌根化处理(图2),即对照POD活性于接种病原菌后3 d即达到峰值,此时的酶活性为菌根化处理的7.2倍,而菌根化植株叶片POD活性于接种病原菌后5 d达到其仅有的一个峰值。磷浓度为31 mg/kg 时,菌根化植株叶片POD活性于接种病原菌后7 d达到峰值,而不接种的对照比菌根化处理提前2 d 达到其峰值。当营养液中磷浓度增加至93 mg/kg时,接种AM真菌处理植株叶片POD活性于接种病原菌后9 d达到峰值,但此时的酶活性与相应的对照接近,而对照植株叶片POD活性较相应的菌根化处理提前4 d达到最大值,且此时的酶活性为菌根化处理的1.6倍。
在3种磷水平条件下,接种病原菌后,AM真菌对植株体内POD活性的影响具有相似的趋势,结合植株的发病情况认为,植株受到病原侵袭时,其体内POD活性的变化在很大程度上是植株受害程度的一种体现。具体而言,与菌根化幼苗叶片幼苗叶片中相对稳定的POD活性相比,菌根化植株体内POD活性变幅较大,且酶活性峰值出现时间早。
早期在番茄上的研究首次证实,AM共生体的形成可诱导寄主产生系统抗性[17]。即植株在受到病原菌攻击时,被感染的部位会通过一定的方式对病原菌的入侵做出反应,同时在未感染病原菌的部位也产生相类似的反应。因此,不同磷浓度条件下,接种病原菌后,植株叶片PPO、POD活性的变化在一定程度上反映了植株根系受到病原侵袭时所诱导的防御反应,且PPO、POD均与植株的抗病性有关,相关研究结果认为,当植株受到病原菌的侵害时,植株体内的PPO、POD活性均会升高,以增加其抗病性[18-20]。本研究中,在接种病原菌的条件下,AM真菌对植株体内PPO、POD活性的影响不同,其中,菌根化植株PPO活性峰值总体出现得较早且酶活性较高,而非菌根化植株体内PPO活性峰值出现得较晚且相对稳定较低;周宝蜊等研究发现,接种病原菌条件下,菌根真菌可显著提高寄主PPO活性[21]。菌根化植株体内POD活性相对稳定,且酶活性峰值出现时间较晚,而非菌根化植株体内POD活性变幅较大,且酶活性峰值提早出现。接种病原菌后,当介质中无磷供给时,非菌根化幼苗叶片中POD活性的变化尤为明显。这与已报道的相关研究结果[22]一致。
。
3 結论
在接种病原菌密度为5×104 CFU/mL的条件下,基质中磷浓度影响植株的抗病性。其中,磷浓度为31 mg/kg时,AM真菌的促生效应不明显,但可明显提高黄瓜幼苗对枯萎病的抗性。无磷条件下,AM真菌表现出显著的促生效应,但因植株长势较弱,抗病能力极低。高磷条件下,接种AM真菌可在一定程度上减轻病害。G. versiforme(G.v)在较高的磷浓度(93 mg/kg)条件下,其菌根侵染率仍高达40.2%,因此在黄瓜生产中可将其引入磷含量较高的土壤,提高植株的抗病性。植株受到病原入侵时,植株体内PPO活性的变化可作为植株受病原菌入侵后做出迅速反应的指标;而接种病原菌后植株叶片中POD活性的变化只是病症表现的反映。
参考文献:
[1]沈 辰,熊 露,韩书庆,等. 我国果菜类蔬菜生产与流通形势分析[J]. 中国蔬菜,2017(9):7-11.
[2]张真和. 我国发展现代蔬菜产业面临的突出问题与对策[J]. 中国蔬菜,2014(8):1-6.
[3]喻景权,周 杰. “十二五”我国设施蔬菜生产和科技进展及其展望[J]. 中国蔬菜,2016(9):18-30.
[4]路 粉,王文桥. 我国蔬菜杀菌剂及其应用状况[J]. 中国蔬菜,2017(10):6-13.
[5]Smith S E,Read D J. Mycorrhizal symbiosis[M]. 3rd ed. London:Academic Press,2008.
[6]Kubota M,McGonigle T P,Hyakumachi M. Co-occurrence of Arum- and Paris-type morphologies of arbuscular mycorrhizae in cucumber and tomato[J]. Mycorrhiza,2005,15(2):73-77.
[7]Díaz F,Alvarado C,Ortiz C,et al. Plant nutrition and fruit quality of pepper associated with arbuscular mycorrhizal in greenhouse[J]. Revista Mexicana de Ciencias Agrícolas,2013,4(2):315-321.
[8]Valentine A J,Osborne B A,Mitchell D T. Interactions between Phosphorus supply and total nutrient availability on mycorrhizal colonization,growth and photosynthesis of cucumber[J]. Scientia Horticulturae,2001,88(3):177-189.
[9]Chen S C,Jin W J,Liu A R,et al. Arbuscular mycorrhizal fungi(AMF)increase growth and secondary metabolism in cucumber subjected to low temperature stress[J]. Scientia Horticulturae,2013,160(3):222-229.
[10]Miransari M. Contribution of arbuscular mycorrhizal symbiosis to plant growth under different types of soil stress[J]. Plant Biology,2010,12(4):563-569.
[11]Yan L,Chen Y L,Min L,et al. Effects of arbuscular mycorrhizal fungi communities on soil quality and the growth of cucumber seedlings in a greenhouse soil of continuously planting cucumber[J]. Pedosphere,2012,22(1):79-87.
[12]Chandanie W A,Kubota M,Hyakumachi M. Interaction between arbuscular mycorrhizal fungus Glomus mosseae and plant growth promoting fungus Phoma sp. on their root colonization and growth promotion of cucumber(Cucumis sativus L.)[J]. Mycoscience,2005,46(3):201-204.
[13]Chandanie W A,Kubota M,Hyakumachi M. Interaction between the arbuscular mycorrhizal fungus Glomus mosseae and plant growth-promoting fungi and their significance for enhancing plant growth and suppressing damping-off of cucumber(Cucumis sativus L.)[J]. Applied Soil Ecology,2009,41(3):336-341.
[14]Phillips J M,Hayman D S,Improved procedures for clearing roots and staining parasitic and vesicular arbuscular mycorrhiza fungi for rapid assessment of infection[J]. Transactions of British Mycological Society,2010,55:158-161.
[15]李合生. 植物生理生化实验原理与技术指导[M]. 北京:高等教育出版社,2000.
[16]Hayman D S. Vesicular-arbuscular mycorrhizas in field crop system[M]. Boca Raton:CRC press,1987.
[17]Cordier C,Pozo M J,Barea J M,et al. Cell defense responses associated with localized and systemic resistance to Phytophthora parasitica induced in tomato by an arbuscular mycorrhizal fungus[J]. Molecular Plant-Microbe Interactions,1998,11(10):1017-1028.
[18]王紅英,钱春桃,张永兵,等. 不同抗性甜瓜接种蔓枯病菌后若干生理指标的变化[J]. 中国瓜菜,2012,25(1):7-10.
[19]郭勤卫,王红英,李 季,等. BTH处理对甜瓜苗期抗蔓枯病相关POD和PPO酶活性的影响[J]. 中国瓜菜,2013,26(6):7-10.
[20]张 宁,毕研飞,郭 静,等. 不同抗性甜瓜接种蔓枯病菌后PAL、PPO与POD活性的变化[J]. 植物生理学报,2016,52(8):1169-1175.
[21]周宝蜊,郑继东,毕晓华,等. 丛枝菌真菌对茄子黄萎病的防治效果和茄子植株生长的影响[J]. 生态学杂志,2015,34(4):1026-1030.
[22]王倡宪,秦 岭,冯 固,等. 丛枝菌根真菌对接种尖孢镰刀菌后黄瓜根系次生代谢物的影响[J]. 植物保护学报,2005,32(2):148-152.
