牛樟芝药用化学及其应用研究进展
2019-11-28张知晓付文刘凌户连荣季梅
张知晓 付文 刘凌 户连荣 季梅


摘要:牛樟芝是一种珍稀的药用真菌,因其寄主专一性,野生资源缺乏,人工培育困难,可持续发展面临严峻挑战。本文评述牛樟芝的化学成分、生物活性和发酵技术的研究进展。牛樟芝化学物质多样,已分离获得325种化学物质,分属酯类、酸类和萜类等15类。发掘这些化学物质和粗提物的生物活性,发现牛樟芝具有抗癌、免疫调节、保肝和消炎等多种药用功能。为获得更广泛的应用,以获得更优的菌丝生长,子实体形成和功能活性物质产生的椴木栽培、固体发酵和液体发酵技术被不断完善。但是要以牛樟芝为材料大量生产药品,临床试验须进一步研究,活性物质生物功能须进一步发掘,人工培育技术须进一步优化。
关键词:牛樟芝;化學成分;生物活性;发酵技术
中图分类号: R284文献标志码: A
文章编号:1002-1302(2019)18-0010-14
收稿日期:2018-06-04
基金项目:云南省科技计划青年项目(编号:2016FD096)。
作者简介:张知晓(1988—),女,云南个旧人,硕士,助理研究员,主要从事森林微生物资源开发与利用研究。E-mail:36062613@qq.com。
通信作者:季 梅,研究员,主要从事生物多样性与林业有害生物防治研究。E-mail:meiji.emma@163.com。
中药是我国传统文化之瑰宝,我国中药生物资源丰富,有药用植物11 146种、药用动物1 581种,药用真菌540种[1-2]。我国药用真菌应用历史悠久,公元102—200年的《神农本草经》中就有黑木耳(Auricularia auricula)、灵芝(Ganoderma sp.)、雷丸(Mylitta lapidescens)、茯苓(Wolfiporia cocos)和猪苓(Polyporus umbellatus)等5种真菌的药用记载。近年,药用真菌的功能活性物质发掘、药理特性揭示和人工培育成为药用真菌研究的热点,在药用真菌中已发现126种新奇的功能活性,如抗癌、止血、抗菌、解毒、消炎和提高免疫力等[2]。一些药用真菌因其功能活性物质、药理特性或人工培育技术较成熟被普遍应用,如冬虫夏草(Ophiocordyceps sinensis)、赤芝(Ganoderma lucidum)、茯苓等多种药用真菌已经实现大宗商品化贸易[3];有的还被开发成中成药或中药饮片,如猪苓多糖注射液、灵芝孢子粉和虫草含片等[4]。因此,发掘、开发、利用和保护药用真菌资源,促进我国传统中药文化发展将是未来中药学研究的热点领域之一。
牛樟芝(Antrodia comphorata)是一种珍稀药用伞菌,具有抗癌、免疫调节、抗衰老、抗病毒、保肝、消炎、治疗心血管疾病和神经损伤等多种功能,大量的功能活性物质被发掘[5],其市场需求量极大。牛樟芝专性腐生牛樟树,生长极为缓慢,且寄主分布区域狭窄,野生资源紧俏,市场售价已高达15 000美元/kg[6]。非法砍伐牛樟树采集牛樟芝已经威胁到牛樟芝和牛樟树资源的可持续发展,台湾已经把牛樟树列为保护植物[7]。通过液体发酵生产加工菌丝商品成为目前牛樟芝资源化利用和野生资源保护的一个关键策略[8];扩大牛樟树人工栽培面积,再用椴木栽培牛樟芝以获取子实体是另一个关键策略[9]。本文系统地综述牛樟芝的化学组成、药理特性及培育技术,目的是为牛樟芝资源保护和利用提供参考。
1 分类描述
牛樟芝的分类历经多次鉴定,目前得出的科学结论有(1)分类地位:隶属真菌界(Fungi)担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)多孔菌科(Polyporaceae)薄孔菌属(Antrodia)[10]。(2)别称:Ganoderma comphoratum,Antrodia cinnamomea和Taiwanofungas camphortus[11]。(3)寄主和分布:牛樟树(Cinnamomum kanehirai)是牛樟芝的自然唯一寄主,主要分布于台湾西北部的桃园和新竹,中部的南投和嘉义,东南部的花莲、高雄和台东等县(区、市)的海拔200~2 000 m的山岭地区[12]。(4)系统发育特点:地理来源不同的牛樟芝菌落内转录间隔区(ITS)序列高度稳定相似,相似长度介于592~596 bp之间,相似性为100%。其中,ITS2序列和5.8S序列高度稳定,长度分别是217 bp和158 bp,但ITS1序列具有变异性[13]。(5)形态特征:子实体多年生,片状、钟形、蹄形或塔形,生长初期平伏,后边缘上翘到卷成蝶形或钟形,尝之味苦涩,闻之有樟脑芳香。表面有光泽和不明显的皱褶,黄色至深褐色,边缘平钝;腹面被0.3~0.5 cm长的圆形菌孔,橘红色或橘黄色。生殖菌丝无色或浅褐色,具锁状联合,直径2.0~3.5 μm;骨架菌丝浅褐色或深褐色,有少量的淀粉体,直径25~4.5 μm;缠绕菌丝浅褐色或深褐色,有分枝,直径0.1~0.2 μm。担子棒状,具有4个担孢子梗,并在基部有一简单分隔,大小(12~14) μm×(3.0~5.0) μm。担孢子无色,圆柱形或弯曲圆柱形,表面平滑,大小(3.5~5.0) μm×(1.5~2.0) μm[14]。
2 化学组成
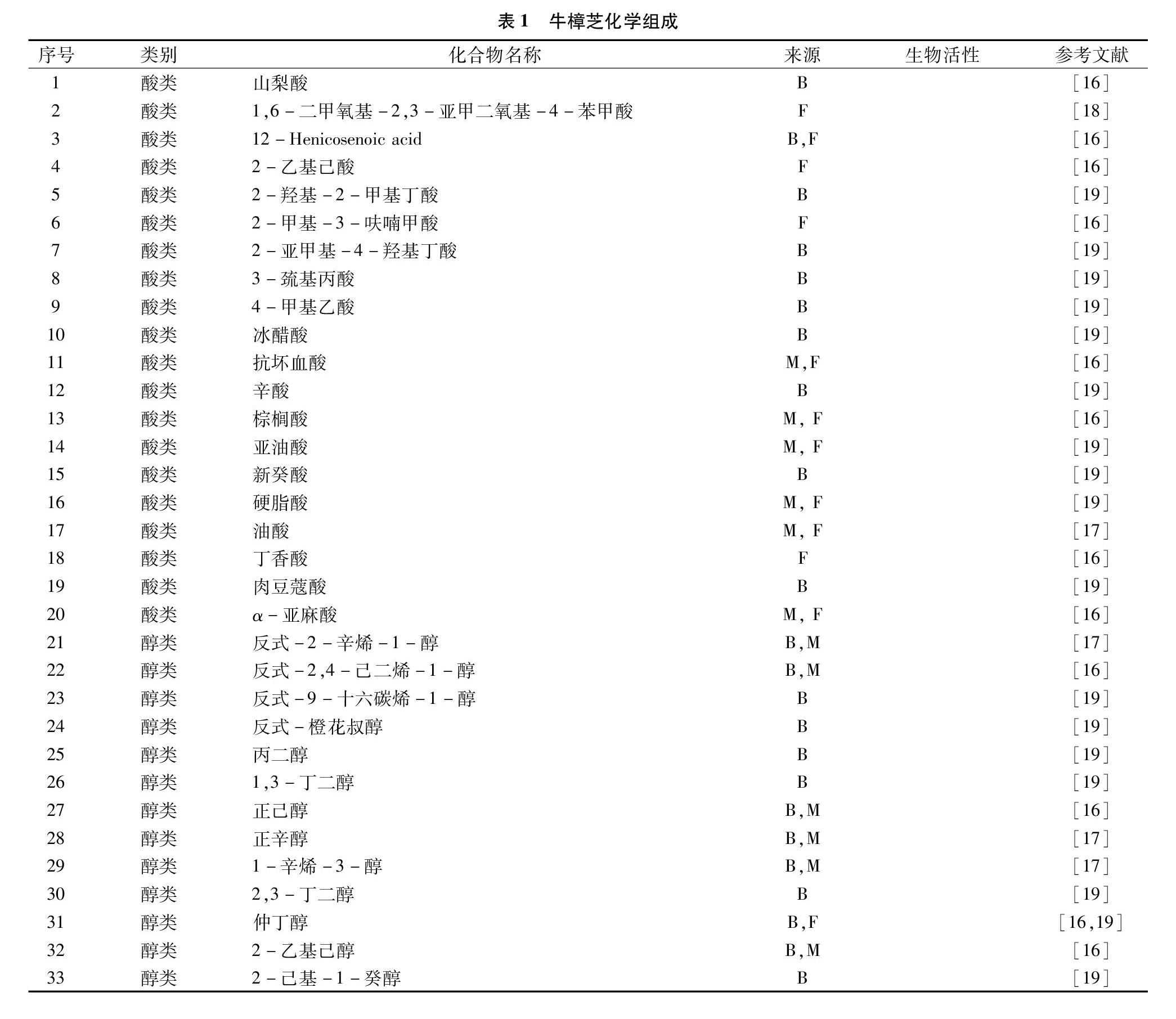
牛樟芝化学组成物质丰富,已分离鉴定出325种化合物,有酸类物质20种、醇类48种、醛类12种、烷烃类12种、苯类43种、酯类57种、杂环类9种、酮类23种、木脂素类3种、含氮类10种、类固醇3种、琥珀酸和马来酸衍生物15种、单萜41种、多萜类21种及其他类8种。牛樟芝药用化学物质丰富,上述化合物中有57种具有药用功能,其中苯类13种、酯类1种、单萜22种、多萜1种、琥珀酸和马来酸衍生物13种,其他类7种,实验室数据已揭示其功能活性包括细胞毒性、抗衰老、消炎、抗癌、抗病毒和神经保护等[15-21](表1)。
3 药理作用
3.1 抗肿瘤作用
牛樟芝已被发现具有多种抗癌活性。(1)抗肝癌活性。牛樟芝粗提取物对肝癌细胞HEP G2、HEP 3B、PLC/PRF/5等都具有明显的细胞毒性[22]。其甲醇提取物能上调表达半胱氨酸天冬氨酸蛋白酶3(caspase-3)和半胱氨酸天冬氨酸蛋白酶8(caspase-8),阻止癌细胞Hep G2由G0向G1正常分裂,引起畸变死亡[23];其乙酸乙酯提取物能调控Bcl家族蛋白表达,产生细胞色素c(cytochrome c)和半胱氨酸天冬氨酸蛋白酶9(caspase-9),引起癌细胞HEP G2、HEP 3B和PLC/PRF/5的死亡,或通过增加癌细胞HEP 3B的胞内钙离子浓度,激活钙蛋白酶和半胱氨酸天冬氨酸蛋白酶12(caspase-12),引起癌细胞HEP 3B死亡[24]。牛樟芝粗提取物能激活肝癌免疫系统活性,用1 000 mg/(kg·d)的剂量连续处理携带肝癌细胞H22的小鼠发现,其巨噬细胞的吞噬作用、T细胞的增殖活性、B细胞的形成能力以及自然杀伤细胞(NK细胞)、淋巴因子活化杀伤细胞(LAK细胞)的毒性显著增强,CD4+/CD8+指标恢复正常,重组白细胞介素-2(IL-2)、肿瘤坏死因子-α(TNF-α)含量增加,对肝癌细胞H22的抑制率达74.24%[25]。牛樟芝粗提物能抑制肝癌细胞转移和扩散,用300 mg/(kg·d)的牛樟芝乙酸乙酯提取物处理小鼠,结果发现,其能诱导核转录因子-κB信号通路(NF-κB)形成,降低血管内皮生长因子(VEGF)、基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)的表达水平,增加金属蛋白酶组织抑制因子1(TIMP-1)、金属蛋白酶组织抑制因子2(TIMP-2)的表达水平,抑制肝癌细胞侵染和扩散[26]。牛樟芝还可以作为抗肝癌的辅助治疗药剂。1 μg/mL牛樟芝发酵菌丝与10 μmol/L铂化合物或10 μmol/L丝裂霉素共用,可以提高肝癌细胞C3A和PLC/PRF/5专性治疗药剂的疗效[27]。(2)抗乳腺癌活性。牛樟芝发酵液能抑制细胞周期蛋白D1(cyclin D1)、细胞周期蛋白A(cyclin A)、细胞周期蛋白E(cyclin E)、周期蛋白依赖性激酶4(CDK4)、环氧合酶-2(COX-2)、前列腺素E2(PGE2)和增殖细胞核抗原(PCNA)的产生,增加周期蛋白依赖性激酶(CDK)抑制因子、上调细胞周期抑制蛋白(P27/KIP)和重组周期蛋白依赖蛋白激酶抑制剂1(P21/WAF1)基因表达,激活caspase-3、caspase-8、caspase-9,降解DNA修复酶(PARP),释放cytochrome c,停滞细胞分裂于G1期,限制乳腺癌细胞MDA-MB-231 增殖,引起细胞死亡[28]。牛樟芝发酵液在25~150 μg/mL剂量下能激活caspase-3,降解多聚ADP核糖聚合酶(PARP),调控Bcl-2基因和Bax(一种兔抗人单克隆抗体)的表达,释放cytochrome c,引起乳腺癌细胞MCF-7死亡[29]。(3)抗前列腺癌活性。牛樟芝粗提物在150 μg/mL剂量下能激活蛋白激酶B(AKT),上调表达P53和P21基因,抑制cyclin D1和CDK4的产生,阻止细胞由G1期向S期分裂,引起前列腺癌细胞LNCaP死亡;也可以在100~200 μg/mL 剂量下,激活AKT,上調表达P53和P21基因,抑制细胞周期蛋白B1(cyclin B1)和蛋白激酶Cdc2的产生,阻止细胞由G2期向M期分裂,引起前列腺癌细胞PC-3死亡[30]。(4)抗膀胱癌活性。牛樟芝粗提物在50 μg/mL剂量下,能抑制MMP-9、cyclin B1和Cdc2的产生,使膀胱癌细胞T24的转移和增殖活性显著下降[31]。(5)抗肺癌活性。牛樟芝乙醇提取物能下调重组人半乳糖凝集素-1(galectin-1)、翻译启动子(TIF 5A)和裂解抑制子(Rho GDP DI α)、钙蛋白亚基(CaDPSS)和膜联蛋白V(Annexin V)的表达,引起肺癌细胞A549死亡[32]。(6)其他抗癌活性。牛樟芝子实体乙醇提取物能上调组蛋白去乙酰化酶1(HDAC 1)的表达,下调组蛋白乙酰转移酶(GCN 5、CBP、PCAF)的表达,引起癌细胞HL60的死亡[33];25~150 μg/mL发酵菌丝水提物能引起癌细胞HL60染色体凝结,核小体间DNA断裂,造成癌细胞HL60失活[34];100 μg/mL 粗提物能上调表达P21,下调表达肿瘤抑制因子(pRb),显著抑制癌细胞RT4增殖[31];100~200 μg/mL菌丝粉能抑制胞外信号调节激酶(ERK MAPK)的磷酸化,降低癌细胞MG63的活力,诱导细胞死亡[35]。半抑制细胞浓度(IC50)为4.1 μg/mL的三氯化碳和甲醇提取物对癌细胞P388具有明显的细胞毒性,相应地,癌细胞Jurkat的细胞毒性IC50为40 μg/mL,癌细胞Colon 205的三氯化碳提取物IC50为60 μg/mL[36]。
牛樟芝含有多种抗癌活性物质。研究发现,战奎酸A(Zhankuic acids A)、战奎酸C(Zhankuic acids C)对癌细胞P-388 具有细胞毒性,IC50分别是1.8、5.4 μg/mL[37]。Antrodins B、Antrodins C也具有细胞毒性,半数有效量(ED50)分别是7.5、3.6 μg/mL[38];Antcin A、Antcin C和Methylantcinate A能抑制肝癌细胞Huh7、Hep G2和Hep 3B增殖,而对正常肝细胞无影响[39];Antroquinonol对乳腺癌细胞(MCF-7、DA-MB-231)、肝癌细胞(Hep 3B、Hep G2)、前列腺癌细胞(DU-145和LNCaP)具有细胞毒性,其IC50介于(0.13±0.02)~(6.09±0.07) μmol/L之间[40];Zhankuic acid A、Zhankuic acid C、Methylantcinate B对结肠癌、乳腺癌、肝癌和肺癌细胞具有专一的细胞毒性,IC50介于22.3~75.0 μg/mL 之间[41];4-acetylantroquinonol B能使癌细胞U937、BxPC3产生细胞分裂障碍,抑制癌细胞增殖[42]。Antrocin能引起乳腺癌细胞MMCS死亡,IC50为0.6 μmol/L[43];4 μmol/L的Zhankuic acid A、Zhankuic acid C、Methyl antcinate可引发癌细胞HT-29死亡[41];50~150 μmol/L 4,7-Dimethoxy-5-methyl-l,3-benzodioxole能干扰结肠癌细胞COLO205由G0向G1期正常分裂,同样的剂量则对上皮细胞无害,150 μmol/L以上的剂量则能引起细胞死亡[44];Zhankuic acids能引起癌细胞HT-29和SW-480死亡[41];具有抗癌活性的多糖是β-D葡聚糖,其一般具有β-(1→3)-D-glucopyranans和β-(1→6)-D-glucosyl分枝结构,对癌细胞U937、S180表现出显著的抑制作用[45]。
3.2 增强免疫力
牛樟芝免疫刺激和免疫调节效果相关研究证明,胞外刺激能激活不同的免疫系统。口服3~6周牛樟芝多糖衍生物能增加转基因鼠脾脏中CD4+-T细胞和B细胞的数量和比例,诱导产生Th1型细胞激素(IFN-γ和TNF-α),降低曼氏血吸虫(Schistosoma mansoni)的感染率,表明牛樟芝可以激活小鼠Th1免疫系统[46]。用4 μg/g牛樟芝发酵液处理巨噬细胞和NK细胞,能增强其吞噬作用和靶向杀死作用[47],牛樟芝多糖、腺苷酸、25~100 μg/mL水提物和3~25 μg/mL三氯化碳子实体提取物能提高单核吞噬细胞的TNF-α、PGE2、重组人白细胞介素-12(IL-12)、诱导型一氧化氮合酶(iNOS)、重组人白细胞介素-6(IL-6)产生能力,抑制NO诱导形成脂多糖,增强其吞噬作用[48];5~60 μg/mL发酵菌丝和滤液的热水提取物在溶血培养试验中也显示了TNF-α、IL-6的诱导活性,牛樟芝粗体物能诱导小鼠淋巴结细胞的IFN-γ mRNA上调表达,产生IL-12、IFN-α,增加细胞毒性T淋巴细胞(CTLs)数量,增强CD4+和CD8+T细胞渗透性,提高引流淋巴结DC的活化作用,增强小鼠对牛痘DNA的抗性[49]。这些结果证明,牛樟芝具有激发先天免疫活性的效果,是一种具有潜力的免疫调节辅剂。
牛樟芝免疫调节功能活性物质多样。研究发现,Me-AntK和Methyl antcinate K能诱导Ag-专性T-细胞增殖,促进辅助性T细胞(Th2细胞)分化,促使DC化脓,增加主要组织相容性复合体(MHC)家族二型和诱导T细胞增殖协同因子(CD86)的上调表达,增强DC和Th2免疫调节作用[50]。Antcin A、Antcin B、齿孔醇(Eburicol)能抑制中性粒白细胞产生超氧化物,具有免疫调节活性,IC50分别是8.5、9.8、50.5 μg/mL[51]。Antcin C(IC50=16.9 μg/mL)、Antcin K(1~25 μmol/L)、脫氢齿孔酸(dehydroeburicoic acid)(IC50=144.8 μg/mL)和齿孔酸(eburicoic acid)(IC50=43.9 μg/mL)、Zhankuic acid A、Zhankuic acid B、Zhankuic acid C能降低中性粒白细胞的产活性氧(ROS)活性[52]。trans-3-isobutyl-4-[4-(3-methyl-2-butenyloxy) phenyl]pyrrolidine-2,5-dione(IC50=10 μg/mL)能刺激中性粒白细胞产生TNF-α,降低细胞脂多糖(LPS)诱导细胞分泌的IL-6(IC50=10 μg/mL)的量。化合物cis-3-(4-hydroxyphenyl)-4-isobutyldihydrofuran-2,5-dione、3-(4-hydroxyphenyl)-4-isobutyl-1hpyrrole-2,5-dione、dimethyl 2-(4-hydroxyphenyl)-3-isobutylmaleate抑制细胞LPS产生IL-6(IC50分别是17、18、25 μg/mL)[53]。antrocinnamomins A能抑制巨噬细胞中NO的产生[54]。γ-十二内酯(γ-dodecalactone)能刺激NK细胞分泌人凋亡相关因子配体(FasL)、人颗粒酶B(Granzyme B)、TNF-α、INF-γ[55]。蛋白ACA能介导TLR2/MyD88依赖型巨噬细胞的极化和分化,上调表达CD86,刺激产生TNF-α和IL-1β,提高吞噬活性,增强其吞噬作用[56]。多糖GF2可诱导酯多糖激活DCs,产生IL-10和IL-12,抑制CD4+T细胞增殖,具有辅助治疗过敏性哮喘的潜力[57]。菌丝多糖蛋白AC-1、AC-2、AC-3、AC-4、AC-5(分子量在394~940 ku之间)都表现出免疫活性,1 μmol/L多糖蛋白AC-1和AC-2能清除745%和50.5%的1,1-二苯基-2-三硝基苯肼(DPPH)自由基,50~200 μg/mL多糖蛋白AC-2能抑制巨噬细胞产生NO和iNOS[58]。
3.3 预防和治疗肝病
乙型肝炎病毒(HBV)、活性自由基氧化作用、乙醇、四氯化碳、痤疮丙酸杆菌是肝病的重要诱因[59]。牛樟芝能清除自由基,增强抗氧化酶活性,诱导肝细胞再生,发挥保肝作用。研究发现,牛樟芝菌株B86的多糖(50 μg/mL)无细胞毒性,但具有较高的抗乙型肝炎病毒活性,效果优于1 000 U/mL的α-干扰素[45];牛樟芝乙醇提取物对乙肝表面抗原(HBsAg)和乙型肝炎E抗原(HBeAg)野生型HBV都具有抗性活性,说明牛樟芝具有抗HBV活性[60]。研究数据显示,牛樟芝是一个有效的自由基直接清除剂,其提取物(IC50=3.1 mg/mL)能清除DPPH、羟基和超氧阴离子自由基,抑制脂质过氧化反应,降低低密度脂蛋白的氧化修饰活性,降低铁离子的螯合和还原能力、抗γ射线(20 kgy)辐射氧化能力[61]。用牛樟芝处理急性乙醇中毒小鼠,其谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶和胆红素含量显著降低,其效果与水飞蓟素相当,说明牛樟芝可以预防乙醇性肝损伤[62]。四氯化碳在常态下会释放三氯化碳自由基,干扰细胞膜上脂肪和蛋白质等大分子物质的结构和功能,导致肝中毒和肝纤维化,口服牛樟芝子实体水提物的四氯化碳处理小鼠,其肝胶原蛋白1、转化生长因子-β1(TGF-β1)、TIMP-1表达水平下调,总谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)比值升高,谷胱甘肽过氧化物酶、谷胱甘肽还原酶、谷胱甘肽-S转移酶活性显著降低,由四氯化碳引起的中性白细胞浸润、水肿、坏死等症状少见,微纤维化结节消失,肝纤维化逐步逆转[63],说明牛樟芝能治疗由四氯化碳导致的肝损伤和肝纤维化。用痤疮丙酸杆菌+脂多糖处理小鼠,会诱发急性肝炎,服用牛樟多糖ACN2a[0.4~0.8 g/(kg·d)]后,其血清中AST和ALT活性显著降低,说明牛樟芝能治疗痤疮丙酸杆菌+脂多糖诱发的急性肝炎[64]。
2,2′,5,5′-tetramethoxy-3,4,3′,4′-dimethlylenedioxy-6,6′-dimethyl biphenyl对野生型和突变型乙型肝炎病毒都具有抗性活性,联苯对野生型HBV细胞ES2的抗性与1 000 U/mL 的α-2a干扰素相当,对突变型HBV细胞M33的抗性则与250 U/mL的α-2a干扰素相当[65]。最近,从牛樟芝中又分离到Camphorataimide B,该物质在50 μmol/L 的剂量下,对乙肝表面抗原(HBsAg)和乙型肝炎E抗原(HBeAg)的抑制表达效率分别是35.2%和12.8%。牛樟芝菌丝和子实体中的环己烯酮Antroquinonol具有抑制HBsAg和HBeAg合成的作用,从而具有抑制HBV的功能[60]。
3.4 消炎功能
炎症是移除生物毁坏、物理创伤、ROS过氧化反应和化学创伤等伤害刺激,恢复正常生理功能的生化反应过程[39]。活性氧是炎症的主要介质,研究发现,1~50 μg/mL牛樟芝预处理可以减少活性氧的形成[66]。Chen等研究发现,牛樟芝菌丝含量为25~100 μg/mL的牛樟芝纯培养物可以抑制NO和PGE2的产生[53],牛樟芝甲醇提取物可以抑制神经胶质细胞中iNOS和COX-2的表达,减轻耳肿[67]。牛樟芝正己烷提取物能抑制小鼠尿蛋白的表达(100 μg/g),降低血尿氮素含量水平(200 μg/g),降低肾小球基膜厚度(400 μg/g),从而预防肾炎[68]。牛樟芝培养液能抑制TNF-α和NO的产生,降低丙二醛(MDA)、iNOS、COX-2含量水平,增加过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)活性,消除肝部水肿[69]。许多牛樟芝化合物显示消炎活性,例如Zhankuic acids A、 B、C和Antcin K可以减少趋化肽(FMLP)和佛波酯(PMA)诱导的活性氧产生量[70]。Antrocamphin A、Antcin A、Antcin B在剂量<10 μmol/L时就能抑制超氧化物产生。牛樟芝的多糖和腺苷能促进自发性分泌TNF-α,抑制IL-6产生,激活巨噬细胞,发挥消炎活性[51]。dimethyl 2-(4-hydroxyphenyl)-3-isobutylmaleate可抑制IL-6的产生,IC50为25 μg/mL[54]。Ergostatrien-3β-ol能抑制TNF-α和NO的产生,降低与MDA、iNOS、COX-2含量水平、增加CAT、SOD和GPx活性,消除肝部水肿[71]。
3.5 其他功能
除上述功能外,牛樟芝还被发现具有神经保护、预防和治疗心血管疾病、干扰幽门螺旋杆菌侵染、提高专性药剂药效和杀虫等功能。牛樟芝发酵液能抑制c-Jun氨基末端激酶(JNK)和蛋白激酶P38活性,保持细胞PC-12的活力[72]。从牛樟芝子实体中分离出的具有保护小鼠大脑皮层神经元细胞功能活性的化合物有19-hydroxylabda-8(17)-en-16,15-olide、3β,19-dihydroxylabda-8(17)、11E-dien-16,15-olide、13-epi-3β,19-dihydroxylabda-8(17)、19-hydroxylabda-8(17),13-dien-16,15-Olide、14-deoxy-11,12-didehydroandrographolide,活性剂量为5~20 μmol/L[73]。这些结果说明,牛樟芝具有神经保护作用。10 μg/g的牛樟芝子实体及菌丝甲醇提取物能够降低小鼠的舒张压和收缩压[74];菌落B85发酵菌丝具有舒张血管的作用,最大舒张率为40.34%±7.53%[75]。这些结果预示,牛樟芝可能是心血管疾病的保健功能药品原料。从牛樟芝中分离的化合物Antcin A、Antcin K、Methyl antcinate B能激活胃上皮细胞AGS的NF-κB活性,释放IL-8z,抑制幽门螺旋杆菌的黏附和侵染作用,发挥其胃病治疗功效[76]。牛樟芝粗提物与铂化合物及丝裂霉素共用,能抑制肝癌等癌细胞的增殖效率,延长小鼠寿命,降低抗癌药物的使用剂量[26];牛樟芝发酵液与黄芪(Astragalus membranaceus)、丹参(Salvia miltiorrhiza)、枸杞(Lycimm chinense)的提取物共用能提高抑制四氯化碳处理动物肝部的ALT水平。这些结果说明,牛樟芝可作为一種抗癌或肝病治疗的辅剂[77]。分离于牛樟芝的化合物Zhankuic acid A、Zhankuic acid C、Methyl antcinate B、Dehydroeburicoic acid、Dehydrosulphurenic acid、15α-Acetyl-dehydrosul-phurenic acid、Sulphurenic acid、3β,15α-Dihydroxylanosta-7,9(11),24-triene-21-oic acid等对草地贪夜蛾(Spodoptera frugiperda)的昆虫卵巢细胞(Sf 9细胞)具有抑制作用,其中Zhankuic acids A、C和Methyl antcinate B效果较好,同时发现,牛樟芝多糖能降低Schistosoma mansoni的感染率,这些结果表明,牛樟芝还具有一定杀虫效果[78]。
4 栽培技术
牛樟芝生长缓慢、寄主单一、难形成子实体等特点是限制其开发利用的瓶颈问题[71],目前借鉴食药用菌传统栽培方法培育牛樟芝是一种保护和利用牛樟芝的关键策略。牛樟芝的人工培育方法主要有3种。一是椴木栽培法,即用牛樟树椴木作为牛樟芝的培养基质,通过喷洒或浸泡接种液体菌种,将其置于合适的温湿度环境中进行培养。该方法能诱导牛樟芝长出活性成分与野生牛樟芝接近的子实体,但牛樟树数量稀少,培养成本高;牛樟芝生长速度慢,培养时间长(2~3年);培养过程中容易污染、质量较难控制等缺陷限制其大规模生产应用[9]。二是固体培养法,即在太空包中填充入纤维物、谷物、杂粮等培养料,灭菌后接入菌种,待菌丝分散布满培养料时,再开口通气培养。该方法能在3个月内获得一定量的菌丝体或与野生牛樟芝外形相似的子实体[79],但其化学成分与野生牛樟芝存在较大差别,产品质量难以保证,极大地限制了其大规模生产应用[80]。三是深层液体发酵法,即利用营养物质制成液体状培养基,灭菌后接入菌种,振荡培养特定时间后获得菌体及代谢产物。该方法周期短、成本低、质量可控[81],但发酵产生的牛樟芝菌丝体所含化学成分与子实体有较大区别,尤其是药用成分三萜类化合物的种类和数量都较子实体大量减少,药用价值较低[82]。
聚焦上述瓶颈问题,牛樟芝发酵工艺成为一个研究热点。(1)提高牛樟芝菌体生长速度。田雪梅等发现,28~32 ℃是最适宜菌丝体生长的温度范围,日均生长量长达0.384 cm[83]。姚秀英认为,在4 ∶7的大米和水制成的培养基中,菌丝体干质量增长迅速,在55 d可达12.89 g[84]。张宝荣确定以葡萄糖为碳源,大豆水解液和玉米浆为氮源,添加硫酸镁和磷酸氢二钠制成的培养基为最佳培养基,以温度28 ℃、摇床转速120 r/min、pH值5.5为最佳培养条件[85]。许正宏等发明的二次发酵技术可缩短40%的发酵周期,即用一次发酵产生的无性孢子作为二次发酵的接种体,实施2次发酵[86]。(2)诱导子实体形成。目前已报道用小叶红心樟为椴木,用蒲公英、虎杖、黄连、陈茵、荷叶提取物及蛋白胨作为添加剂,培养150~180 d,能诱导出与野生型外观、气味、成分一致的牛樟芝子实体[87]。另外,用马铃薯葡萄糖抽出物、葡萄糖作为主要原料,添加山药、陈皮、当归、柴胡和槟榔等中药混合物,培养120~150 d,也能培育出与野生型具有相同药用成分的子实体[88]。陈永得对马铃薯培养基进行改进,通过添加用红曲霉发酵大米后的营养物,混合发酵小麦、麸皮浸出液等,能在50~70 d后收获黄白色菌膜和红色的子实体[89]。(3)专性诱导药物成分。菌株是菌丝体活性功能的一个影响因素。研究发现,从菌株B71、B85和B86等中分离的多糖抗HBV活性具有差异性;菌株B85的菌丝提取物具有最好的舒张血管作用[90]。营养物质是菌丝体活性功能的另一个影响因素。以葡萄糖为碳源、蛋白胨和黄豆粉为氮源,能获得最多数量和种类的三萜类物质[91];多种柑橘属植物果皮提取物具有促进牛樟芝产生三萜类化合物的效果,其中橘子皮效果最佳,发酵28 d能增加三萜类化合物含量10倍以上[92];香樟石油醚提取物能增加牛樟芝三萜含量30.78%左右,其中α-松油醇是促进樟芝萜类化合物合成的主要物质[17]。另外,培养条件也影响菌丝体的活性功能。Lin等发现,表多糖生成的最佳培养条件为温度28 ℃,pH值5.5,时间14 d,额外添加葡萄糖、硝酸钙、硫酸亚铁和烟酸(添加量分别为5%、0.5%、0.1%和0.1%)后,能够产生最大量的表多糖,含量高达0.49 g/L[93]。此外,朱会霞等研究发现,溶氧浓度(15%~20%)、装液量(120 mL)、摇瓶转速(150 r/min)和接种量(15%)也可以影响多糖产量[94]。另外,喻学淳等发现,用初始含水量为50%的大米作为基质,外加2.0 g葡萄糖碳源和0.3 g大豆粉氮源,在1 L三角瓶中装料110 g发酵牛樟芝,可获得最高的Antroquinonol 产量(696.83 mg/kg)[95]。
5 结论及展望
牛樟芝(Antrodia comphorata)是一种具有潜在应用价值的珍稀药用真菌,具有抗肿瘤、增强免疫力、预防和治疗肝病以及消炎等生物活性,现已从牛樟芝中分离获得15类325種化合物,并揭示了其中57种化合物的生物活性功能。但因其寄主专一性、野生资源稀有性和人工培育困难性,牛樟芝可持续发展面临严峻挑战。目前,为获得牛樟芝的子实体、菌丝以及人类需要的有用代谢物,采用椴木栽培、固体培养和深层液体发酵等方法生产牛樟芝发酵物,已成为牛樟芝资源利用和保护的重要策略。
聚焦牛樟芝的相关研究发现,不同来源的牛樟芝菌株其生物活性具有差异性[96];野生子实体与发酵菌丝和培养液的生物活性功能和化合物组成存在差异性[15];粗提物与分离获得的纯化合物生物活性间缺少对应关系,不同活性化合物间具有协同作用[97];培养基和培养条件等因素会影响牛樟芝生长和代谢,进而影响其生物活性和化合物产量[15]。因此,牛樟芝要实现其药用价值,大量用于药品生产,并用于临床治疗,须要进一步借助分子生物学技术手段揭示其地理起源,选择具有工业应用价值的标准菌株,进一步发展活性物质诊断的质量参数和活性分析方法,挖掘其新奇化合物和新奇功能,验证化合物的生物活性,开展临床试验研究,揭示化合物的作用机制,并评估其安全性;进一步揭示和组装子实体诱导和活性化合物激发因素,以便在人工栽培条件下获得大量富含功能活性物质的发酵物[97]。
参考文献:
[1]孙芙蓉. 我国中草药的知识产权保护研究[D]. 郑州:郑州大学,2004.
[2]Dai Y C,Yang Z L,Cui B K,et al. Species diversity and utilization of medicinal mushroons and fungi in China(Review)[J]. International Journal of Medicinal Mushrooms,2009,11(3):287-302.
[3]殷培峰,浦冠勤. 中国药用真菌研究进展[J]. 滁州学院学报,2008,10(6):58-60.
[4]耿 燕,陆震鸣,史劲松,等. 中国药用真菌资源开发与应用研发现状与展望[J]. 生物产业技术,2013(1):32-36.
[5]战林华,董 云,蒋丽芹. 樟芝的药用保健价值及市场研究分析[J]. 中外企业家,2013(5):63-64.
[6]陈体强,方忠王. 珍稀药用菌樟芝研究现状与进展[J]. 食用菌学报,2003,10(4):55-60.
[7]马晓蕾. 台湾红宝石——牛樟菇[J]. 中国商贸,2013(19):42-43.
[8]夏永军,张贤芳,许赣荣. 响应面法优化樟芝液态发酵产Antrodin C[J]. 食品科学,2012,33(11):185-189.
[9]郭立忠,贾培培,郭奇林,等. 一种微通气椴木栽培樟芝的方法:102047814[P]. 2011-05-11.
[10]Krik P M,Cannon P F,Minter D W,et al. Dictionary of the fungi[M]. Connecticut:CAB international,2008:54-55.
[11]Wu S H,Ryvarden L,Chang T T. Antrodia camphorata (“Niu-Chang-Chih”),new combination of a medicinal fungus in Taiwan[J]. Botanical Bulletin of Academia Sinica,1997,38(4):273-275.
[12]董彩虹,劉奇正,张娇娇. 近十年中国重要食药用菌研究进展[J]. 微生物学杂志,2017,37(4):1-9.
[13]Chiu H H. Phylogenetic analysis of Antrodia species and Antrodia camphorata inferred from internal transcribed spacer region[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,2007,91(3):267-276.
[14]Su C H. Health Guardian angel:Antrodia camphorata. 1st edition[M]. Taipei:EKS Book Publishing,2002.
[15]Ao Z H,Xu Z H,Lu Z M,et al. Niuchangchih (Antrodia camphorata) and its potential in treating liver diseases[J]. Journal of Ethnopharmacology,2009,121(2):194-212.
[16]Huang C H,Chen Y J,Lin C C. Antrodia cinnamomea (A. camphorata,neu chang chih):an exceptional polypore mushroom with potential antitumor and immuno-modulatory effects[J]. Current Topics in Nutraceutical Research,2012,10(1):61-74.
[17]陆震鸣. 樟芝深层液态发酵及其三萜类化合物的研究[D]. 无锡:江南大学,2009:21.
[18]Geethangili M,Tzeng Y M. Review of pharmacological effects of Antrodia camphorata and its bioactive compunds[J]. Evid Based Complement Alternat Med,2010:1-17.
[19]Liu H,Jia W,Zhang J S,et al. GC-MS and GC-olfactometry analysis of aroma compounds extracted from culture fluids of Antrodia camphorata[J]. World Journal of Microbiology & Biotechnology,2008,24(8):1599-1602.
[20]Chen Y C,Chiu H L,Chao C Y,et al. New anti-inflammatory aromatic components from Antrodia camphorata[J]. International Journal of Molecular Sciences,2013,14(3):4629-4639.
[21]Chen P Y,Wu J D,Tang K Y,et al. Isolation and synthesis of a bioactive benzenoid derivative from the fruiting bodies of Antrodia camphorata[J]. Molecules,2013,18(7):7600-7608.
[22]Hsu Y L,Kuo Y C,Kuo P L,et al. Apoptotic effects of extract from Antrodia camphorata fruiting bodies in human hepatocellular carcinoma cell lines[J]. Cancer Letters,2005,221(1):77-89.
[23]Song T Y,Hsu S L,Yen G C,et al. Induction of apoptosis in human heptoma cells by mycelium of Antrodia camphorata in submerged culture[J]. Journal of Ethnopharmacology,2005,100(3):158-167.
[24]Kuo P L,Hsu Y L,Cho C Y,et al. Apoptotic effects of Antrodia cinnamomea fruiting bodies extract are mediated through calcium and calpain-dependent pathways in Hep 3B cells[J]. Food and Chemical Toxicology,2006,44(8):1316-1326.
[25]單丽珠,宋 腾,王华庆. 牛樟芝联合化疗对恶性肿瘤患者免疫功能的影响[J]. 中国中西医结合外科杂志,2015(6):552-555.
[26]Hsu Y L,Kuo P L,Cho C Y,et al. Antrodia cinnamomea fruiting bodies extract suppresses the invasive potential of human liver cancer cell line PLC/PRF/5 through inhibition of nuclear factor B pathway[J]. Food and Chemical Toxicology,2007,45(7):1249-1257.
[27]Chang C Y,Huang Z N,Yu H H,et al. The adjuvant effects of Antrodia camphorata extracts combined with antitumor agents on multidrug resistant human hepatoma cells[J]. Journal of Ethnopharmacology,2008,118(3):387-395.
[28]Hseu Y C,Chen S C,Chen H C,et al. Antrodia camphorata inhibits proliferation of human breast cancer cells in vitro and in vivo[J]. Food and Chemical Toxicology,2008,46(8):2680-2688.
[29]Yang H L,Chen C S,Chang W H,et al. Growth inhibition and induction of apoptosis in MCF-7 breast cancer cells by Antrodia camphorata[J]. Cancer Letters,2006,231(2):215-227.
[30]Chen K C,Peng C C,Peng R Y,et al. Unique formosan mushroom Antrodia camphorata differentially inhibits androgen-responsive LNCaP and -independent PC-3 prostate cancer cells[J]. Nutrition and Cancer-An International Journal,2007,57(1):111-121.
[31]Peng C C,Chen K C,Peng R Y,et al. Antrodia camphorata extract induces replicative senescence in superficial TCC,and inhibits theabsolute migration capability in invasive bladder carcinoma cells[J]. Journal of Ethnopharmacology,2007,109(1):93-103.
[32]Wu H,Pan C L,Yao Y C,et al. Proteomic analysis of the effect of Antrodia camphorata extract on human lung cancer A549 cell[J]. Proteomics,2006,6(3):826-835.
[33]Lu M C,Du Y C,Chuu J J,et al. Active extracts of wild fruiting bodies of Antrodia camphorata (EEAC) induce leukemia HL 60 cells apoptosis partially through histone hypoacetylation and synergistically promote anticancer effect of trichostatin A[J]. Archives of Toxicology,2009,83(2):121-129.
[34]Hseu Y C,Yang H L,Lai Y C,et al. Induction of apoptosis by Antrodia camphorata in human premyelocytic leukemia HL-60 cells[J]. Nutrition and Cancer-An International Journal,2004,48(2):189-197.
[35]Lu Y C,Huang C,Huang C J,et al. Effects of Antrodia camphorata on viability,apoptosis,[Ca2+]i,and MAPKs phosphorylation in MG63 human osteosarcoma cells[J]. Drug Development Research,2007,68(2):71-78.
[36]Rao Y K,Fang S H,Tzeng Y M. Evaluation of the anti-inflammatory and anti-proliferation tumoral cells activities of Antrodia camphorata,Cordyceps sinensis,and Cinnamomum osmophloeum bark extracts[J]. Journal of Ethnopharmacology,2007,114(1):78-85.
[37]Chen C H,Yang S W,Shen Y C. New steroid acids from Antrodia cinnamomea,a fungal parasite of Cinnamomum micranthum[J]. Journal of Natural Products,1995,58(11):1655-1661.
[38]Huang K F,Huang W M,Chiang H C,et al. Phenyl compounds from Antrodia cinnamomea[J]. Chinese Pharmaceutical Journal,2001,53(6):327-331.
[39]Yunchih H,Rao Y K,Wu C C,et al. Methyl antcinate a from Antrodia camphorata induces apoptosis in human liver cancer cells through oxidant-mediated cofilin-and bax-triggered mitochondrial pathway[J]. Chemical Research in Toxicology,2010,23(7):1256-1267.
[40]Hseu Y C,Chen S C,Tsai P C,et al. Inhibition of cyclooxygenase-2 and induction of apoptosis in estrogen-nonresponsive breast cancer cells by Antrodia camphorata[J]. Food and Chemical Toxicology,2007,45(7):1107-1115.
[41]Yeh C T,Rao Y K,Yao C J,et al. Cytotoxic triterpenes from Antrodia camphorata and their mode of action in HT-29 human colon cancer cells[J]. Cancer Letters,2009,285(1):73-79.
[42]Lin Y W,Pan J H,Liu R H,et al. The 4-acetylantroquinonol B isolated from mycelium of Antrodia cinnamomea inhibits proliferation of hepatoma cells[J]. Journal of the Science of Food and Agriculture,2010,90(10):1739-1744.
[43]Rao Y K,Wu A T,Geethangili M,et al. Identification of antrocin from Antrodia camphorata as a selective and novel class of small molecule inhibitor of Akt/mTOR signaling in metastatic breast cancer MDA-MB-231 cells[J]. Chemical Research in Toxicology,2011,24(2):238-245.
[44]Lien H M,Lin H W,Wang Y J,et al. Inhibition of anchorage-independent proliferation and G0/G1 cellcycle regulation in human colorectal carcinoma cells by 4,7-dimethoxy-5-methyl-l,3-benzodioxole isolated from the fruiting body of Antrodia camphorata[J]. Evidence-Based Complementary and Alternative Medicine,2011,4(1):1-10.
[45]Lee I H,Huang R L,Chen C T,et al. Antrodia camphorata polysaccharides exhibit anti-hepatitis B virus effects[J]. FEMS Microbiology Letters,2002,209(1):63-67.
[46]Chen Y J,Cheng P C,Lin C N,et al. Polysaccharides from Antrodia camphorata mycelia extracts possess immunomodulatory activity and inhibits infection of Schistosoma mansoni[J]. International Immunopharmacology,2008,8(3):458-467.
[47]Lin S Y,Sheen L Y,Chiang B H,et al. Dietary effect of Antrodia camphorata extracts on immune responses in WEHI-3 leukemia BALB/c mice[J]. Nutrition and Cancer,2010,62(5):593-600.
[48]Hseu Y C,Wu F Y,Wu J J,et al. Anti-inflammatory potential of Antrodia camphorata through inhibition of iNOS,COX-2 and cytokines via the NF-kappaB pathway[J]. International Immunopharmacology,2005,5(13/14):1914-1925.
[49]Kuo M C,Chang C Y,Cheng T L,et al. Immunomodulatory effect of Antrodia camphorata mycelia and culture filtrate[J]. Journal of Ethnopharmacology,2008,120(2):196-203.
[50]Yu Y L,Chen I H,Shen K Y,et al. A triterpenoid methyl antcinate K isolated from Antrodia cinnamomea promotes dendritic cell activation and Th2 differentiation[J]. European Journal of Immunology,2009,39(9):2482-2491.
[51]Chen J J,Lin W J,Liao C H,et al. Antiinflammatory benzenoids from Antrodia camphorata[J]. Journal of Natural Products,2007,70(6):989-992.
[52]Shen Y C,Chen C F,Wang Y H,et al. Evaluation of the immuno-modulating activity of some active principles isolated from the fruiting bodies of Antrodia camphorata[J]. Chinese Pharmaceutical Journal,2003,55(5):313-318.
[53]Chen C C,Chyau C C,Hseu T H. Production of a COX-2 inhibitor,2,4,5-trimethoxybenzaldehyde,with submerged cultured Antrodia camphorata[J]. Letters in Applied Microbiology,2007,44(4):387-392.
[54]Chien S C,Chen M L,Kuo H T,et al. Anti-inflammatory activities of new succinic and maleic derivatives from the fruiting body of Antrodia camphorata[J]. Journal of Agricultural and Food Chemistry,2008,56(16):7017-7022.
[55]Chen C J,Vijaya K R,Tsai C C,et al. Structure and functions of r-dodecalactone isolated from Antrodia camphorata for NK cell activation[J]. Bioorganic and Medicinal Chemistry,2010,18(18):6896-6904.
[56]Sheu F,Chien P J,Hsieh K Y,et al. Purification,cloning,and functional characterization of a novel immunomodulatory protein from Antrodia camphorata (bitter mushroom) that exhibits TLR2-dependent NF-κB activation and M1 polarization within murine macrophages[J]. Journal of Agricultural and Food Chemistry,2009,57(10):4130-4141.
[57]Liu K J,Leu S J,Su C H,et al. Administration of polysaccharides from Antrodia camphorata modulates dendritic cell function and alleviates allergen-induced T helper type 2 responses in a mouse model of asthma[J]. Immunology,2010,129(3):351-362.
[58]Chen C C,Liu Y W,Ker Y B,et al. Chemical characterization and anti-inflammatory effect of polysaccharides fractionated from submerge-cultured Antrodia camphorata mycelia[J]. Journal of Agricultural and Food Chemistry,2007,55(13):5007-5012.
[59]姜喜梅,孫建光. 肝病中医外治法临床应用综述[J]. 山东中医杂志,2015,34(4):318-320.
[60]Shen C C,Yang H C,Huang R L,et al. Anti-HBV principle from the culture broth of Antrodia camphorata(strainCCRC-35396)[J]. Journal of Chinese Medicine,2005,16(1):57-61.
[61]Hsiao G,Shen M Y,Lin K H,et al. Antioxidant and hepatoprotective effective of Antrodia camphorata extract[J]. Journal of Agricultural and Food Chemistry,2003,51(11):3302-3308.
[62]Lu Z M,Tao W Y,Zao X L,et al. Protective effects of mycelia of Antrodia camphorata and Armillariella tabescens in submerged culture against ethanol-induced hepatic toxicity in rats[J]. Journal of Ethnopharmcology,2007,110(1):160-164.
[63]Tsai M C,Song T Y,Shih P H,et al. Antioxidant properties of watersoluble polysaccharides from Antrodia cinnamomea in submerged culture[J]. Food Chemistry,2007,104(3):1115-1122.
[64]Han H F,Nakamura N,Zuo F,et al. Protective effects of a neutral polysaccharide isolated from the mycelium of Antrodia cinnamomea on Propionibacterium acnes and lipopolysaccharide induced hepatic injury in mice[J]. Chemical and Pharmaceutical Bulletin,2006,54(4):496-500.
[65]Huang R L,Huang Q L,Chen C F,et al. Anti-viral effects of active compounds from Antrodia camphorata on wild-type and lamivudineresistant mutant HBV[J]. The Chinese Pharmaceutical Journal,2003,55(5):371-379.
[66]Shen Y C,Chou C J,Wang Y H,et al. Anti-inflammatory activity of the extracts from mycelia of Antrodia camphorata cultured with water-soluble fractions from five different Cinnamomum species[J]. FEMS Microbiology Letters,2004,231(1):137-143.
[67]Liu D Z,Liang H J,Chen C H,et al. Comparative antiinflammatory characterization of wild fruiting body,liquidstate fermentation,and solid-state culture of Taiwanofungus camphoratus in microglia and the mechanism of its action[J]. Journal of Ethnopharmacology,2007,113(1):45-53.
[68]Chang J M,Lee Y R,Hung L M,et al. An extract of Antrodia camphorata mycelia attenuates the progression of nephritis in systemic lupus erythematosus-prone NZB/WF1 mice[J]. Evidence-Based Complementary and Alternative Medicine,2011(25):458-465.
[69]Huang G J,Huang S S,Lin S S,et al. Analgesic effects and the mechanisms of anti-inflammation of ergostatrien-3 beta-ol from Antrodia camphorata submerged whole broth in mice[J]. Journal of Agricultural and Food Chemistry,2010,58(12):7445-7452.
[70]Shen Y C,Wang Y H,Chou Y C,et al. Evaluation of the anti-inflammatory activity of zhankuic acids isolated from the fruiting bodies of Antrodia camphorata[J]. Planta Medica,2004,70(4):310-314.
[71]浦躍武,熊冬生. 樟芝的研究及其应用现状[J]. 中国医院药学杂志,2005,25(2):171-173.
[72]Huang N K,Cheng J J,Lai W L,et al. Antrodia camphorata prevents rat pheochromocytoma cells from serum deprivation-induced apoptosis[J]. FEMS Microbiology Letters,2005,244(1):213-219.
[73]Chen C C,Shiao Y J,Lin R D,et al. Neuroprotective diterpenes from the fruiting body of Antrodia camphorata[J]. Journal of Natural Products,2006,69(4):689-691.
[74]Liu D Z,Liang Y C,Lin S Y,et al. Antihypertensive activities of a solid-state culture of Taiwanofungus camphoratus (Chang-Chih) in spontaneously hypertensive rats[J]. Bioscience Biotechnology and Biochemistry,2007,71(1):23-30.
[75]Wang G J,Tseng H W,Chou C J,et al. The vasorelaxation of Antrodia camphorata mycelia:involvement of endothelial Ca2+-NO-cGMP pathway[J]. Life Sciences,2003,73(21):2769-2783.
[76]Geethangili M,Fang S H,Lai C H,et al. Inhibitory effect of Antrodia camphorata constituents on the Helicobacter pylori-associated gastric inflammation[J]. Food Chemistry,2010,119(1):149-153.
[77]Huang J S,Chang H C,Li E,et al. Enhancement of hepatoprotective efficacy of Antrodia camphorata by Chinese tradition medicine[J]. Journal of Gastroenterology and Hepatology,2006,21(2):A234.
[78]Cheng P C,Hsu C Y,Chen C C,et al. In vivo immunomodulatory effects of Antrodia camphorata polysaccharides in a T1/T2 doubly transgenic mouse model for inhibiting infection of Schistosoma mansoni[J]. Toxicology and Applied Pharmacology,2008,227(2):291-298.
[79]赵宗杰,李 静. 一种樟芝的大规模固体培养方法:101803534[P]. 2010-08-18.
[80]车长远,车长远. 樟芝的人工培养及其有效成分提取的研究现状[J]. 科技信息,2010(35):50,53.
[81]丁健峰. 羊肚菌富硒深层发酵工艺及产物功能性研究[D]. 长春:吉林大学,2014:7-8.
[82]贾 薇,刘艳芳,张劲松,等. 樟芝深层发酵培养条件的优化[J]. 食品科学,2004,25(5):52-55.
[83]田雪梅,宋爱荣. 温度对樟芝菌丝体生长的影响试验[J]. 中国食用菌,2005,24(5):51-52.
[84]姚秀英. 牛樟芝人工培养条件的初步研究[D]. 济南:山东师范大學,2011:21-22.
[85]张宝荣. 樟芝发酵及其代谢产物的初步研究[D]. 无锡:江南大学,2010:14.
[86]许正宏,陆震鸣,史劲松,等. 一种基于无性孢子的樟芝快速液态发酵工艺:102172174[P]. 2011-09-07.
[87]黄阿贤. 牛樟芝的椴木栽培法:103918472[P]. 2014-07-16.
[88]张闳积. 用以培养牛樟芝子实体的培养基及其培养方法:102746054[P]. 2012-10-24.
[89]陈永得. 人工快速繁育牛樟芝的方法:102283019[P]. 2011-12-21.
[90]Chiu H H,Lee F P,Wang J K,et al. Identification and phylogenetic analysis of Antrodia camphorata and related species based on the polymorphic D2 region of LSU rDNA[J]. Fooyin Journal of Health Sciences,2009,1(1):33-40.
[91]Lu Z M,Lei J Y,Xu H Y,et al. Optimization of fermentation medium for triterpenoid production from Antrodia camphorata ATCC 200183 using artificial intelligence-based techniques[J]. Applied Microbiology and Biotechnology,2011,92(2):371-379.
[92]Ma T W,Lai Y E,Yang F C. Enhanced production of triterpenoid in submerged cultures of Antrodia cinnamomea with the addition of citrus peel extract[J]. Bioprocess and Biosystems Engineering,2014,37(11):2251-2261.
[93]Lin E S,Sung S C. Cultivating conditions influence exopolysaccharide production by the edible Basidiomycete Antrodia cinnamomea in submerged culture[J]. International Journal of Food Microbiology,2006,108(2):182-187.
[94]朱会霞,孙金旭. 樟芝真菌发酵条件优化研究[J]. 中国酿造,2008,20(197):46-49.
[95]喻学淳,夏永军,张 欢,等. 樟芝固态发酵生产Antroquinonol及萃取Antroquinonl的研究[J]. 食品工业科技,2013(5):164-168.
[96]Vos P,Hogers R,Bleeker M,et al. AFLP:a new technique for DNA fingerprinting[J]. Nucleic Acids Research,1995,23(21):4407-4414.
[97]Majid E,Male K B,Tzeng Y M,et al. Cyclodextrin-modified capillary electrophoresis for achiral and chiral separation of ergostane and lanostane compounds extracted from the fruiting body of Antrodia camphorata[J]. Electrophoresis,2009,30(11):1967-1975.
