苯磺酰基吲哚类化合物去质子化离子的质谱裂解行为研究
2019-11-22叶贝贝曹小吉
凌 彬,方 媚,叶贝贝,曹小吉,2
(1.浙江工业大学化学工程学院,浙江 杭州 310014;2.浙江工业大学分析测试中心,浙江 杭州 310014)
吲哚结构单元广泛存在于活性药物分子中,含吲哚官能团的药物在临床上具有抗炎[1]、抗菌[2-3]、抗惊厥[4]和抗肿瘤[5]等功效。在药物分子中引入磺酰基团可以改善药物的代谢稳定性[6],延长药物作用时间[7],提高其生物利用率[8]。通过偶联反应在吲哚分子骨架上引入苯磺酰基即可得到苯磺酰基吲哚类化合物[9-11]。据文献报道,3-苯磺酰基吲哚衍生物具有抗HIV活性[12-13],而2-苯磺酰基吲哚衍生物则具有较强的抗炎活性[14]。快速区分上述两类位置异构体可为深入研究它们的构效关系提供保障。
电喷雾串联质谱(ESI-MSn)是研究气相有机化学反应机理的重要工具,在吲哚类衍生物的质谱裂解研究领域扮演着重要角色[15-17],量子化学计算可以辅助推测或验证化合物的电喷雾质谱裂解规律[18-25]。目前,研究报道大多只关注吲哚类化合物在电喷雾离子源正离子模式下的质谱行为,而其在负离子模式下的质谱行为则鲜有报道。吲哚环是一个平面共轭体系,氮原子上的孤对电子参与吲哚环共轭大π键,碱性很弱,其pKa值在16~17之间,不易与质子结合,在合适的条件下可以丢失氮原子上的氢产生去质子化离子[26-27]。直至目前,还未见苯磺酰基吲哚类化合物去质子化离子的质谱行为报道。
本研究拟采用电喷雾串联质谱技术结合量子化学计算对苯磺酰基吲哚类化合物去质子化离子的质谱裂解机理进行研究,以期建立快速、简便、准确地区分3-苯磺酰基吲哚类化合物和2-苯磺酰基吲哚类化合物这两类位置异构体的有效实验手段,为苯磺酰基吲哚类化合物的结构鉴定和定量分析提供理论基础。
1 实验部分
1.1 主要仪器与试剂
LCQ DECA XP MAX 离子阱质谱仪:美国Thermo Fisher 公司产品,配有ESI源及Xcalibur 2.0 数据处理系统;Infinity II G6545四极杆飞行时间质谱仪(QTOF MS):美国Agilent公司产品,配有ESI源。
9个苯磺酰基吲哚衍生物:由江西师范大学万结平教授提供[11];甲醇:色谱纯,德国Merck公司产品。
1.2 实验条件
1.2.1样品制备 称取1 mg样品,用10 mL甲醇溶解,配制成0.1 g/L的样品溶液,过0.45 μm滤膜,用注射泵输送到质谱仪中进行分析,流速5 μL/min。
1.2.2质谱条件 在LCQ电喷雾电离源负离子模式下,以标准校正液(caffeine, MRFA and Ultramark 1621)对质谱分析器的质量轴进行校正;以氮气作为鞘气,流量2.4 L/min;喷雾电压3.5 kV,毛细管温度275 ℃;用氦气作为碰撞气,碰撞能量42%,前体离子的质量选择宽度为2;高分辨质谱实验在Q TOF MS电喷雾离子源负离子模式下进行,使用标准校正液(Agilent, G1969-85000)进行仪器校准。雾化气、鞘气、干燥气和碰撞气均为氮气,气体温度320 ℃;毛细管电压3.5 kV;雾化气压力241 kPa;鞘气流量11 L/min,温度350 ℃;碰撞能量25 V。
1.2.3计算条件 所有理论计算均应用Gaussian 03程序完成,采用密度泛函理论(DFT)方法,选择6-31G(d)基组在B3LYP水平上对反应物、产物和过渡态的可能结构进行优化分析。反应物和产物的优化中没有虚频产生,为极小值;过渡态则是仅有一个虚频的一阶鞍点。优化中没有强制对称限制。过渡态通过内禀反应坐标(IRC)方法向前和向后追踪反应途径。文中讨论的能量是电子能和内能之和。
2 结果与讨论
5个3-苯磺酰基吲哚类化合物和4个2-苯磺酰基吲哚类化合物的化学结构信息列于表1。9个化合物在电喷雾负离子模式下主要产生去质子化离子[M-H]-,在正离子模式下则主要产生质子化离子[M+H]+。由于吲哚基团的含 氮杂环平面大共轭体系,这些化合物在电喷雾负离子模式下的灵敏度明显高于正离子模式。如0.02 g/L的化合物C1在电喷雾负离子模式下的信噪比为69,而在电喷雾正离子模式下的信噪比只有4,示于图1。在磺酰基吲哚类化合物的痕量分析方面,电喷雾负离子模式的优势显而易见。

表1 9个苯磺酰基吲哚类化合物的化学结构Table 1 Molecular structures of nine phenylsulfonylindoles
2.1 3-苯磺酰基吲哚类化合物的ESI-MSn分析
化合物A1为3-苯磺酰基吲哚类化合物,其去质子化离子(m/z256)的ESI-MSn图谱示于图2。
化合物A1的[M-H]-(m/z256)碰撞诱导 解离生成2个丰度较高的碎片离子m/z192和
m/z179。3-苯磺酰基吲哚[M-H]-的高分辨ESI-MS/MS谱图示于图3。m/z192的碎片离子精确质量数为192.081 4,对应的元素组成为C14H10N-(理论值m/z192.081 9,误差为2.45×10-6),表明该离子是由[M-H]-中性丢失SO2产生的,碎片离子m/z192中性丢失苯炔产生碎片离子m/z116(图2c);碎片离子m/z179的精确质量数为179.004 3,对应的元素组成为C8H5SO2N-(理论值m/z179.004 6,误差为1.93×10-6),表明该离子是由[M-H]-中性丢失苯自由基产生的,m/z179碎片离子中性丢失SO生成m/z131碎片离子(图2d),其可能的裂解途径示于图4。

图1 化合物C1在ESI+(a)和ESI-(b)模式的灵敏度Fig.1 Sensitivity of compound C1 in ESI+ (a) and ESI- (b) mode

注:a.[M-H]-(m/z 256)的一级质谱图;b.[M-H]-(m/z 256)的二级质谱图;c.碎片离子(m/z 192)的三级质谱图;d.碎片离子(m/z 179)的三级质谱图图2 3-苯磺酰基吲哚[M-H]-的ESI-MSn图Fig.2 ESI-MSn spectra of [M-H]- of 3-phenylsulfonylindole
确定去质子化位点对了解3-苯磺酰基吲哚类化合物去质子化离子的裂解机理至关重要。本工作采用密度泛函理论计算推测化合物A1可能的去质子化位点。化合物A1的原子标记示于图5,去质子化位点计算结果列于表2,以去质子化位点在N1上(MH1)的能量为零点,其余位点的能量为两者的差值(相对能量)。由表2可知,A1化合物丢失N1原子上的活泼氢产生的去质子化离子MH1的相对能量比丢失其他位点上的质子产生的去质子化离子的相对能量低156 kJ/mol以上,表明N1原子是该化合物热力学最稳定的去质子化位点。A1的去质子化离子MH1可能的共振结构示于图6,N1位上的 负电荷通过共轭体系可以离域到C3位或C2位上[18],分别形成各自对应的共振结构式b或c。

图3 3-苯磺酰基吲哚[M-H]-的高分辨ESI-MS/MS图Fig.3 High resolution ESI-MS/MS spectrumof [M-H]- of 3-phenylsulfonylindole

图4 3-苯磺酰基吲哚去质子化离子的可能的裂解途径Fig.4 Proposed fragmentation pathways of deprotonated 3-phenylsulfonylindole
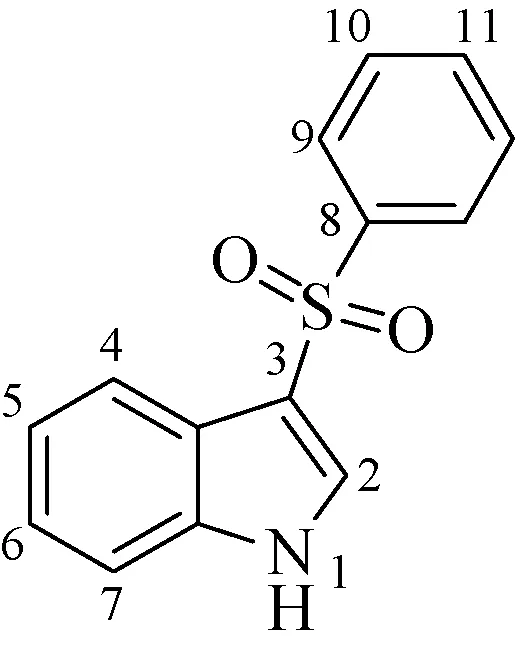
图5 3-苯磺酰基吲哚的化学结构式Fig.5 Chemical structure of 3-phenylsulfonylindole
化合物A1的去质子化离子碰撞诱导解离发生SO2的丢失,涉及到连接磺酰基的2个C—S键的断裂以及吲哚环、芳环之间新C—C键的形成。分子内的骨架重排是触发上述反应的可能原因。据文献报道[20-21],对苯胺磺酰阳离子碰撞诱导活化发生了分子内的砜基-亚磺酸酯骨架重排反应,导致了SO的中性丢失。另外,芳香性的磺酰胺类化合物的去质子化离子碰撞诱导解离发生了分子内芳香亲核取代重排反应,导致了SO2的中性丢失[22-24]。如图6所示,当负电荷位于A1化合物去质子化离子的N1位上时(共振结构a),吲哚N1原子可以通过五元环过渡态(TS1, 351 kJ/mol)亲核进攻苯环C8位,C8—S键同时断裂,随后负电荷诱导C3—S键断裂产生SO2的丢失(path Ⅰ);当负电荷离域到吲哚C3位上时,共振结构b上的C3原子通过三元环过渡态(TS3, 230 kJ/mol)亲核进攻C8位,C8—S键同时断裂,随后负电荷诱导C3—S键异裂,中性丢失SO2(path Ⅱ);当负电荷离域到吲哚C2位上时,共振结构c上的C2原子通过四元环过渡态(TS4, 294 kJ/mol)亲核进攻C8位,C8—S键 同时断裂,随后C2位上的氢经过1,2-质子迁移至吲哚C3上,同时,负电荷诱导解离中性丢失SO2(path Ⅲ)。从过渡态能量角度考虑,path Ⅱ是A1的去质子化离子碰撞诱导解离中性丢失SO2的最可能路径。

表2 化合物A1不同去质子化位点的相对能量Table 2 Relative energy of structures with different deprotonation sites for compound A1

图6 3-苯磺酰基吲哚的去质子化离子丢失SO2可能的路径Fig.6 Proposed mechanism for the loss of SO2 from deprotonated 3-phenylsulfonylindole
电喷雾串联质谱中偶电子的[M-H]-碰撞诱导解离产生阴离子自由基是一种违反“偶电子规则”的异常断裂反应,但是这种碎裂反应也常常被观察到[24,27]。据文献[24]报道,苯磺酰苯胺的去质子化离子可通过C—S键均裂中性丢失苯基自由基产生阴离子自由基。同样,A1的[M-H]-通过C8—S键均裂,中性丢失苯自由基生成m/z179阴离子自由基碎片离子。
其余的3-苯磺酰基吲哚类化合物的CID-MS/MS数据列于表3。可知,3-苯磺酰基吲哚类化合物的[M-H]-碰撞诱导解离中性丢 失SO2生成R1R2C14H8N-碎片离子,中性丢失苯自由基生成R1C8H4SO2N-·碎片离子,两种碎片离子的丰度会因取代基的不同而变化。当C5位取代基为甲基(A2)时,通过三元环过渡态(TS3, 229 kJ/mol)重排丢失SO2相比A1通过三元环过渡态(TS3, 230 kJ/mol)重排丢失SO2,过渡态能量降低,碎片离子丰度比值(I(R1R2C14H8N-)/I(R1C8H4SO2N-·))升高,表明A2的[M-H]-比A1的[M-H]-更易中性丢失SO2分子;当C5位取代基为三氟甲基(A3)时,通过三元环过渡态(TS3, 240 kJ/mol)重排丢失SO2相比A1过渡态能量升高,相应地碎片离子丰度比值降低,表明A3的[M-H]-比A1的[M-H]-更难丢失中性SO2分子。这是由于三氟甲基使得吲哚C3位电子云密度降低,导致吲哚环亲核重排反应过渡态能量升高,不利于重排丢失SO2反应的发生,而给电子基团甲基则具有相反的作用。吲哚环上的取代基类型变化对丢失苯自由基的均裂反应影响不大。

表3 苯磺酰基吲哚类化合物去质子化离子在ESI-MS/MS中产生的主要碎片离子Table 3 ESI-MS/MS spectra data of deprotonated phenylsulfonylindoles
当苯环C11位为甲基(B1)时,通过三元环过渡态(TS3, 232 kJ/mol)重排丢失SO2相比A1通过三元环过渡态(TS3, 230 kJ/mol)重排丢失SO2,过渡态能量升高,碎片离子丰度比值(I(R1R2C14H8N-)/I(R1C8H4SO2N-·))升高,这可能与苯基自由基的稳定性有关。当苯环C11位为硝基(B2)时,通过三元环过渡态(TS3, 179 kJ/mol)重排丢失SO2相比A1过渡态能量显著降低,相应地碎片离子丰度比值显著升高,表明B2的[M-H]-比A1的[M-H]-更易丢失中性SO2分子,这是由于硝基显著降低了苯环的电子云密度,导致吲哚环亲核重排反应过渡态能量显著降低,有利于重排丢失SO2反应的发生。此外,除化合物B2外(苯环对位取代基为硝基),其他4个3-苯磺酰基吲哚类化合物的R1R2C14H8N-碎片离子与R1C8H4SO2N-·碎片离子的丰度比值(I(R1R2C14H8N-)/I(R1C8H4SO2N-·))均小于1。
2.2 2-苯磺酰基吲哚类化合物的ESI-MSn分析
2-苯磺酰基吲哚类化合物的[M-H]-碰撞诱导解离后,主要产生中性丢失SO2的碎片离子,同时也会产生少量丢失苯自由基的碎片离子(丰度低于2%)结果列于表3。以2-苯磺酰基吲哚(C1)的[M-H]-为例,中性丢失SO2产生m/z192碎片离子,中性丢失苯自由基产生m/z179碎片离子。
C1不同去质子位点丢失质子的相对能量列于表4,通过比较不同位点丢失质子的相对能量,发现C1化合物热力学最稳定的去质子化位点同样是在吲哚N1上。C1的去质子化离子可能的共振结构示于图7,N1的负电荷可以通过共轭体系离域到C3位或C2位,分别形成各自对应的共振结构e或f。
2-苯磺酰基吲哚去质子化离子丢失SO2可能的路径示于图7。当负电荷在2-苯磺酰基吲哚去质子化离子的N1位上时(共振结构d),吲哚环N1原子可通过四元环过渡态亲核进攻苯环C8位,同时C8—S键断裂,随后吲哚环C2位通过三元环过渡态(TS7, 182 kJ/mol)亲核进攻苯环C8位,负电荷诱导C2—S键异裂,中性丢失SO2(path IV);当负电荷离域到C3位,共振结构式e上的吲哚环C3原子通过四元环过渡态(TS8, 240 kJ/mol)亲核进攻苯环C8位,C8—S键同时断裂,随后C3位上的氢经过1,2-质子迁移至吲哚C2位,电荷诱导C2—S键异裂,中性丢失SO2(path V);当负电荷离域到C2位,共振结构式f上吲哚环C2原子通过三元环过渡态(TS10, 276 kJ/mol)亲核进攻苯环C8位,同时C8—S键断裂,随后中性丢失SO2(path Ⅵ)。从过渡态能量角度考虑,path Ⅳ是C1的去质子化离子碰撞诱导解离中性丢失SO2最可能的路径。

表4 化合物C1不同去质子化位点的相对能量Table 4 Relative energy of compound C1 with different deprotonation sites

图7 2-苯磺酰基吲哚去质子化离子丢失SO2可能的路径Fig.7 Proposed mechanism for the loss of SO2 from deprotonated 2-phenylsulfonylindole
综上可知,3-苯磺酰基吲哚类化合物和2-苯磺酰基吲哚类化合物的[M-H]-碰撞诱导解离都发生中性丢失SO2,但是具体的解离路径不同。3-苯磺酰基吲哚类化合物通过简单的一步吲哚环负离子亲核芳香取代重排反应消除SO2,而2-苯磺酰基吲哚类化合物则是经过两步吲哚环负离子亲核芳香取代重排反应消除SO2。两类位置异构体的C8—S均裂导致苯基自由基的中性丢失。苯磺酰基吲哚去质子化离子主要的裂解途径示于图8。
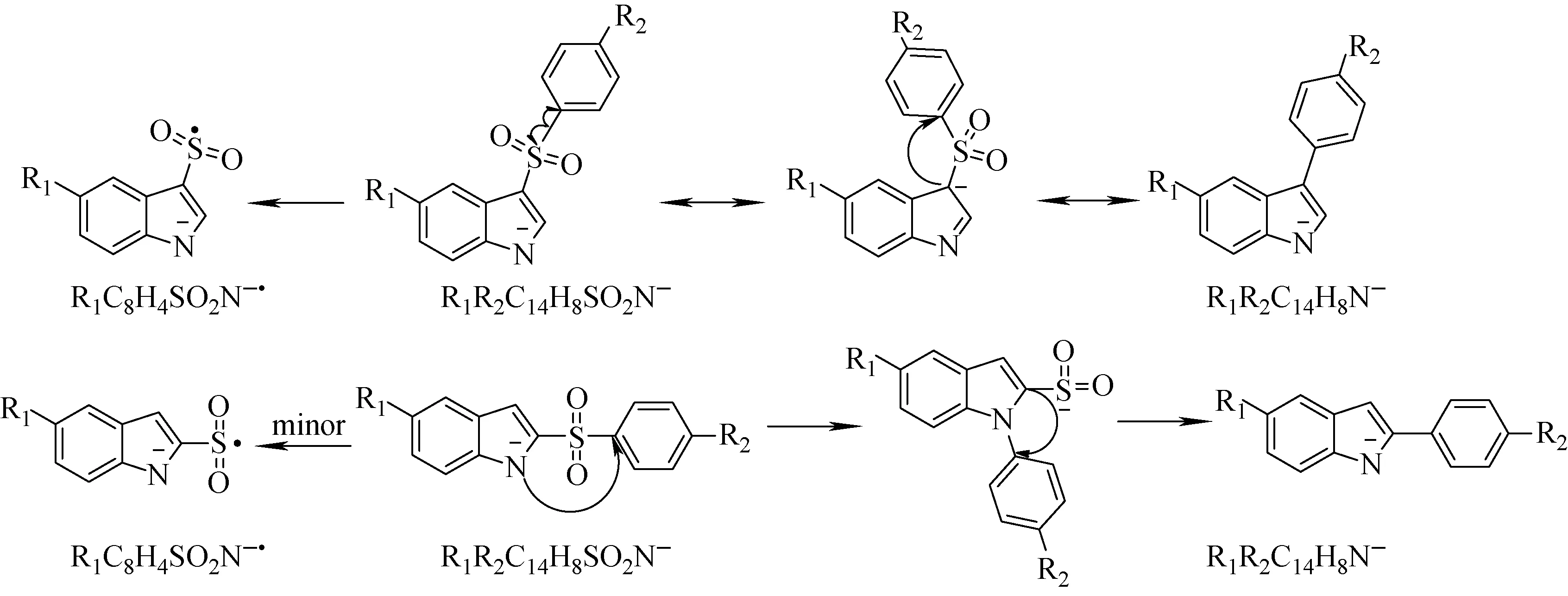
图8 苯磺酰基吲哚去质子化离子主要的裂解途径Fig.8 Major fragmentation mechanism of deprotonated phenylsulfonylindoles
2.3 位置异构体的区分
由表3可知,对应的位置异构体(A1-C1, A2-C2, B1-C3)碰撞诱导解离产生相同的中性丢失,中性丢失SO2产生碎片离子R1R2C14H8N-,中性丢失苯自由基则产生R1C8H4SO2N-·离子。理论计算结果显示,互为位置异构体的[M-H]-消除SO2的具体裂解路径不同,对应的过渡态能量也不同。如C1的[M-H]-中性丢失SO2的过渡态能量比A1的过渡态能量低48 kJ/mol,表明C1的去质子化离子较A1的去质子化离子更易丢失SO2碎片。
此外, 3-苯磺酰基吲哚类化合物去质子化离子产生的R1R2C14H8N-和R1C8H4SO2N-·两个碎片离子的丰度比值小于1,而2-苯磺酰基吲哚类化合物去质子化离子对应的碎片离子丰度比值则远大于1。根据2个主要碎片离子丰度比值的显著性差异,可以将3-苯磺酰基吲哚与其位置异构体2-苯磺酰基吲哚区分开。
对于位置异构体B2和C4,强吸电子基团硝基显著降低了中性丢失SO2的过渡态能量,导致两者碰撞诱导解离均主要产生SO2的中性丢失,无法从碎片离子丰度比值I(R1R2C14H8N-)/I(R1C8H4SO2N-·)来区分B2和C4。此外,在相同质谱裂解条件下,2-苯磺酰基吲哚类化合物的[M-H]-前体离子丰度明显低于对应的3-苯磺酰基吲哚类化合物位置异构体。由密度泛函理论计算结果可知,C4的去质子化离子能量 (-1 347.168 578 hartree)比B2的去质子化离子能量(-1 347.174 649 hartree)高16 kJ/mol,导致在相同条件下,C4去质子化离子的解离程度比位置异构体B2更剧烈。
3 结论
采用ESI-MSn技术结合量子化学计算,研究了3-苯磺酰基吲哚类化合物和2-苯磺酰基吲哚类化合物两类位置异构体在负离子模式下的裂解行为。结果表明,3-苯磺酰基吲哚类化合物的[M-H]-是经过一步吲哚环负离子芳香亲核取代重排反应中性丢失SO2分子,而2-苯磺酰基吲哚类化合物的[M-H]-则是通过连续两步吲哚环负离子亲核芳香取代重排反应消除SO2分子。两类位置异构体的C8—S化学键均裂导致苯自由基的中性丢失。基于消除SO2的碎片离子丰度与丢失苯基自由基的碎片离子丰度比值I(R1R2C14H8N-)/I(R1C8H4SO2N-·)是否大于1,以及在相同质谱条件下,2-苯磺酰基吲哚类化合物的[M-H]-较3-苯磺酰基吲哚类化合物的[M-H]-更不稳定的特点,可以有效区分上述两种位置异构体。通过研究9种苯磺酰基吲哚化合物的质谱裂解机制,可为苯磺酰基吲哚类化合物的结构鉴定及其位置异构体区分提供理论依据和方法参考。
致谢:感谢江西师范大学万结平教授提供样品。
