杨树重金属相关异戊二烯化植物蛋白(HIPPs)基因的鉴定及表达分析
2019-11-15许志茹陈瑾元黄佳欢刘关君
王 琪 许志茹, 陈瑾元 张 双 黄佳欢 刘关君*
(1.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 2.东北林业大学生命科学学院,哈尔滨 150040)
金属离子在生物体内具有重要作用。据估计,生物体内大约超过一半的蛋白质都含有金属离子。这些金属离子在生物体的各种代谢反应中作为结构组分或催化因子发挥作用。但是过量的金属离子也具有潜在毒性。因此,生物体在进化过程中形成了复杂的调控机制确保各种金属离子稳态。此外,进入细胞的金属离子会被蛋白质和小分子配体螯合,这些金属离子的转运是通过金属伴侣蛋白完成的[1~2]。在一些藻类、真菌和动物中,存在少量的金属伴侣-like蛋白。在植物中,此类蛋白形成了大的基因家族,包括两种类型的蛋白质,即重金属相关植物蛋白(heavy metal-associated plant proteins,HPPs)和重金属相关异戊二烯化植物蛋白(heavy metal-associated isoprenylated plant protein,HIPPs)[3~4]。
HIPPs是维管植物特有的、在非生物胁迫和生物胁迫过程中发挥作用的蛋白质,一般含有113~584个氨基酸残基[5]。此类蛋白包含一个或两个HMA结构域(heavy metal-associated domain)和羧基端(C端)的异戊二烯化基序。大部分HIPPs蛋白在这两种元件之间存在甘氨酸富集区和/或脯氨酸富集区。异戊二烯化是蛋白质翻译后的一种修饰过程,异戊二烯化蛋白质的一个典型结构特点是蛋白质的C端都具有CaaX结构(C代表半胱氨酸;a代表脂肪族氨基酸;X代表C端氨基酸,通常是甲硫氨酸、谷氨酰胺、半胱氨酸、丝氨酸或丙氨酸),此结构对于蛋白质发挥生物学功能如蛋白质与膜互作、蛋白质之间的相互作用是十分重要的[6~8]。1999年,Dykema等人首次描述并鉴定了拟南芥(Arabidopsisthaliana)、大豆(Glycinemax)和烟草(Nicotianatabacum)中的HIPPs蛋白,并证明此类蛋白可以通过HMA结构域的核心基序M/LXCXXC(M代表甲硫氨酸,L代表亮氨酸,X代表任意氨基酸,C代表半胱氨酸)与Cu2+、Ni2+和Zn2+结合[9]。拟南芥HIPP蛋白家族包括45个成员,而水稻(Oryzasativa)、毛果杨(Populustrichocarpa)和粟米(Setariaitalica)中分别含有59、74和51个HIPPs蛋白,这些蛋白被分为5个不同的类别(clusters)[5]。
目前,关于HIPPs蛋白的研究多集中于此类蛋白与病原菌侵染和非生物胁迫的相关关系等方面。小麦(TriticumaestivumL.)TaHIPP1基因在生物及非生物胁迫条件下差异表达,Zhang等通过病毒诱导的基因沉默证实,TaHIPP1增强了植株对小麦条锈病(Pucciniastriiformisf.sp.Tritici,Pst)的易感性,敲低TaHIPP1表达可以在一定程度上增强小麦对Pst的抗性[10]。此外,拟南芥HIPP27是甜菜胞囊线虫(Heteroderaschachtii)的宿主易感性基因,应答甜菜胞囊线虫侵染其表达量大量增加。过量表达HIPP27可以增加拟南芥对胞囊线虫的易感性。拟南芥hipp27突变体对胞囊线虫的易感性急剧降低[11]。烟草敲除NbHIPP26后可以阻止马铃薯帚顶病毒(potato mop-top virus,PMTV)的长距离移动,但不能阻止细胞-细胞之间的病毒移动。干旱和PMTV感染能够上调NbHIPP26基因表达,而PMTV感染则可以保护烟草免受干旱胁迫[12]。冬麦(HordeumvulgareL.cv.Trixi)HvFP1蛋白含有HMA结构域、核定位信号和异戊二烯化基序,定位于细胞核。干旱胁迫、ABA处理及叶片衰老能够诱导HvFP1基因表达[13]。拟南芥HIPP26的表达受冷胁迫、盐胁迫和干旱胁迫诱导。定位于细胞核的HIPP26蛋白能够与锌指同源域转录因子ATHB29互作,后者在脱水胁迫应答中发挥作用;重金属结合基序M/L/IXCXXC的两个半胱氨酸在这种互作中至关重要。转录因子ATHB29也可以与拟南芥HIPP20、HIPP21、HIPP23、HIPP24、HIPP27、HIPP30互作。HIPP26突变的拟南芥植株中ATHB29调控的胁迫相关靶基因的表达受抑制[3]。拟南芥HIPP3是核定位的锌结合蛋白,含有两个HMA结构域和4个核定位信号。ABA处理和干旱胁迫抑制HIPP3基因表达。HIPP3过量表达可以调控拟南芥400多个基因表达,绝大多数基因与病原体应答有关,尤其是水杨酸途径的基因。此外,HIPP3过量表达也可以影响非生物胁迫应答基因及种子和花发育基因。HIPP3过量表达植株开花延迟[14]。小麦TaHIPP1基因在茎和叶中表达量较高,且叶中的表达量受干旱和盐胁迫诱导。在施用ABA和创伤条件下,TaHIPP1基因的表达量上调[10]。
此外,HIPPs蛋白也可能参与重金属稳态及解毒机制。Tehseen等的研究指出,拟南芥HIPP20、HIPP22、HIPP26和HIPP27蛋白都可以提高酵母ycf1突变体细胞的镉耐受性。拟南芥hipp20/21/22突变植株对镉敏感,地上部和根中镉的积累量低于野生型,由此推测此类蛋白通过结合镉参与镉解毒过程[4]。拟南芥CdI19基因转化酵母后可以明显增加细胞对镉胁迫的耐受性。CdI19蛋白含有两个重金属结合基序M/LXCXXC,羧基末端有保守的异戊二烯化位点。CdI19的转录可以被镉诱导,同时也可以被Hg2+、Fe2+和Cu2+诱导。过量表达CdI19的拟南芥植株镉耐受性增加[8]。在酵母(Schizosaccharomycespombe)中过量表达小麦TaHIPP1基因显著增加了细胞在铜胁迫(100 μmol·L-1CuSO4)和高盐胁迫条件下的生长率[10]。Tehseen等在研究拟南芥HIPPs蛋白和HPPs蛋白(包括已经鉴定的拟南芥铜伴侣蛋白AtATX1、AtCCH和AtCCS)时发现,这些蛋白均含有1个或2个HMA结构域,HMA结构域保守的氨基酸序列可以形成βαββαβ二级结构[4]。一部分拟南芥HIPPs蛋白的HMA结构域含有保守的MXCXXC基序,而此基序也是铜伴侣蛋白AtATX1、AtCCH和AtCCS共有的一致序列[15~17],在结合铜及维持铜稳态过程中发挥重要作用[18]。目前关于HIPPs蛋白与植物维持细胞铜稳态的相关关系还有待进一步研究证实。
杨树是重要的造林和用材树种,且已经成为林木分子生物学研究的模式植物[19~20]。小黑杨(P.simonii×P.nigra)是小叶杨(PopulussimoniiCarr.)与欧洲黑杨(PopulusnigraL.)的杂交种,生长速度快、适应能力强,具有较强的抗寒、抗旱、耐贫瘠及耐盐碱等生物学特性,在我国北方广泛种植[21]。本研究利用生物信息学方法在毛果杨基因组中搜索鉴定了14个含有两个重金属结合基序MXCXXC的PtHIPPs基因家族成员,并分析了这些PtHIPPs的基因结构及编码蛋白的基序组成;鉴定了毛果杨PtHIPPs和小黑杨PnHIPPs基因的组织表达特异性,同时利用qRT-PCR技术检测了PnHIPPs基因应答铜胁迫的表达模式。本研究可以为初步阐明杨树HIPPs蛋白在维持细胞铜稳态过程中发挥的作用提供借鉴。
1 材料与方法
1.1 毛果杨HIPP蛋白家族成员的鉴定
从phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)[23]网站下载毛果杨的蛋白质数据库,并从Pfam数据库(http://pfam.xfam.org/)下载重金属结合结构域(HMA)的HMM文件。利用HMMER(v 3.0)软件中的hmmer搜索命令,以HMA.hmm文件搜索杨树蛋白质数据库。此外,以含有MXCXXC基序的重金属结合结构域的毛果杨PtATX1(POPTR_0008s02430)蛋白序列为探针,对毛果杨蛋白质数据库进行在线BlastP搜索。参数设置为:Target type=Proteome,Program=BLASTP-protein query to protein db,Expect(E) threshold=-5,其他参数默认。进一步筛选通过以上两种方法获得的蛋白质序列,筛选的标准为:蛋白质的氨基端(N端)含有2个MXCXXC保守基序,N端可以形成βαββαβ二级结构(利用SWISS-MODEL(http://swissmodel.expasy.org/)软件进行二级结构预测),蛋白质C端含有CaaX异戊二烯化位点。筛选鉴定后最终获得了14个符合上述特征的毛果杨PtHIPPs蛋白。
1.2 PtHIPPs蛋白的理化性质分析
根据筛选结果从数据库中下载毛果杨PtHIPPs蛋白的氨基酸序列。利用在线程序ExPASy(http://www.expasy.org/)分析PtHIPPs蛋白的相关特征,包括氨基酸数目、分子量、等电点、脂肪系数和总平均亲水性等。利用WoLF PSORT(http://www.genscript.com/psort/wolf_psort.html)软件预测PtHIPPs蛋白的亚细胞定位。
1.3 外显子/内含子结构和保守基序分析
下载毛果杨PtHIPPs的基因组序列及CDS序列,利用GSDS2.0(http://gsds.cbi.pku.edu.cn)软件鉴定PtHIPPs基因外显子和内含子的分布模式。进行PtHIPPs蛋白保守基序分析时使用MEME(http://meme-suite.org/tools/meme)软件,参数设置为:maximum number of different motifs to find=10,minimum width=6,maximum width=50。
1.4 HIPPs蛋白的同源序列比对及进化树分析
利用BioEdit软件比对PtHIPPs蛋白的氨基酸序列,并鉴定MXCXXC重金属结合保守基序、赖氨酸富集区、甘氨酸富集区及CaaX异戊二烯化位点。使用相同的方法和标准鉴定含有2个MXCXXC基序的拟南芥AtHIPPs和水稻(Oryzasativa)OsHIPPs蛋白并从数据库中下载这些蛋白的氨基酸序列。利用PtHIPPs、AtHIPPs和OsHIPPs蛋白的氨基酸序列、通过MEGA5.0软件构建系统进化树。
1.5 毛果杨PtHIPPs基因组织表达特异性的鉴定
利用PopGenIE网站(http://popgenie.org)中毛果杨PtHIPPs基因在成熟叶片、幼叶、节点、节间和根中的表达数据构建组织特异性表达可视图。
1.6 植物材料及铜胁迫处理方法
小黑杨试材取自东北林业大学林木遗传育种国家重点实验室实验林场。插条的培养、幼苗的截顶生根及培养条件参照Xu等的方法[21]。生根后的幼苗移至蛭石中,每2 d浇灌一次1/2霍格兰德营养液(改良后的Hoagland nutrient solution,含0.5 μmol·L-1CuSO4·5H2O)。2周后,将一部分苗用于鉴定小黑杨PnHIPPs基因的组织表达特异性[21]。将剩余部分苗利用不含Cu2+(缺铜处理)、含0.5 μmol·L-1Cu2+(正常铜浓度:对照组)、10 μmol·L-1Cu2+(过量铜处理)的1/2霍格兰德营养液继续培养小黑杨幼苗3、12、72 h。将叶片长度达到2cm的第一个展开的叶片命名为LPI0(LPI:leaf plastochron index)[22]。取材方式为:分别对植株的根、茎、成熟叶片(LPI 7-9)和幼叶(LPI 0-2)进行取材,液氮速冻后-80℃保存。每个处理重复3次。
1.7 RNA的提取及qRT-PCR分析
利用pBIOZOL植物总RNA提取试剂盒(杭州BioFlux)提取试材总RNA。去除基因组DNA后,使用PrimeScriptTMRT reagent Kit(TaKaRa)进行反转录合成cDNA第一条链。根据PtHIPPs基因序列设计定量引物,以毛果杨PtUBQ7(XM_002306689.2)和PtCDC2(XM_002305968.2)基因作为内参基因(表1)[21]。按照康为世纪的UltraSYBR Mixture(LowROX)试剂盒中20 μL反应体系的说明加样,在ABI 7500荧光定量PCR仪上进行Real-time PCR反应。每个样品重复3次,采用2-ΔΔCT法进行基因的相对定量分析[24~25],鉴定小黑杨PnHIPPs基因应答铜胁迫处理的表达模式及PnHIPPs基因的组织表达特异性。
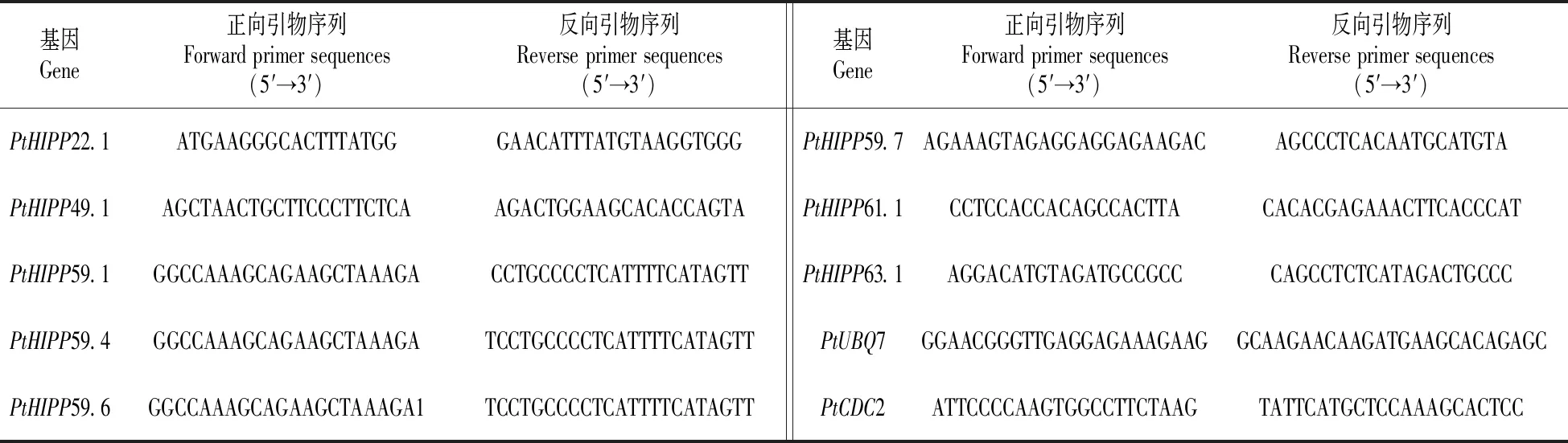
表1 用于qRT-PCR的引物序列
2 结果与分析
2.1 毛果杨HIPP蛋白家族成员的理化性质分析
搜索鉴定后在毛果杨基因组中获得了14个含有2个重金属结合基序MXCXXC的PtHIPPs蛋白编码基因,其中部分成员是同一基因的不同转录本,包括PtHIPP22.1和PtHIPP22.2,PtHIPP49.1和PtHIPP49.2,PtHIPP59.1、PtHIPP59.2、PtHIPP59.4、PtHIPP59.5、PtHIPP59.6和PtHIPP59.7,PtHIPP61.1、PtHIPP61.2和PtHIPP61.3(表2)。利用ExPASy和WoLF PSORT软件分析了14个PtHIPPs蛋白的理化性质,包括基因登录号和染色体位置、氨基酸数目、蛋白质分子量、等电点、脂肪系数、总平均亲水性(GRAVY)和亚细胞定位信息等(表2)。PtHIPPs蛋白含有的氨基酸数目为225~334个,等电点为5.34~9.08,既有酸性氨基酸又有碱性氨基酸。GRAVY值皆为负值,表明14个PtHIPPs蛋白都是亲水性蛋白质。亚细胞定位结果显示,PtHIPPs主要定位于细胞质和细胞核。
2.2 毛果杨HIPP蛋白家族成员的二级结构预测
14个毛果杨PtHIPPs蛋白的二级结构预测结果如图1所示,PtHIPPs蛋白的N端都可以形成保守的βαββαβ二级结构;其中,PtHIPP22.1、PtHIPP49.1、PtHIPP49.2、PtHIPP59.1、PtHIPP59.6、PtHIPP59.7、PtHIPP61.1、PtHIPP63.1蛋白可以形成2个完整的βαββαβ二级结构。重金属结合基序MXCXXC均位于βαββαβ二级结构的第一个α螺旋内。
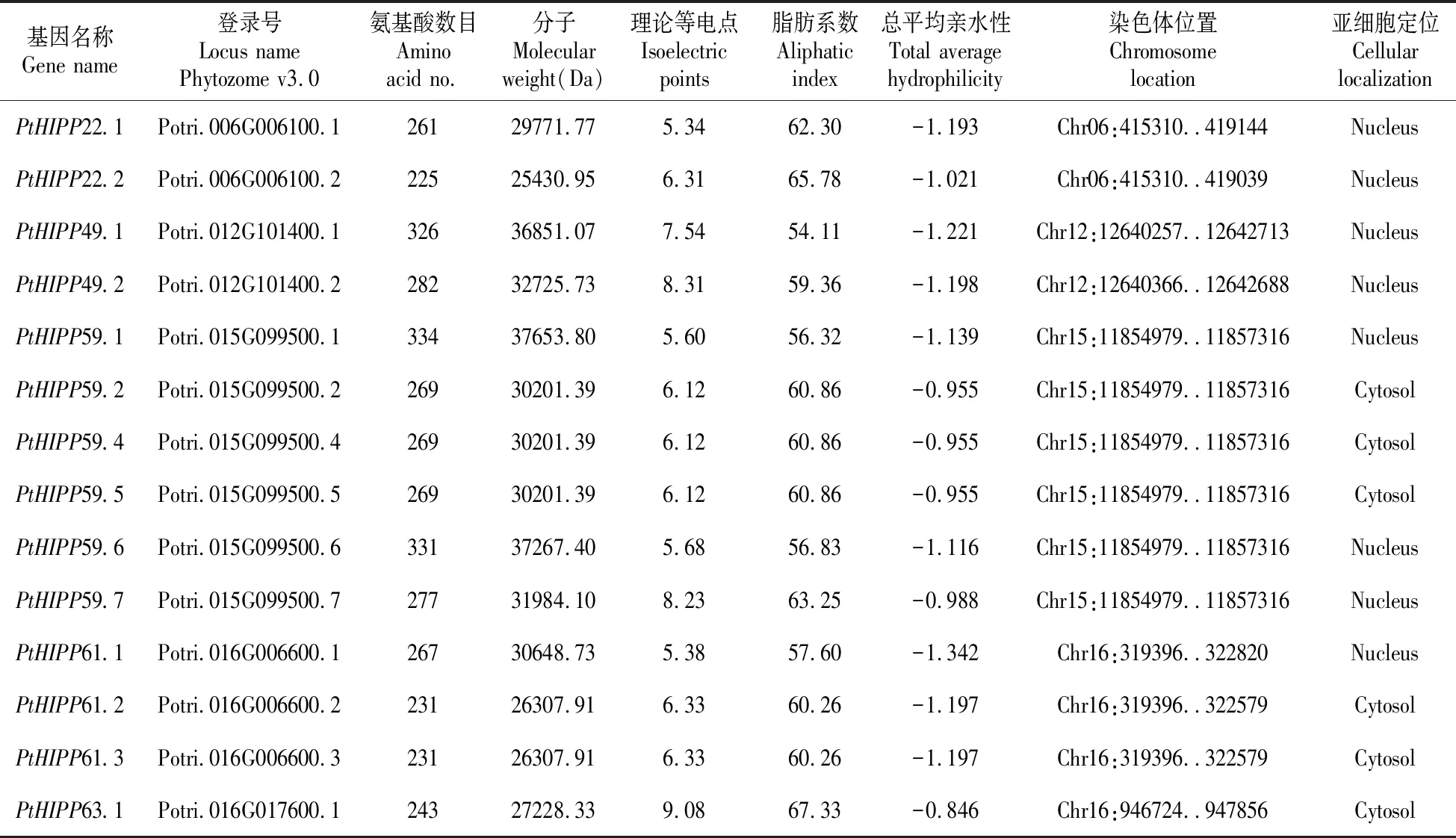
表2 毛果杨HIPP蛋白家族成员的相关参数
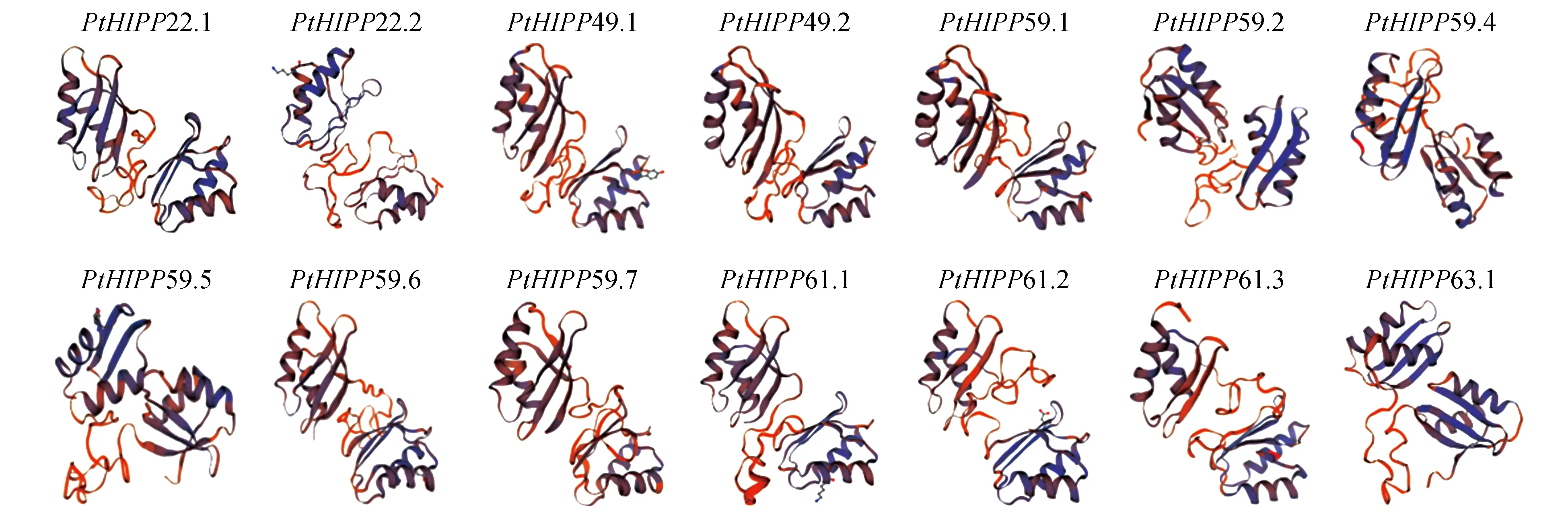
图1 毛果杨PtHIPPs蛋白的二级结构预测结果Fig.1 The predicted secondary structure of PtHIPPs in P.trichocarpa
2.3 毛果杨PtHIPPs蛋白氨基酸序列的同源性比对
利用BioEdit软件对14个PtHIPPs蛋白的氨基酸序列进行同源性比对,结果显示(图2),所有PtHIPPs蛋白的N端都具有2个重金属结合基序MXCXXC,C端具有异戊二烯化位点CaaX;某些PtHIPPs具有赖氨酸富集区(lysine-rich region)和甘氨酸富集区(glycine-rich region)。14个PtHIPPs蛋白氨基酸序列的相似性为36.67%~100%。
2.4 HIPPs蛋白的系统进化分析
使用相同的鉴定方法和标准获得了2个拟南芥AtHIPPs(AtHIPP07和AtHIPP08)和3个水稻OsHIPPs(OsHIPP28、OsHIPP29和OsHIPP33)蛋白,这些蛋白质都含有2个MXCXXC重金属结合基序。通过MEGA5.0软件,利用5个PtHIPPs(去除同一基因的不同转录本)、2个AtHIPPs和3个OsHIPPs构建同源序列的系统进化树。结果表明(图3),10个HIPPs蛋白被归为3个亚组,亚组Ⅰ包含PtHIPP49、PtHIPP59、AtHIPP07、OsHIPP28及OsHIPP29,PtHIPP49、PtHIPP59与AtHIPP07的亲缘关系较近;亚组Ⅱ包含PtHIPP22、PtHIPP61和OsHIPP33;亚组Ⅲ包含PtHIPP63和AtHIPP08。

图2 PtHIPPs蛋白氨基酸序列的同源性比较 红框表示保守的MXCXXC金属结合基序和CaaX异戊二烯化位点;绿框表示赖氨酸富集区和甘氨酸富集区;点(·)表示相同的氨基酸;连接号(-)是为了进行同源性比对加入的空格。Fig.2 Homologous comparison of the amino acid sequences of PtHIPPs Red boxes indicate the conserved MXCXXC metal-binding motif and CaaX isoprenylation site, and the green boxes indicate the lysine-rich region and glycine-rich region. Dots indicate the identical amino acids, and dashes indicate gaps introduced to optimize the alignment.
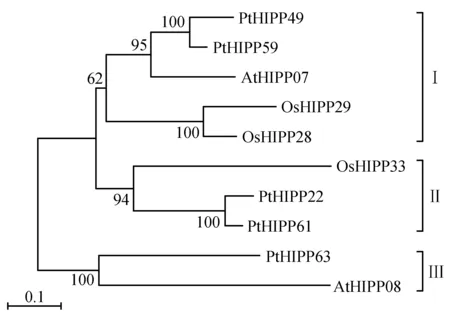
图3 毛果杨、拟南芥和水稻HIPPs蛋白的进化树分析Fig.3 Phylogenetic analysis of HIPP proteins from P.trichocarpa,A.thaliana and O.sativa
2.5 PtHIPPs外显子/内含子结构及编码蛋白的保守基序分析
PtHIPPs基因的外显子/内含子结构分析结果显示(图4B),5个PtHIPPs基因具有相同的外显子/内含子结构,均含有3个内含子,但是内含子和外显子的长度存在差异。利用MEME软件在PtHIPPs蛋白序列中共预测了十个保守基序(命名为motif 1~10)(表3,图4C)。PtHIPPs蛋白都包含基序1、2、3、4和基序5,且这5个基序在每个PtHIPPs蛋白中的排列顺序相同;基序1和基序3中分别包含一个重金属结合基序MXCXXC。同一亚组中的PtHIPPs蛋白通常含有相似的基序组成,且基序的排列顺序也相同;不同亚组的PtHIPPs蛋白之间基序组成存在差异。基序6仅存在于SI亚组成员中;SII亚组蛋白含有8~9个基序,且基序7和基序10仅存在于SII亚组蛋白中。SIII与SII成员中基序9的位置存在明显差异。预测的这些基序在PtHIPPs蛋白中的相关功能还有待实验验证。
2.6 PtHIPPs和PnHIPPs基因的组织表达特异性
利用PopGenIE网站中毛果杨PtHIPPs基因在成熟叶片、幼叶、节点、节间和根中的表达数据构建的组织特异性表达可视图显示,PtHIPP22.1和PtHIPP63.1基因在成熟叶片中表达量较高,PtHIPP61.1基因在幼叶中大量表达;PtHIPP49.1在节间的表达量较高;PtHIPP59.1、PtHIPP59.4、PtHIPP59.6和PtHIPP59.7基因具有相同的组织特异性表达模式,均在节点大量表达(图5:A~H)。
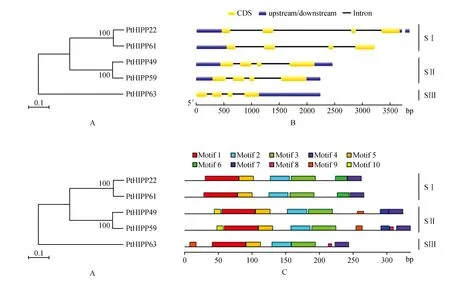
图4 PtHIPPs基因结构及蛋白基序分析 A. PtHIPPs蛋白的进化分析;B. PtHIPPs基因的外显子/内含子结构(黄色表示CDSs;蓝色表示上游/下游序列;黑线表示内含子);C. PtHIPPs蛋白的保守基序分析Fig.4 Gene structure of PtHIPPs and the motif analysis of PtHIPPs A. Phylogenetic analysis of PtHIPPs proteins; B. The exons/introns structure of PtHIPPs genes(Yellow indicates CDSs,blue indicates upstream/downstream sequences,and black line indicates introns); C. Conservation motifs analysis of PtHIPPs proteins

表3 毛果杨PtHIPPs蛋白的基序序列
通过qRT-PCR技术鉴定小黑杨PnHIPPs基因在根、茎、幼叶和成熟叶片中的组织表达特异性。PtHIPP22.1和PtHIPP22.2、PtHIPP49.1和PtHIPP49.2、PtHIPP59.1和PtHIPP59.2是毛果杨基因组数据库中描述的同一基因的不同转录本,且分别具有高度同源的核苷酸序列,因此,没有设计PtHIPP22.2、PtHIPP49.2和PtHIPP59.2的定量引物;PtHIPP61.1、PtHIPP61.2和PtHIPP61.3基因也存在此类情况。此外,利用设计的PtHIPP59.5定量引物进行qRT-PCR时未获得扩增结果。所以表1中不包括PtHIPP22.2、PtHIPP49.2、PtHIPP59.2、PtHIPP59.5、PtHIPP61.2和PtHIPP61.3基因的定量引物。qRT-PCR结果显示(图5:A~H中柱形图),PnHIPP63.1在小黑杨根、茎、幼叶和成熟叶片中大量表达,表达水平无明显差异。PnHIPP22.1和PnHIPP61.1在检测的各组织部位均表达,且在根中的表达量最高。PnHIPP49.1、PnHIPP59.1、PnHIPP59.4、PnHIPP59.6和PnHIPP59.7基因在茎中的表达量较高。由此可见,毛果杨PtHIPPs和小黑杨PnHIPPs基因的组织表达特异性存在一定差异。
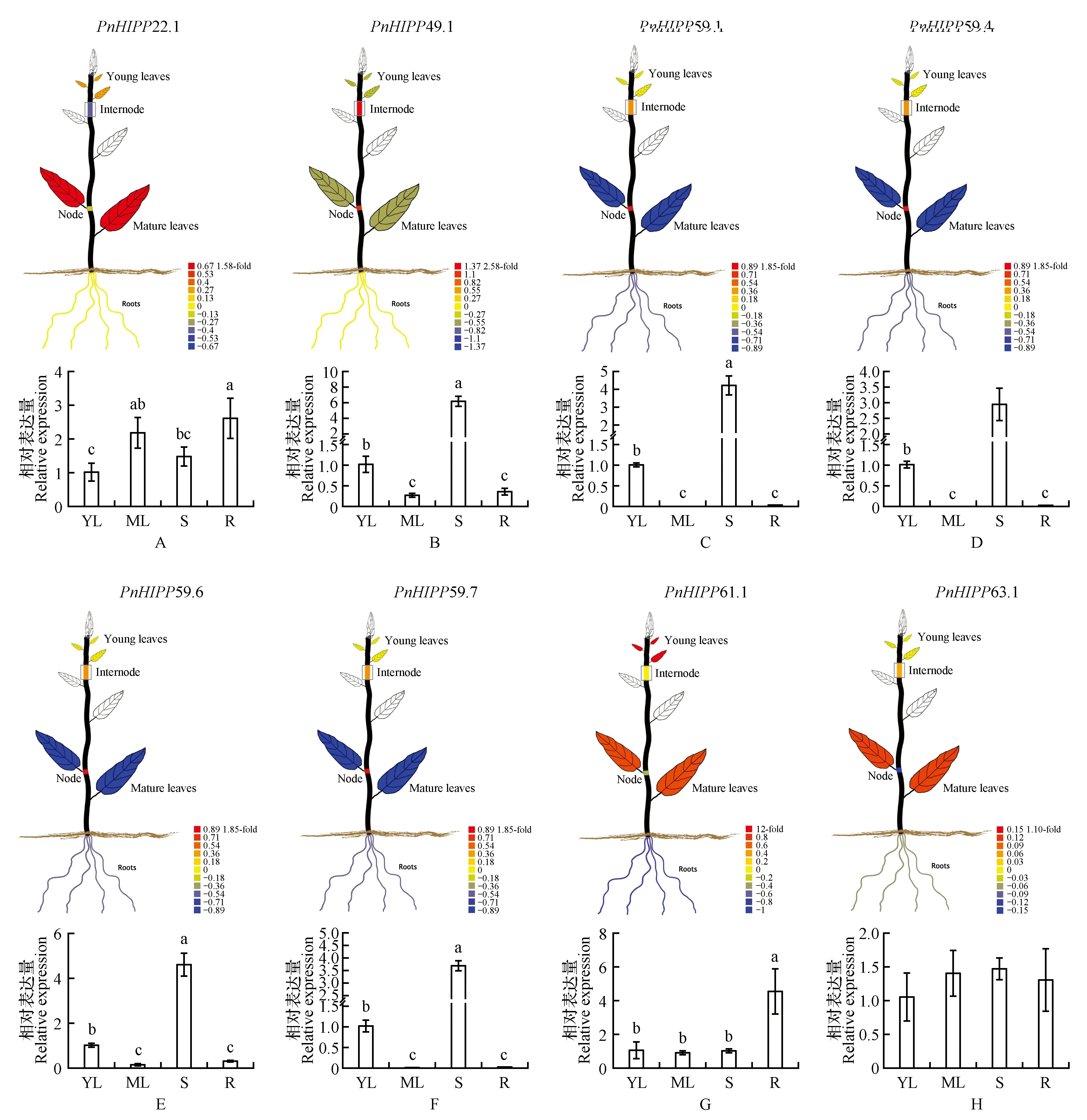
图5 PtHIPPs和PnHIPPs基因的组织表达特异性 毛果杨PtHIPPs基因的组织特异性表达可视图数据来自http://PlantGenIE.org[26]。柱形图为小黑杨中相应的PnHIPPs基因在幼叶(young leaves,YL)、成熟叶片(mature leaves,ML)、茎(stems,S)和根(roots,R)中的组织特异性表达模式,不同的字母代表邓肯检验中统计学上的显著差异(P<0.05)。Fig.5 Tissue-specific expression characterization of PtHIPPs and PnHIPPs genes The tissue-specific expression visual images of PtHIPPs genes in P.trichocarpa were generated using the data derived from http://PlantGenIE.org[26]. The bar graphs indicated the tissue-specific expression profiles which generated using the expression data of PnHIPPs genes in young leaves(YL),mature leaves(ML),stems(S),and roots(R) of P.simonii×P.nigra detected by qRT-PCR. The different letters represent statistical significant differences(P<0.05) using Duncan’s test.
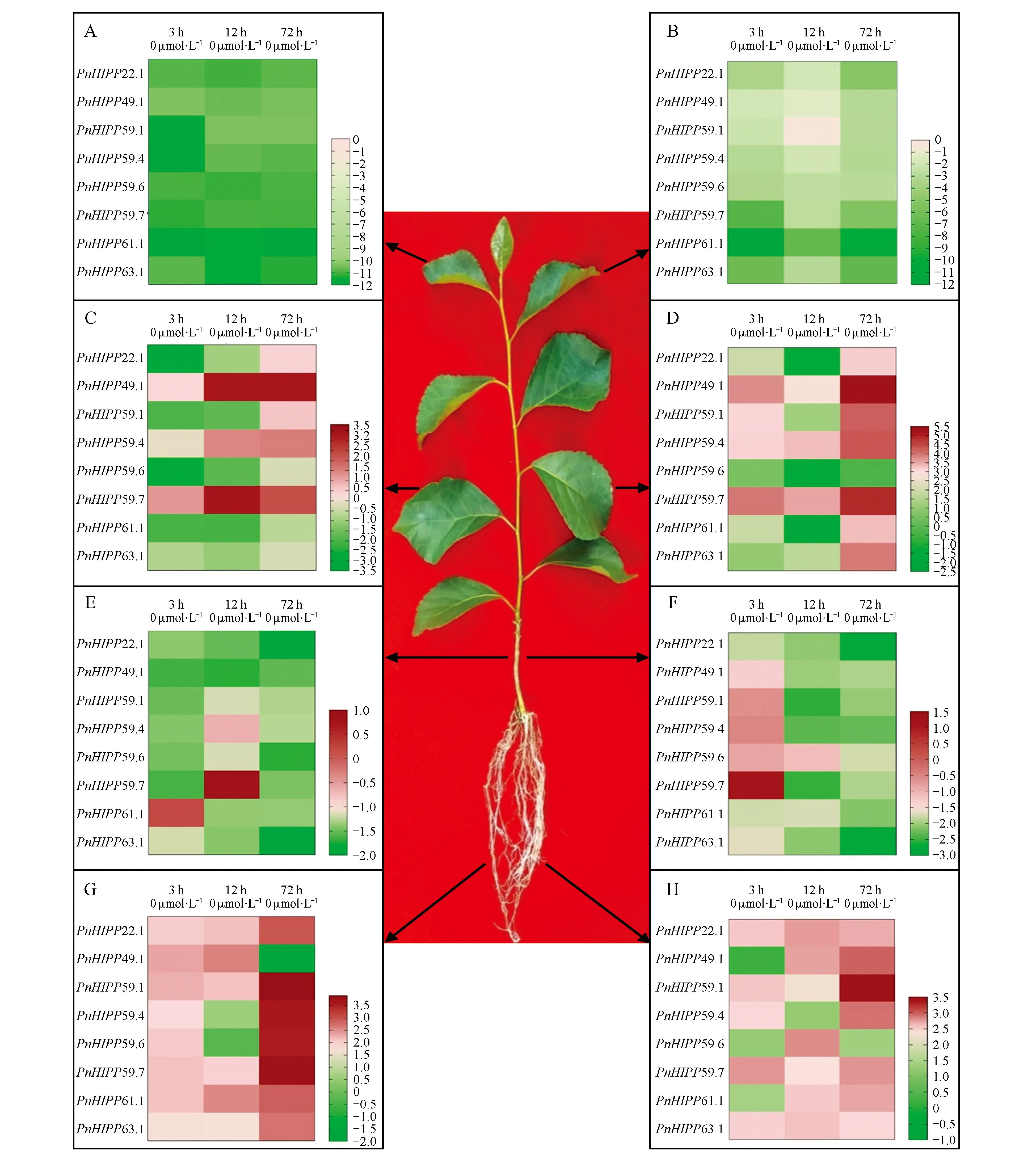
图6 铜胁迫条件下小黑杨不同组织中PnHIPPs基因的表达模式 A、C、E、G图为缺铜处理条件下幼叶、成熟叶片、茎、根中PnHIPPs基因的表达热图;B、D、F、H图为过量铜处理条件下这些组织中PnHIPPs基因的表达热图。图中黑色箭头所示依次为幼叶、成熟叶片、茎和根。热图左侧为基因名称,顶部标注为处理时间及铜离子浓度。用2-ΔΔCT法分析铜胁迫条件下不同组织中PnHIPPs的表达量。利用log2(样品/对照)值表示不同铜胁迫条件处理不同时间后每个PnHIPP基因的相对表达量。热图的右下角为标尺,热图中不同的颜色块表示处理后基因的表达量与对照相比上升或下降。Fig.6 Expression profiles of PnHIPPs genes in different tissues of P.simonii×P.nigra under copper stress conditionsA,C,E and G are heatmaps of PnHIPPs genes in young leaves,mature leaves,stems and roots under copper deficiency condition,and figures B,D,F and H are heatmaps of these genes in the tissues under excess copper treatment. The black arrows in the figure indicate the tissues of young leaves,mature leaves,stems,and roots in turn. In the heatmaps,the genes are shown on the left,and the copper stress concentrations and treatment times are indicated on the top. The 2-ΔΔCT method was used to analyze the expression levels of PnHIPPs in different tissues under copper stress conditions. The values of log2(sample/control) upon to copper stress conditions and different treated times were calculated as the relative expression levels of every PnHIPP gene. Scale bars are on the bottom right,and the different color of the cells in the heatmaps indicated the expression level of the genes went up or down compared with their controls after treatments.
2.7 铜胁迫条件下小黑杨PnHIPPs基因的表达模式分析
通过qRT-PCR鉴定PnHIPPs基因应答铜缺乏(0 μmol·L-1Cu2+)和铜过量(10 μmol·L-1Cu2+)胁迫条件的表达模式。结果如图6所示,与对照(0.5 μmol·L-1Cu2+)处理相比,不同组织中PnHIPPs基因应答铜缺乏和铜过量胁迫的表达模式存在差异。根中,除了PnHIPP49.1基因在缺铜处理72 h后表达量低于对照、PnHIPP59.6基因在缺铜处理12 h后表达量与对照无差异、PnHIPP49.1在过量铜处理3 h后表达水平与对照无差异之外,其他PnHIPPs基因在缺铜、过量铜处理不同时间后表达量均高于对照。茎中,除了PnHIPP59.7基因在缺铜处理12 h、PnHIPP61.1在缺铜处理3 h、PnHIPP59.7在过量铜处理3 h后表达水平分别高于对照之外,其他基因在缺铜、过量铜分别处理不同时间后表达量均低于对照。幼叶中,缺铜、过量铜处理3、12、72 h后8个PnHIPPs基因的表达量均低于对照。
成熟叶片中,PnHIPP22.1、PnHIPP59.1、PnHIPP59.6、PnHIPP61.1和PnHIPP63.1基因的表达量在缺铜处理3和12 h后低于对照,而PnHIPP49.1、PnHIPP59.4和PnHIPP59.7基因在缺铜处理12和72 h后表达量高于对照。PnHIPP22.1、PnHIPP59.6和PnHIPP61.1基因的表达量在过量铜处理3 h后高于对照,处理12 h后表达量低于对照;PnHIPP22.1和PnHIPP61.1基因在过量铜处理72 h后表达量又高于对照。PnHIPP49.1、PnHIPP59.4和PnHIPP59.7基因的表达水平在过量铜处理后均高于对照。
3 讨论
植物重金属耐受性是重金属吸收和分配的综合调控结果,金属伴侣蛋白是金属离子在细胞内安全传输、维持细胞内金属稳态的关键蛋白质。HIPP类蛋白是维管植物特有的在重金属稳态调节过程中发挥作用的伴侣蛋白。进化树分析结果显示,拟南芥、水稻、毛果杨和粟米的HIPP蛋白家族成员分为5个类别,本研究鉴定的14个含有2个重金属结合基序的PtHIPPs也包含其中,并采用相同的蛋白编号;de Abreu-Neto等推测包括HPPs和HIPPs在内的植物金属伴侣基因在植物进化的早期即已进行多样化分化,这种多样化主要发生在维管植物的祖先世系中,且这种高度分化的特性与此类基因家族在植物中的重要功能是一致的。进化分析也表明,HPPs和HIPPs基因在陆地植物进化过程中也存在基因复制和功能分化等现象[5]。HIPP类蛋白具有一个或两个保守的重金属结合基序和C端的异戊二烯化位点;已有的研究显示此类蛋白在不同植物物种中具有较多的家族成员[9]。目前认为,HIPPs蛋白可能与(1)重金属稳态及解毒机制相关,如镉耐受性;(2)与应答其他非生物胁迫相关,如ABA处理、寒冷或干旱;(3)与植物和病原菌的互作相关[5,13~14]。
HIPPs蛋白的重金属结合基序M/L/IXCXXC可以通过形成半胱氨酰硫配体结合重金属,参与金属转运和金属稳态[9,27]。应答镉胁迫的拟南芥CdI19蛋白定位于细胞膜,在细菌内表达后可以直接通过其CXXC基序与镉互作,由此推测CdI19蛋白可能作为重金属进入细胞的最初屏障在细胞的重金属稳态中发挥作用[8]。Dykema等的鉴定结果显示,拟南芥HIPP蛋白ATFP3可以通过MXCXXC基序与Cu2+、Ni2+和Zn2+结合[9]。研究表明,拟南芥的铜伴侣蛋白AtATX1、AtCCH和AtCCS的铜结合基序也是MXCXXC,这些蛋白在细胞铜稳态过程中发挥重要作用[28]。拟南芥AtATX1属于HPP类蛋白,N端可以形成典型的βαββαβ二级结构,C端不含CaaX基序[4,15]。AtATX1蛋白在细胞铜稳态过程中发挥关键作用,铜结合基序MXCXXC是AtATX1应答铜胁迫所必须的。生长在铜过量土壤中的过量表达AtATX1的拟南芥植株具有较高的铜耐受性,将MXCXXC突变成MXGXXG后,过量表达AtATX1的转基因株系与野生型的铜敏感性相同[18]。此外,与拟南芥AtATX1同源的酵母ScAtx1也具有铜结合基序MXCXXC且可以形成βαββαβ二级结构。ScAtx1能够将一个Cu+传递给CCC2蛋白;ScAtx1的赖氨酸富集区与CCC2蛋白的酸性氨基酸之间的静电引力可以实现这两种蛋白的互作[29~30]。人Atx1蛋白HAH1(Atox1)具有运输铜和抗氧化损伤功能,HAH1蛋白保守的赖氨酸突变后可以消除其抗氧化功能[31]。本研究鉴定的14个毛果杨PtHIPPs基因(包括同一基因的不同转录本)编码的PtHIPPs蛋白都含有两个MXCXXC重金属结合基序;8个PtHIPPs的N端可以形成2个完整的βαββαβ二级结构(图1);PtHIPPs蛋白氨基酸序列同源性比对结果显示,13个PtHIPPs蛋白具有赖氨酸富集区(图2);这些特征是铜伴侣蛋白ATX1具备的主要结构特点,由此推测,筛选到的毛果杨PtHIPPs蛋白有可能与维持杨树细胞的铜稳态相关。
异戊二烯化是蛋白质的翻译后修饰方式,是通过酶促反应将聚异戊二烯基团以硫醚键连接到多肽链C端CaaX的半胱氨酸上,此蛋白可以进行进一步修饰,包括切除aaX三个氨基酸残基或半胱氨酸羧基端甲基化。异戊二烯化可以促进蛋白质与其他蛋白质或与膜的特异性相互作用,进而调节细胞周期、信号转导、组织或细胞内囊泡转运等过程[7]。目前的研究表明,植物中某些具有异戊二烯化位点的HIPPs蛋白定位于细胞核,进而行使各种生理功能。冬麦HvFP1蛋白定位于细胞核,其表达受干旱和ABA诱导[13]。烟草NbHIPP26是非生物胁迫应答过程中质膜-细胞核的信号分子,未脂化的NbHIPP26主要定位于细胞核,可以激活干旱胁迫应答,并促进PMTV病毒的长距离运输[12]。拟南芥HIPP26蛋白在细胞核内与转录因子ATHB29互作进而应答脱水胁迫;HIPP26的M/L/IXCXXC基序的两个C在这种互作中至关重要[3]。拟南芥核定位的锌结合蛋白HIPP3含有两个HMA结构域,此蛋白可能通过结合锌作为应答病原体侵染的水杨酸依赖途径的上游调控因子,同时也与非生物胁迫应答、种子和花发育相关[14]。此外,小麦核定位的TaHIPP1蛋白在酵母中过量表达明显增加了细胞在铜胁迫条件下的生长率[10]。大豆GmHMADP基因含有4个外显子和3个内含子,编码的蛋白质具有2个MXCXXC金属离子结合位点,定位于细胞膜与细胞核,此蛋白无异戊二烯化位点。GmHMADP的表达量受Cu2+、Cd2+诱导上调。GmHMADP过表达拟南芥植株在Cu、Cd胁迫后根长和干重均显著高于野生型植株[32]。亚细胞定位预测结果显示,本研究鉴定的具有2个MXCXXC位点的毛果杨PtHIPPs蛋白定位于细胞核和细胞质的可能性较大。14个PtHIPPs蛋白可以分为3个亚组,这些蛋白的编码基因具有相同的基因结构,均含有3个内含子;此外,同一亚组内的PtHIPPs蛋白具有相同的基序组成且基序的排列顺序相同(图3);由此推测,同一亚组内的PtHIPPs蛋白可能具有相同或相似功能,且不同亚组之间的PtHIPPs蛋白可能存在功能差异。
表达数据分析及qRT-PCR检测结果显示,PtHIPPs和PnHIPPs基因的组织特异性表达特性存在差异。大多数PtHIPPs和PnHIPPs基因在节(茎)中大量表达,PtHIPPs基因在根中的表达量较低;除了PnHIPP63.1,其他PnHIPPs基因在成熟叶片和幼叶中的表达量都较低(图5)。PtHIPPs和PnHIPPs基因之间组织特异性表达模式的差异有可能是毛果杨和小黑杨之间的物种差异导致的。此外,定量鉴定数据表明,铜缺乏和铜过量胁迫条件都可以导致PnHIPPs基因在小黑杨不同组织中的表达模式发生改变(图6)。例如,缺铜和铜过量处理后幼叶PnHIPPs基因的表达模式相似,均低于对照。除了PnHIPP59.7和PnHIPP61.1基因,茎中其他基因在缺铜、过量铜处理不同时间后表达量均低于对照。根中大多数PnHIPPs基因的表达量在两种铜胁迫处理后普遍高于对照(PnHIPP49.1基因缺铜处理72 h后表达量低于对照)。成熟叶片中,PnHIPP49.1、PnHIPP59.4和PnHIPP59.7基因在缺铜和铜过量处理12、72 h后表达量均高于对照。
因此,根据重金属结合基序、异戊二烯化位点、赖氨酸富集区等结构特点,结合亚细胞定位预测结果、PtHIPPs和PnHIPPs基因的组织特异性表达特点、铜胁迫条件下PnHIPPs基因在小黑杨不同组织中的表达模式推测,HIPP蛋白家族成员可能在杨树的不同组织中参与结合铜及维持细胞铜稳态的复杂过程,但其功能的共性及特异性尚需进一步试验验证。
