杜仲脂氧合酶基因家族全基因组鉴定及其表达特性研究
2019-11-15朱利利杜庆鑫杜红岩
朱利利 庆 军 杜庆鑫 何 凤 杜红岩*
(1.中国林业科学研究院经济林研究开发中心,郑州 450003; 2.国家林业局杜仲工程技术研究中心,郑州 450003)
杜仲(EucommiaulmoidesOliv.)为杜仲科(Eucommiaceae)杜仲属(Eucommia)的单科单属植物,是第四纪冰川期后仅留存于我国的孑遗植物,具有重要的药用价值和经济价值[1]。杜仲的皮、叶、果等器官中含有丰富的杜仲胶、黄酮、多酚、绿原酸等次生代谢物质[2~4]。杜仲通过调节一系列代谢途径激活防御系统保护其在多种环境条件下正常生长发育,其中茉莉酸、愈伤激素、脂肪酸氢过氧化物、醛类挥发物在植物的生长发育和防御过程中发挥重要作用,而这些物质的生物合成过程受到脂氧合酶(Lipoxygenases,LOX)(EC:1.13.11.12)催化[5]。脂氧合酶(LOX)是一种含有非血红素铁的氧合酶,广泛存在于真核和原核生物中,参与JA,醛类、醇类等芳香物质的生物合成[6]。LOX在植物中以亚油酸、亚麻酸为底物,其9位或13位碳原子加氧生成脂氢过氧化物,根据加氧位置分为9-LOX和13-LOX[7]。LOX定位于植物不同亚细胞器,如黄瓜(Cucumissativus)的脂溶性LOX存在于胞桨和液泡中,而以跨膜蛋白形式存在的LOX定位于脂体膜和质膜上[8],同时LOX也定位于叶绿体、微粒体、脂体等细胞器[9]。
LOX是一个多基因家族,研究发现拟南芥(Arabidopsisthaliana)中有6个LOX[10],葡萄(Vitisvinifera)中有18个LOX(有5个为假基因)[11],杨树(Populustrichocarpa)中有21个LOX[12]。LOX是一种同工酶,植物的不同发育阶段和胁迫条件可诱导相应特异LOX基因的表达。水稻(Oryzasativa)[13]、拟南芥[14]、番茄[15]等植物受到机械损伤时,其13-LOX基因特异表达诱导JA生物合成;烟草(Nicotianatabacum)受到病菌感染时,9-LOX类型基因活性增加[16];土豆(Solanumtuberosum)叶片接种真菌后,POTLX-3(9-LOX类型)表达量增加,但机械损伤对9-LOX基因没有影响[17]。
目前杜仲的基因组测序已完成,在全基因组水平上研究杜仲的LOX基因信息对探索杜仲的生长发育和抗胁迫能力提供参考。本研究利用生物信息学方法对杜仲的LOX基因家族进行鉴定和分类,同时结合杜仲的RNA-seq,分析LOX家族在杜仲不同发育时期、组织器官的表达谱,探索杜仲LOX基因家族功能。
1 材料和方法
1.1 数据来源及LOX基因家族鉴定和结构分析
杜仲基因组测序数据、CDS序列、蛋白质序列及其注释信息均来源于杜仲基因组数据(NCBI登录号PRJNA357336、SRP095726及SRS2666014)。查阅国内外文献,下载已分类的5种植物的LOX氨基酸序列,水稻下载自水稻基因组(http://rice.plantbiology.msu.edu/)、拟南芥下载自TAIR(http://www.arabidopsis.org/),番茄下载自NCBI(登录号TomLOXA(U09026)、TomLOXB(U09025)、TomLOXC(U37839)、TomLOXD(U37840)、TomLOXE(AY008278)和TomLOXF(FJ617476)),葡萄和杨树的LOX氨基酸序列下载Phytozomev.11.0(https://phytozome.jgi.doe.gov/pz/portal.html)。
LOX基因的结构域信息(PF00305)下载自Pfam数据库,利用Hmmer 3.0软件建立Profile HMM模型,并利用此模型检索下载杜仲基因组数据中的蛋白质序列,根据已得到的杜仲LOX基因家族序列建立新的HMM模型,用新的模型再次检索杜仲蛋白质序列,得到的序列被认为是候选蛋白质序列,所有蛋白结构域经过SMART(http://smart.embl/heidelberg.de/)验证。利用GSDS在线工具(http://gsds.cbi.pku.edu.cn/)制作基因外显子-内含子结构图。利用Plant-Ploc在线工具(http://www.csbio.sjtu.edu.cn/bioinf/plant/)、WOLFPSORT(http://wolfpsort.seq.cbrc.jp/)和Softberry(http://www.softberry.com/)预测亚细胞定位,综合3个软件预测结果进行分析。
1.2 杜仲LOX氨基酸序列系统发育树构建
利用ClustalX2.0.12软件对杜仲、拟南芥、番茄、葡萄、杨树和水稻的LOX氨基酸序列进行多重序列比对。比对结果用软件MEGA6.0的最大似然法(Maximum Likelihood)构建系统进化树,抽样次数为1000(bootstrap:1000 relications),其他为默认值。
1.3 杜仲LOX蛋白质结构预测
使用在线工具ProtParam(http://web.expasy.org/protparam/)评估杜仲LOX蛋白的理论等电点、分子量、疏水性等理化性质,利用在线分析工具HNN Secondary StructurePrediction(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)预测LOX蛋白的α-螺旋、延伸链等二级结构。
1.4 杜仲LOX基因家族的表达分析
通过下载不同发育时期的国家审定杜仲良种‘华仲6号’的叶片(4月18日、5月18日、6月17日、7月17日、8月16日及9月20日)、果实(采样时间同叶片相同)和‘神农架’树皮(5月20日、7月20日及9月20日)的转录组数据获得杜仲LOX基因的测序表达谱(FPKM值,fragments per kilobase of exon per million fragments mapped),数据来源于杜仲基因组RNA数据,同时从NCBI网站SRA数据库(https://www.ncbi.nlm.nih.gov/sra)下载‘华仲6号’花后70天和160天种仁的测序表达谱(登录号分别是SRR3203265,70d;SRR3203241,160d)。去除在不同发育时期和组织中FPKM均小于1的基因,利用EXCELL对筛选的基因FPKM值进行log10(FPKM+1)转换,对数转换后的数据利用SPSS进行标准化,利用软件Cluster 3.0和JAVA TreeView-1.1.6对标准化的表达数据聚类分析。
2 结果与分析
2.1 杜仲LOX基因家族的鉴定
通过Hmmer 3.0搜索,杜仲基因组共鉴定出23个LOX基因家族成员(表1)。23个LOX基因分布于12条scaffolds,每条scaffold上分布的基因数量为1~5个,而多基因分布的scaffolds上的基因呈聚集形式分布,形成串联重复,推测这些基因发生过复制事件。杜仲LOX基因内含子数量分布范围是0~6,有9个LOX基因不含内含子,有4个基因含5个内含子,有5个基因含6个内含子,其他LOX基因分别含有1~2个内含子,其中EU05484-RA的内含子序列长度显然长于其它LOX基因内含子序列,内含子具体分布位置如图1所示。亚细胞定位预测结果显示杜仲23个LOX基因有15个定位于细胞质,8个定位于叶绿体。
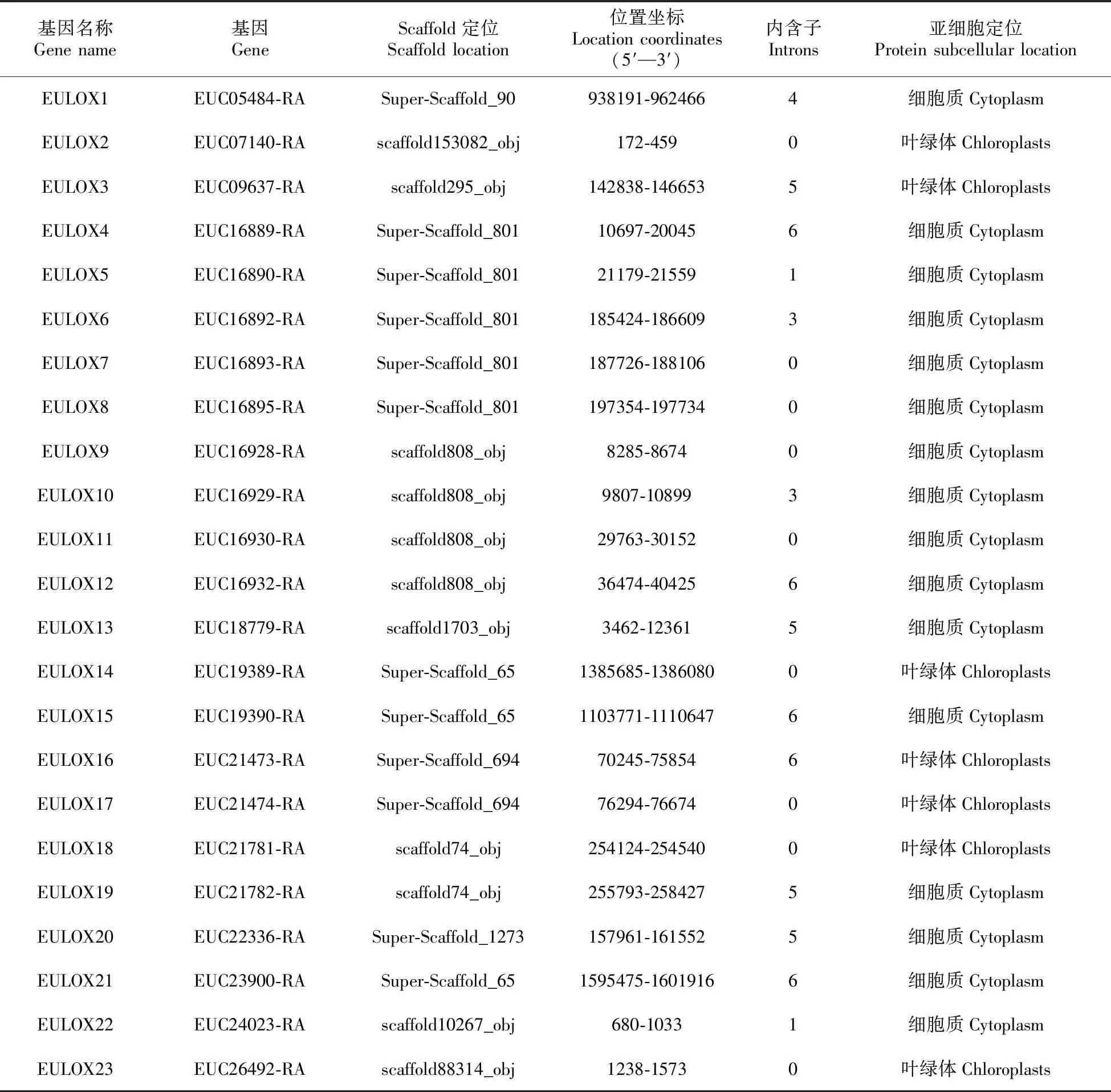
表1 杜仲LOX基因家族信息
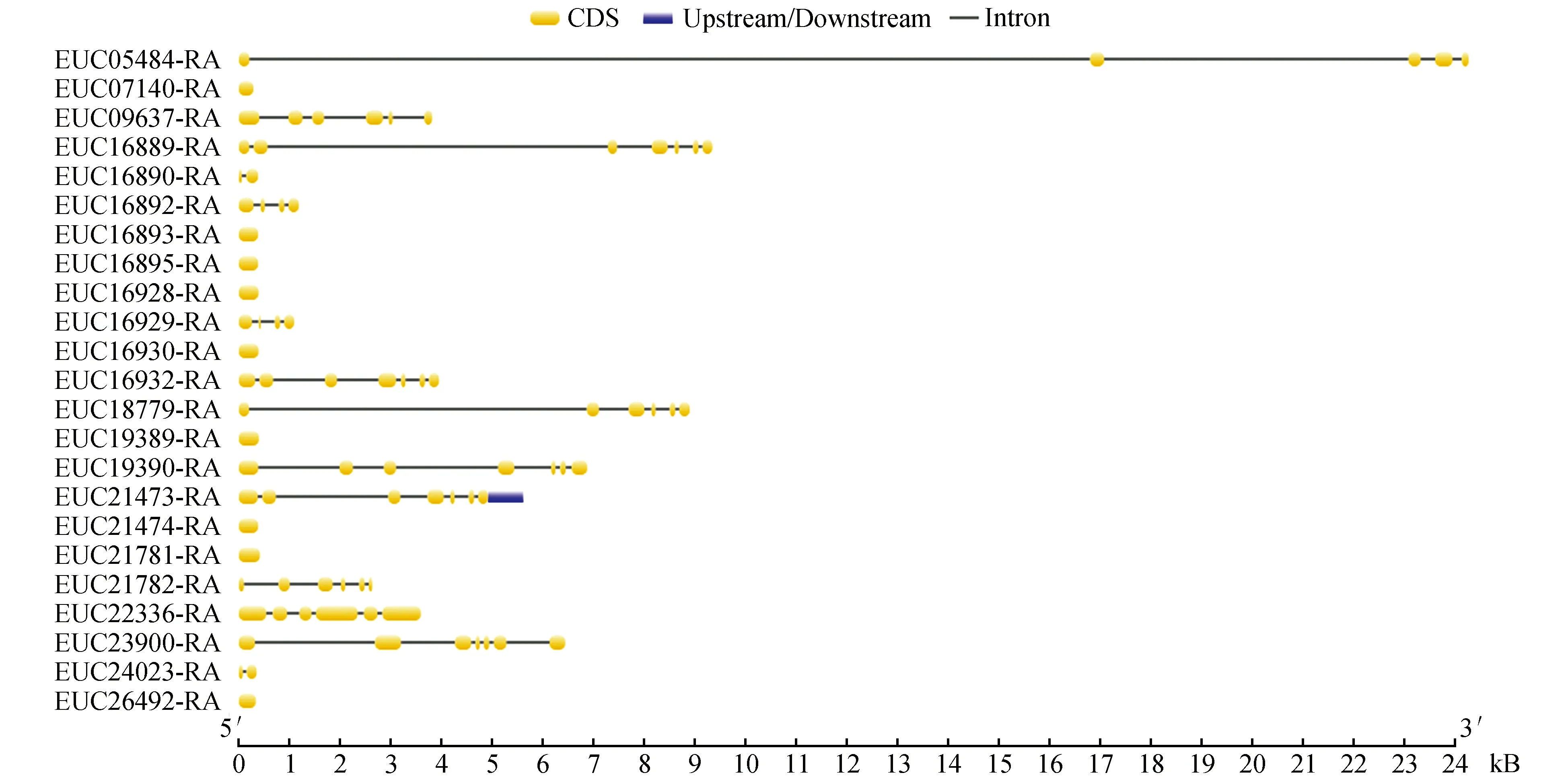
图1 杜仲LOX基因内含子外显子结构Fig.1 The intron-exon structures of LOX genes in E.ulmoide
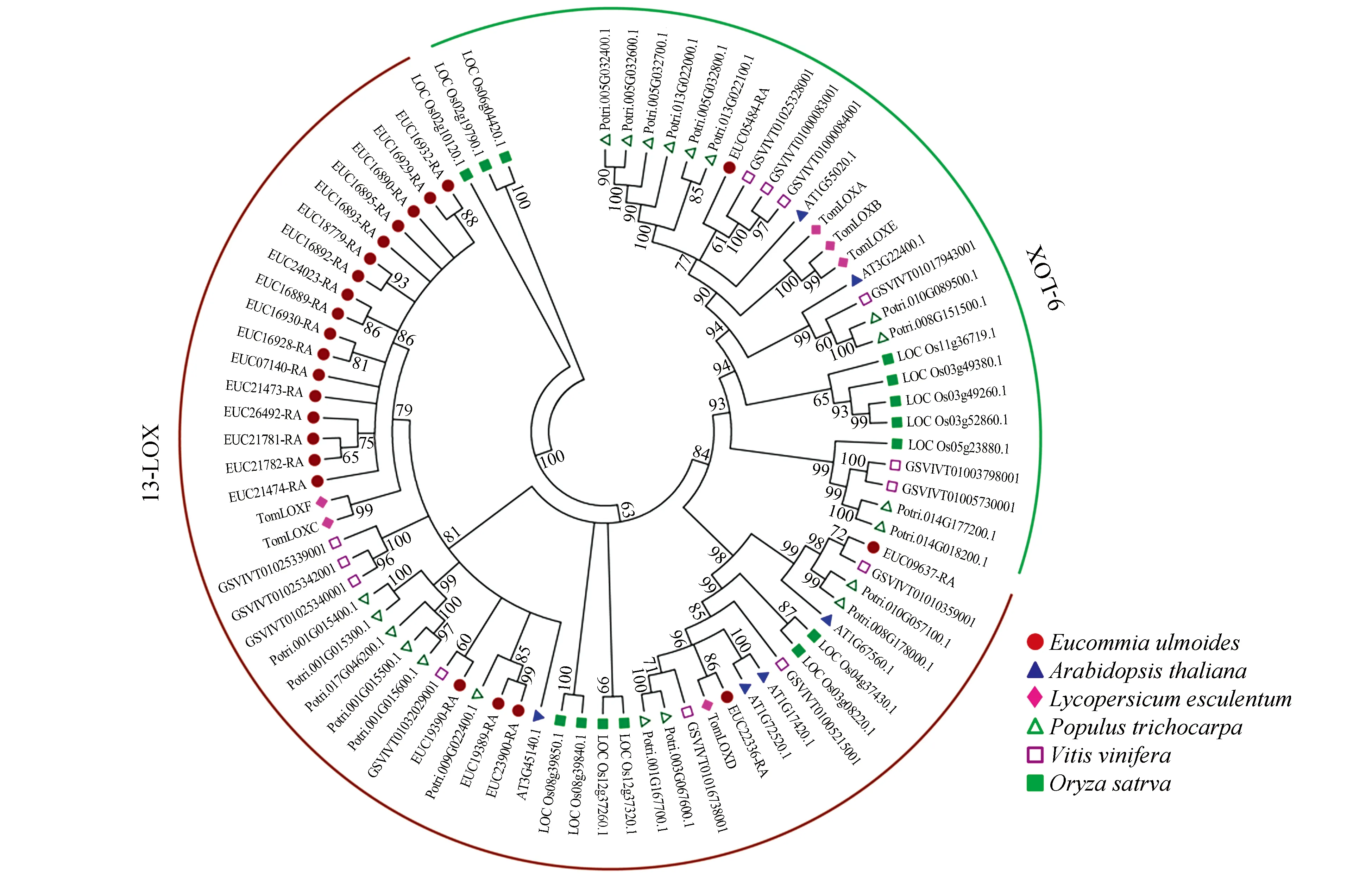
图2 杜仲与其他植物LOX氨基酸序列的系统进化树Fig.2 Phylogenetic tree analysis of the amino acid sequences of LOX in E.ulmoides and other plants
2.2 杜仲LOX氨基酸序列的聚类分析
依据杜仲LOX家族氨基酸长度和序列结构特征差异等特点,运用ClustalX2.0.12和MEGA对杜仲LOX氨基酸序列和已进行分类和功能研究的水稻、拟南芥、番茄、杨树、葡萄的LOX氨基酸序列构建系统进化树。进化树显示杜仲的LOX编码蛋白与番茄的LOX蛋白遗传距离最近,其次与葡萄、杨树和拟南芥的距离较近,而与水稻的LOX编码蛋白距离最远。杜仲23个LOX蛋白与其他5种植物的LOX蛋白分类结果相似,也可分为9-LOX蛋白和13-LOX蛋白两个类型,其中仅有EUC05484-RA编码蛋白属于9-LOX,其余22个LOX蛋白均属于13-LOX,杜仲的13-LOX蛋白家族成员数量占据明显优势,说明杜仲的13-LOX家族成员在进化上产生了较多扩增事件。杜仲的22个13-LOX家族成员聚为2个分支,其中第一个分支由EUC09637-RA和EUC22336-RA组成,分别与葡萄的GSVIVT01010359001编码蛋白和番茄的TomLOXD蛋白聚成一支,且较杜仲其他13-LOX家族成员与9-LOX类型聚类距离更近;杜仲其余20个13-LOX家族成员组成第二个分支,同时第二分支又继续分为3个小支,其中有17个成员与番茄的TomLOXC和TomLOXF蛋白聚为第一个小支,而EUC19390-RA单独与葡萄的GSVIVT01032029001编码蛋白聚为第二小支,EUC23900-RA和EUC19389-RA与杨树的Potri.009G022400.1蛋白聚为第三小支。杜仲的9-LOX家族唯一成员EUC05484-RA与葡萄的3个9-LOX蛋白聚在一起、遗传距离较近。遗传距离越近,表明蛋白结构和功能更为相似,暗示杜仲的LOX蛋白功能可能与番茄、葡萄和杨树的特定LOX蛋白具有相似的生理作用。
2.3 杜仲LOX基因家族蛋白质理化性质分析
利用Protparam在线工具分析杜仲LOX蛋白一级结构,表2显示杜仲23个LOX基因家族成员中,EUC22336-RA编码的氨基酸数量最多为968aa,EUC24023-RA编码的氨基酸数量最少为92,同时结果表明杜仲LOX基因家族编码氨基酸数目与其分子质量整体呈正相关,23个LOX基因的氨基酸数量和分子质量均具有差异。根据理论等电点氨基酸可以分为碱性氨基酸(Theoretical pI>7)和酸性氨基酸或中性氨基酸(Theoretical pI≦7);蛋白质总平均疏水性正值表现疏水性、负值表现为亲水性,且疏水值越大越疏水,值越小越亲水。其中EUC05484-RA为9-LOX家族成员,编码氨基酸数量为401,理论等电点是5.98,为酸性氨基酸,同时总平均疏水值为-0.312,为亲水性氨基酸。其余13-LOX类型中包括6个碱性氨基酸和16个酸性氨基酸或中性氨基酸,22个LOX蛋白疏水值均为负值,表现为亲水性。
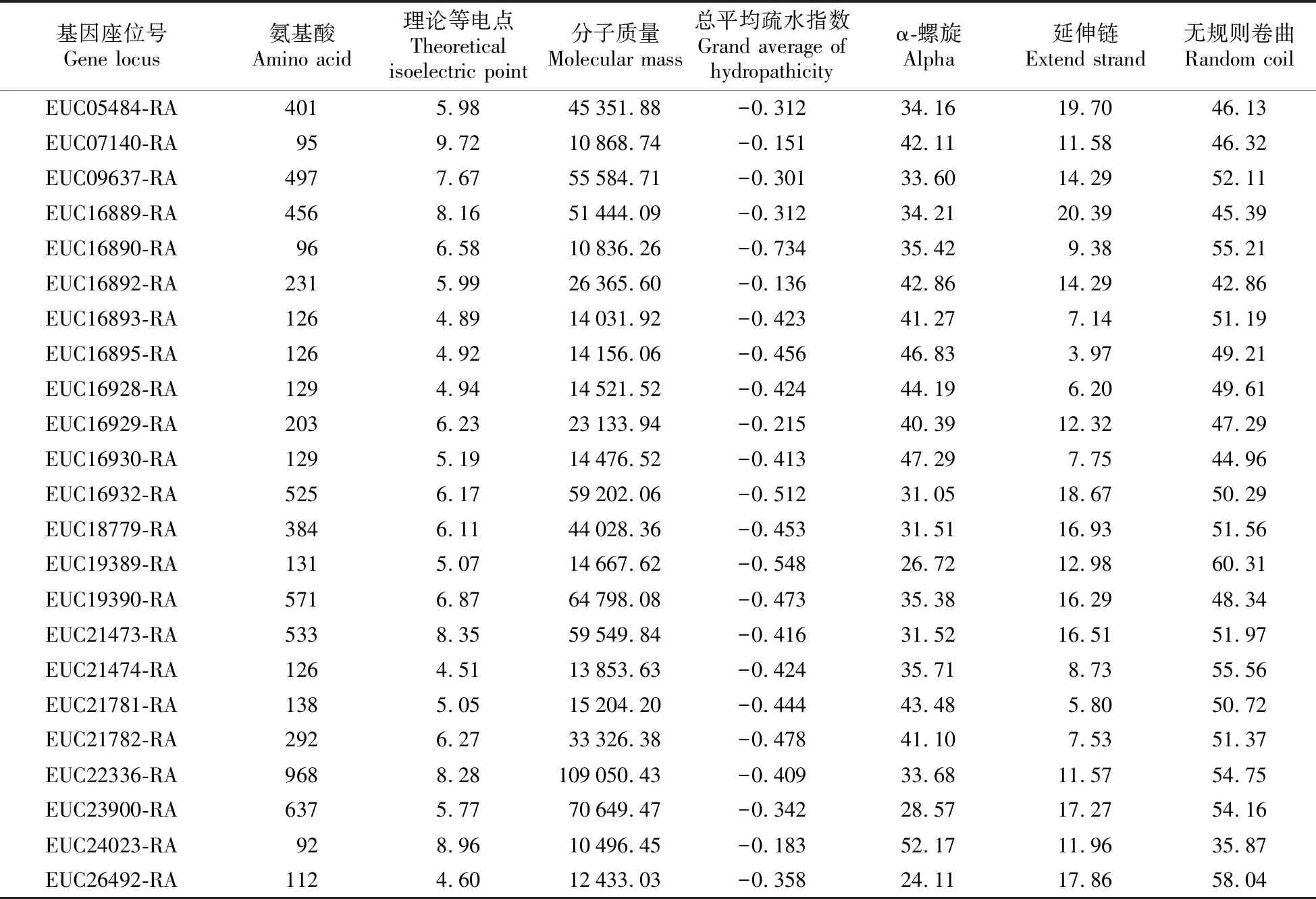
表2 杜仲LOX基因家族蛋白理化性质分析
HNN Secondary Stucture Prediction分析显示α-螺旋、延伸链和无规则卷曲在杜仲整个LOX蛋白质都有散布,其中无规则卷曲易受侧链相互作用,经常构成活性部位和功能部位,而α-螺旋在DNA结合基序中具有重要作用。杜仲有21个LOX蛋白以无规则卷曲所占比例较高为主要构成元件,α-螺旋所占比例次之,延伸链比例最低,其中以EUC19389-RA蛋白的无规则卷曲比例最高为60.31%。而EUC16930-RA和EUC24023-RA 2个LOX蛋白则以α-螺旋所占比例较高为主要构成元件,比例分别为47.29%和52.17%,其次无规则卷曲比例略低,分别为44.96%和35.87%,而延伸链比例最低。
2.4 杜仲LOX基因家族的表达分析
杜仲LOX基因家族在3个组织中的表达模式显示,有6个LOX基因(EUC16892-RA、EUC16893-RA、EUC16929-RA、EUC16930-RA、EUC24023-RA和EUC26492-RA)在不同发育时期及各组织中的FPKM值为0或接近0,暗示这6个基因在杜仲皮、叶、果和种仁中均不表达,其余17个LOX基因表达具有组织和时空特异性。组织特异性表达规律显示,这17个LOX基因表达模式可以分为3类,第Ⅰ类基因包含7个,在不同发育时期的果和叶中表达相对高,而在皮和种仁中表达相对较低;第Ⅱ类包含2个基因,在种仁中表达相对较高,其次在不同发育时期杜仲的皮、果有一定的表达量,而在不同发育时期的杜仲叶中表达相对较低;第Ⅲ类有8个基因,在杜仲皮中表达相对较高,在不同发育时期叶中有一定表达,在不同生长发育时期的果和种仁中表达相对较低,且第Ⅱ类和第Ⅲ类基因的表达更为相似。时空特异性表达规律显示,杜仲9-LOX基因(EUC05484-RA)在5月20日的皮、4月18日的果、4月18日的叶及花后70天的种仁中表达量相对其它时期较高,可能在生长发育早期阶段发挥重要作用;杜仲13-LOX基因在不同发育时期的组织中表达模式多样,一些基因在生长初期和后期表达高于中期,如EUC18779在4月份和8月份的果和叶中表达高于其他时期;同时也存在后期生长发育阶段表达高于前期的基因,如EUC16932在9月份皮、8月份果、叶及花后160天种仁中表达高于其他时期;也存在一些基因在各个发育时期的组织中表达量均相似,如EUC21473在4个组织的不同时期表达无明显差异。表达谱聚类图结果显示定位于一条Scaffold的基因表达模式总体相似,说明串联重复的基因可能具有相似的生理功能。
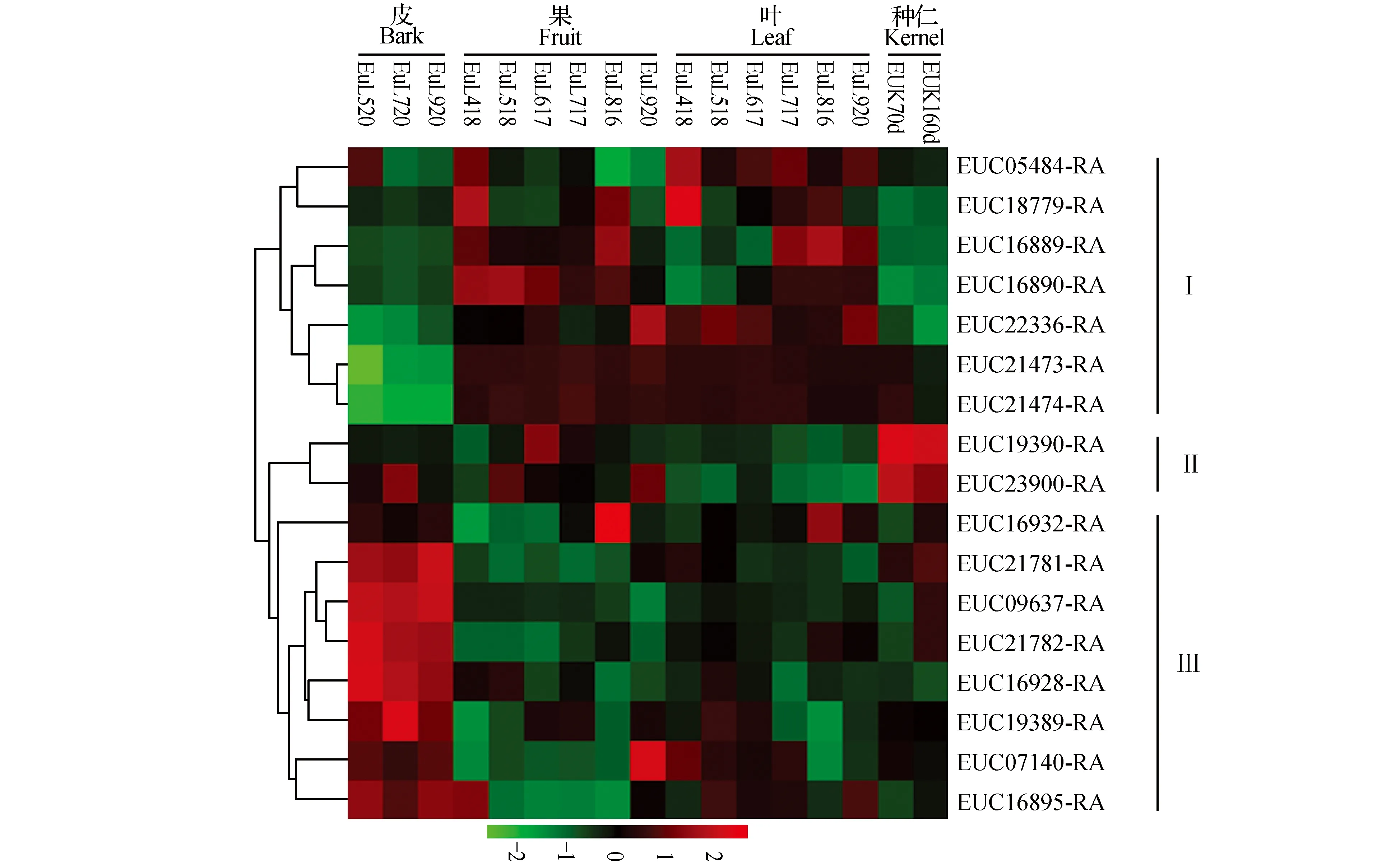
图4 杜仲LOX基因表达聚类分析Fig.4 Heat map of LOX gene expression obtained from RNA-seq in E.ulmoides
3 讨论
通过全基因组分析,从杜仲中鉴定了23个LOX基因,13-LOX型家族成员22个,9-LOX型家族成员仅一个。其中一些13-LOX成员以基因簇形式分布,可能发生了复制,形成串联重复。基因复制在基因家族进化过程中具有重要作用,可产生新基因并发生亚功能化或新功能化,以功能互补的方式分担祖先基因的功能[18],串联重复基因更易发生内含子获得,促进外显子重组和基因进化[19]。杜仲表达谱聚类显示其串联重复基因在不同发育时期的各个组织器官中表达量虽有一定差异,但总体变化趋势是相似的,表明杜仲的串联重复基因在生理功能更可能发生了亚功能化,以功能互补的方式作用机体。
前人研究显示13-LOX及其衍生物更多参与茉莉酸、醛类、醇类物质合成,在逆境胁迫防御过程中发挥作用[21],而9-LOX基因及其衍生物与植物生长发育[20]和抗菌[22]具有一定的相关性。Chauvin等发现拟南芥的13-LOX基因能够促进JA的合成抵抗机械损伤胁迫[14]。孙炎锋等发现13-LOX基因在拟南芥叶片衰老过程中也发挥重要生理作用[23]。此外,番茄的13-LOX类型(TomLOXC、TomLOXD和TomLOXF)与茉莉酸合成相关,其中TomLOXC和TomLOXD与机械损伤有关,具有抵抗生物和非生物胁迫作用,同时两者也参与C6醛类挥发物合成以形成特殊风味;而番茄9-LOX基因(TomLOXA、TomLOXB和TomLOXE)则与果实成熟相关[15]。但研究发现拟南芥和小麦在感染病菌后其9-LOX基因通过调节水杨酸和茉莉酸信号传导能力促进抗病[24]。
杜仲的22个13-LOX基因,其中有18个基因与番茄的13-LOX基因(TomLOXC、TomLOXF)遗传距离比较近,表明杜仲的13-LOX基因可能参与茉莉酸、醛类、醇类物质的合成,或许与植物衰老、机械损伤等过程相关,暗示杜仲的13-LOX具有抵抗生物和非生物胁迫的潜在能力,同时13-LOX在不同组织中和不同发育时期表达特征存在多样性,不同类型13-LOX基因在杜仲的特定生长发育阶段具有高表达,这些基因可能以功能互补的方式在杜仲整个生长发育时期发挥生理作用。表达分析结果显示杜仲9-LOX基因EU05485表达同样具有组织特异性,且在组织发育前期表达较高,在生长后期表达量下降,但在发育后期是否作用减弱还需要试验验证。目前关于杜仲LOX基因家族的具体生理功能还需进一步的试验验证分析。
