新生鼠肾积水病肾组织转化生长因子β1、单核细胞趋化蛋白-1、胰岛素样生长因子-1、内皮素-1蛋白水平表达变化的意义
2019-11-14田文超马洪刘贤贤郑步峰傅廷亮
田文超 马洪 刘贤贤 郑步峰 傅廷亮
[摘要]目的 探討新生鼠肾积水病肾组织转化生长因子β1(TGF-β1)、单核细胞趋化蛋白-1(MCP-1)、胰岛素样生长因子-1(IGF-1)、内皮素-1(ET-1)蛋白水平表达变化的意义。方法 选取新生48 h内的Wistar鼠72只,随机分为6组,每组12只,随机选择1组作为对照组,其余5组均制作成输尿管左侧部分梗阻的动物模型。通过HE染色法观察病肾组织的病理结构变化并对病肾组织做出相应的病理学分级;通过免疫组化SP法检测新生鼠的肾脏组织中TGF-β1、MCP-1、IGF-1、ET-1的蛋白水平表达情况。结果 在梗阻解除后12周,模型组中TGF-β1的蛋白表达量与对照组比较,差异无统计学意义(P>0.05);模型组的ET-1、MCP-l蛋白表达量(6.20±1.16,3.34±0.06)高于对照组(2.27±0.73,0.71±0.25),差异有统计学意义(P<0.05);模型组的IGF-1蛋白表达量(18.12±1.08)低于对照组(28.38±4.82),差异有统计学意义(P<0.05)。模型组各病理学分级(Ⅰ、Ⅱ、Ⅲ、Ⅳ级)新生鼠的TGF-β1蛋白表达量比较,差异均有统计学意义(P<0.05)。模型组Ⅱ级新生鼠的ET-1、MCP-1蛋白表达量与Ⅰ级的比较,差异无统计学意义(P>0.05),Ⅲ、Ⅳ级的ET-1、MCP-1蛋白表达量高于Ⅱ级,差异有统计学意义(P<0.05)。模型组Ⅱ、Ⅲ、Ⅳ级新生鼠的IGF-1蛋白表达量低于Ⅰ级,模型组Ⅳ级新生鼠的IGF-1蛋白表达量低于Ⅲ级,差异均有统计学意义(P<0.05),模型组Ⅱ级新生鼠的IGF-1蛋白表达量与Ⅲ级比较,差异无统计学意义(P>0.05)。TGF-β1、MCP-l、ET-1、IGF-1的蛋白表达量在梗阻解除后的不同时间点比较:梗阻解除后6、8、12周,模型组中的TGF-β1、MCP-l、ET-1蛋白表达量均低于梗阻解除后2周,IGF-1蛋白表达量高于梗阻解除后2周,差异有统计学意义(P<0.05)。模型组中梗阻解除后2周的TGF-β1、MCP-l、ET-1、IGF-1蛋白表达量与梗阻解除后0周比较,差异无统计学意义(P>0.05)。模型组中梗阻解除后8周的TGF-β1、MCP-l、ET-1、IGF-1蛋白表达量与梗阻解除后6周比较,差异无统计学意义(P>0.05)。梗阻解除后12周,模型组中的TGF-β1、MCP-l、ET-1蛋白表达量均低于梗阻解除后8周,IGF-1蛋白表达量高于梗阻解除后8周,差异有统计学意义(P<0.05)。TGF-β1的蛋白表达量与病理学分级均成正相关关系(r=0.873,P<0.01);ET-1、MCP-1的蛋白表达量与病理学分级均成正相关关系(r=0.579、0.637,P<0.05);IGF-1的蛋白表达量与病理学分级无明显的相关性(P>0.05)。结论 病肾组织的组织病理学改变随梗阻解除时间延长而逐渐恢复。TGF-β1的蛋白水平表达随梗阻病理学分级的增加而增加,随梗阻解除的时间延长而逐渐下降。TGF-β1可作为新生鼠肾积水病肾的损害程度及恢复情况判定的可靠指标。
[关键词]新生鼠;肾积水;蛋白水平
[中图分类号] R693 [文献标识码] A [文章编号] 1674-4721(2019)9(b)-0015-06
Significance of expression changes of transforming growth factor β1, monocyte chemoattractant protein-1, insulin-like growth factor-1, endothelin-1 proteins in renal tissues of neonatal rats with hydronephrosis
TIAN Wen-chao1 MA Hong2 LIU Xian-xian3 ZHENG Bu-feng1 FU Ting-liang1
1. Department of Pediatric Surgery, Affiliated Hospital of Binzhou Medical College, Shandong Province, Binzhou 256603, China; 2. Department of Pediatric Surgery, Affiliated Hospital of Zunyi Medical College, Guizhou Province, Zunyi 563003, China; 3. Department of Infectious Diseases, Affiliated Hospital of Binzhou Medical College, Shandong Province, Binzhou 256603, China
[Abstract] Objective To investigate the significance of changes in the expression of transforming growth factor β1 (TGF-β1), monocyte chemoattractant protein-1 (MCP-1), insulin-like growth factor-1 (IGF-1) and endothelin-1 (ET-1) proteins in renal tissue of neonatal rat hydronephrosis. Methods A total of 72 Wistar rats within 48 h of newborn were selected and randomly divided into 6 groups with 12 rats in each group. One group was randomly selected as the control group, the other 5 groups were all made into animal models of partial obstruction of the left ureter. The structural changes of the diseased kidney tissues were observed by HE staining and the pathological grades of the diseased kidney tissues were made accordingly. The expression of TGF-β1, MCP-1, IGF-1 and ET-1 in kidney tissue of Wistar rats were detected by immunohistochemical SP method. Results At 12 weeks after the obstruction was relieved, the protein expression of TGF-β1 in the model group was not significantly different from that in the control group (P>0.05). The expression of ET-1 and MCP-l protein in the model group (6.20±1.16, 3.34±0.06) were higher than those in the control group (2.27±0.73, 0.71±0.25), the differences were statistically significant (P<0.05). The expression of IGF-1 protein in model group (18.12±1.08) was lower than that in control group (28.38±4.82), and the difference was statistically significant (P<0.05). Compared with the expression of TGF-β1 protein in all pathological grades (grade Ⅰ, Ⅱ, Ⅲ, Ⅳ) in the model group, the differences were statistically significant (P<0.05). The expression of ET-1 and MCP-1 protein in model group Ⅱ newborn mices were not significantly different from those in model group Ⅰ (P>0.05). The expression of ET-1 and MCP-1 protein in model group Ⅲ and Ⅳ were significantly higher than those in model group Ⅱ, the differences were statistically significant (P<0.05). The expression of IGF-1 protein in model group Ⅱ, Ⅲ and Ⅳ newborn mices were lower than those in grade Ⅰ, while the expression of IGF-1 protein in model group Ⅳ newborn mices were lower than that in grade Ⅲ, the differences were statistically significant (P<0.05). The expression of IGF-1 protein in model group Ⅱ newborn mices had no significant difference compared with grade Ⅲ (P>0.05). Comparison of protein expressions about TGF-β1, MCP-l, ET-1 and IGF-1 at different time points after obstruction were relieved. The expression of TGF-β1, MCP-l, ET-1 protein in the model group were lower than 2 weeks after the obstruction were relieved, and the expression of IGF-1 protein was higher than 2 weeks after the obstruction were relieved, the differences were statistically significant (P<0.05). In the model group, the expression of TGF-β1, MCP-l, ET-1, IGF-1 protein at 2 weeks after obstruction were relieved were not significantly different from that at 0 weeks after obstruction were relieved (P>0.05). The expression of TGF-β1, MCP-l, ET-1, IGF-1 protein in the model group at 8 weeks after obstruction were relieved were not significantly different from those at 6 weeks after obstruction were relieved (P>0.05). The expression of TGF-β1, MCP-l, ET-1 protein in model group were lower than those in 8 weeks after obstruction were relieved, and the expression of IGF-1 protein was higher than that in 8 weeks after obstruction were relieved, the differences were statistically significant (P<0.05). The protein expression of TGF-β1 was positively correlated with pathological grade (r=0.873, P<0.01). The protein expressions of ET-1 and MCP-1 were positively correlated with pathological grade (r=0.579, 0.637, P<0.05). There was no significant correlation between IGF-1 protein expression and pathological grade (P>0.05). Conclusion Histopathological changes of diseased kidney tissue gradually recover with the extension of obstruction relieving time. The expression of TGF-β1 protein level increases with the increase of pathological grade of obstruction, and gradually decreases with the extension of time to relieve obstruction. TGF-β1 can be used as a reliable index to judge the degree of renal damage and recovery of hydronephrosis in newborn rats.
[Key words] Newborn rat; Hydronephrosis; Protein level
先天性肾积水是小儿泌尿外科的常见疾患,新生儿的发病率为1%~2%,最常见的病因是肾盂输尿管连接部梗阻,可导致患肾发生复杂的病理生理变化[1]。肾盂与输尿管上段连接处呈漏斗状,肾盂收缩时输尿管上段扩张,尿液从肾盂排向输尿管。如果肾盂输尿管连接处存在梗阻,妨碍了尿液顺利地排入输尿管,导致集合系统张力增加,从而引发肾积水。国内外学者对先天性肾积水做了大量的实验研究,但先天性肾积水的具体发病机制尚不十分明确,尤其是对如何确定积水肾脏的功能是否存在进行性损害仍缺乏简单有效的方法[2]。近年来,随着分子生物学技术广泛应用于临床及实验研究,已发现转化生长因子-β1(TGF-β1)、单核细胞趋化蛋白-1(MCP-1)、胰岛素样生长因子-1(IGF-1)以及血管活性多肽如内皮素-1(ET-1)等不同程度地参与了先天性肾积水的发生机制,但它们能否用于检测病肾的损害程度,鲜有报导。因此,本研究选取新生48 h内的Wistar鼠制成输尿管左侧部分梗阻的动物模型,通过HE染色法观察病肾组织的结构变化,以及通过免疫组化SP法分别检测在梗阻期间及梗阻解除后的病肾组织中TGF-β1、MCP-1、IGF-1、ET-1的蛋白水平表达情况,旨在探寻一种评定先天性肾积水病肾损害程度的理想指标,现报道如下。
1材料与方法
1.1实验材料与仪器
SPF级的Wistar孕鼠10只[重庆市中药研究院实验动物研究所,许可证号:SCXK(渝)20070006],体重(300±50)g,采用上述孕鼠所产48 h内新生鼠,建立动物模型[3];SP-9001免疫组化染色试剂盒(北京中杉金桥生物技术有限公司);TGF-β1-Rabbit Anti、IGF-1-Rabbit Anti(Santa Cruz Biotechnology,Inc);MCP-1兔抗大鼠多克隆抗体、ET-1兔抗大鼠多克隆抗体(武汉博士德生物有限公司);RM2135型石蜡切片机、光学显微镜、Leica Qwin V3型细胞图像分析仪(均产自德国Leica公司)。
1.2方法
1.2.1动物分组及标本制备 选取72只新生48 h内的Wistar鼠,将其随机分为6组,每组12只。随机选择1组作为对照组,对照组仅行假手术(切开腹腔,显露左侧输尿管后关闭切口);其余5组均用腰大肌压迫法制成输尿管左侧部分梗阻模型,然后再随机分为5组作为模型组。随机选取1组于造模后3周采集病肾组织并处死;其余4组再次行手术解除梗阻,分别于梗阻解除后2、6、8、12周随机选取1组采集病肾组织并处死。将切取的肾脏组织进行处理分别行病理学及免疫组织化学分析。其中,模型组术中死亡5例,术后死亡4例,存活51例,对照组全部存活。
病肾的组织学改变按Elder[4]法分级。肾脏Elder病理学分级,具体包括,Ⅰ级:正常肾脏;Ⅱ级:轻度梗阻性肾病,病变仅限于肾小囊腔轻度扩张、集合管轻度间质纤维化和肾皮质慢性炎症;Ⅲ级:中度梗阻性肾病,病变在Ⅱ级基础上加上肾小球改变,包括球样硬化,异常肾小球达25%,肾皮质变薄,肾小球数量减少,中度间质性纤维化和炎症反应;Ⅳ级:重度梗阻性肾病,在Ⅲ级基础上合并显著的区域性肾小球表面硬化,异常肾小球超过25%,肾小囊消失;Ⅴ级:重度梗阻性肾病伴囊下微小囊生成,肾小管、肾小球显著病变,间质纤维化严重,并出現慢性间质性炎症。
1.2.2免疫组化SP法检测蛋白水平 将石腊块经切片、脱蜡、水化和抗原修复,按免疫组织化学染色SP法步骤操作,分别进行TGF-β1、MCP-1、ET-1及IGF-1的蛋白检测,DAB显色,苏木素复染,脱水,透明,封片处理。阳性对照片为试剂公司提供,阴性对照片为以PBS代替一抗所制成的片。显微镜下观察,以胞浆或细胞间质点状或片状棕黄色颗粒为阳性结果,在每张切片随机选取10个互不交叉重叠的高倍镜视野(400×),经Leica Qwin V3型细胞图像分析系统计算阳性信号的光密度值作为其表达强度进行分析,最后计算平均值和标准差(x±s)。
1.3统计学方法
采用SPSS 18.0统计学软件进行实验数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;不符合正态分布者经过变量转换为正态分布后行统计学分析;病理学分级与病肾组织TGF-β1、MCP-1、ET-1及IGF-1的光密度值采用Spearman秩相关性分析,以P<0.05为差异有统计学意义。
2结果
2.1 HE染色结果
Wistar鼠积水肾脏可见肾小球和肾小管数目减少,肾小管管腔扩张明显,上皮细胞萎缩(图1,见封三)。
2.2免疫组化检测结果
对照组Wistar鼠的肾脏组织中,TGF-β1、MCP-l、ET-1的蛋白呈弱阳性表达,棕色颗粒弥散大多分布于近曲小管的细胞胞浆内,在肾小球内呈阴性或弱阳性表达(图2A、B、C,见封三)。对照组肾小管内的IGF-1蛋白呈强阳性表达,棕色颗粒弥散大多分布于近曲小管、极少数分布于远曲小管的细胞胞浆内、在肾小球内未见表达(图2D,见封三)。模型组肾小管TGF-β1、MCP-l、ET-1的蛋白呈强阳性表达(图3A、B、C见封四)。模型组肾小管内的IGF-1蛋白呈弱阳性表达(图3D,见封四)。
随着梗阻解除时间的延长,TGF-β1、MCP-l、ET-1、ET-1的蛋白表达逐渐减弱,其中,TGF-β1在梗阻解除后12周的蛋白表达趋于正常水平,而MCP-1及ET-1的蛋白表达仍稍强于对照组,IGF-1蛋白在对照组中呈强阳性表达,棕色颗粒大多分布于近曲小管以及少数的远曲小管的细胞胞浆内,IGF-1蛋白在模型组中则呈弱阳性表达,且随梗阻解除的时间延长,IGF-1蛋白的表达逐渐增强(图4 A、B、C、D,见封四)。
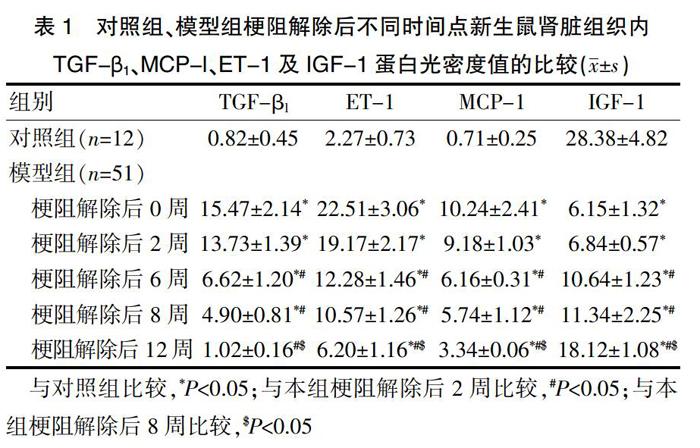
梗阻解除后0、2、6、8周,模型组中的TGF-β1、MCP-l、ET-1蛋白表达量均高于对照组,IGF-1蛋白表达量低于对照组,差异有统计学意义(P<0.05);在梗阻解除后12周,模型组中的TGF-β1蛋白表达量与对照组比较,差异无统计学意义(P>0.05);在梗阻解除后12周,模型组中的MCP-l、ET-1蛋白表达量高于对照组,差异有统计学意义(P<0.05);在梗阻解除后12周,模型组中的IGF-1蛋白表达量低于对照组,差异有统计学意义(P<0.05)。TGF-β1、MCP-1、ET-1的蛋白表达水平随梗阻解除时间的延长而逐渐下降,IGF-1的蛋白表达水平随梗阻解除时间的延长而逐渐升高。TGF-β1、MCP-l、ET-1、IGF-1的蛋白表达量在模型组梗阻解除后的不同时间点比较:梗阻解除后6、8、12周,模型组中的TGF-β1、MCP-l、ET-1蛋白表达量均低于梗阻解除后2周,IGF-1蛋白表达量高于梗阻解除后2周,差异有统计学意义(P<0.05)。模型组中梗阻解除后2周的TGF-β1、MCP-l、ET-1、IGF-1蛋白表达量与梗阻解除后0周比较,差异无统计学意义(P>0.05)。模型组中梗阻解除后8周的TGF-β1、MCP-l、ET-1、IGF-1蛋白表达量与梗阻解除后6周比较,差异无统计学意义(P>0.05)。梗阻解除后12周,模型组中的TGF-β1、MCP-l、ET-1蛋白表达量均低于梗阻解除后8周,IGF-1蛋白表达量高于梗阻解除后8周,差异有统计学意义(P<0.05)(表1)。
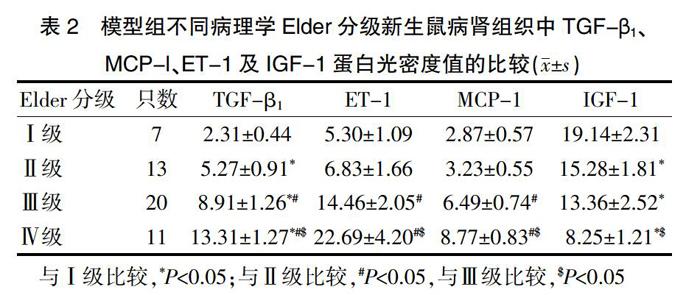
模型组新生鼠TGF-β1、MCP-1、ET-1的蛋白表达量随病理学分级的增加而逐渐升高,IGF-1的蛋白表达量随病理学分级的增加而逐渐降低。模型组各病理学分级(Ⅰ、Ⅱ、Ⅲ、Ⅳ级)新生鼠的TGF-β1蛋白表达量比较,差异均有统计学意义(P<0.05)。模型组Ⅱ级新生鼠的ET-1、MCP-1蛋白表达量与Ⅰ级的比较,差异无统计学意义(P>0.05),Ⅲ、Ⅳ级的ET-1、MCP-1蛋白表达量高于Ⅱ级,差异有统计学意义(P<0.05)。模型组Ⅱ、Ⅲ、Ⅳ级新生鼠的IGF-1蛋白表达量低于Ⅰ级,模型组Ⅳ级新生鼠的IGF-1蛋白表达量低于Ⅲ级,差异均有统计学意义(P<0.05);模型组Ⅱ级新生鼠的IGF-1蛋白表达量与Ⅲ级比较,差异无统计学意义(P>0.05)(表2)。
2.3病肾组织TGF-β1、MCP-1、ET-1及IGF-1蛋白表达量与病理学检测的相关性分析
Spearman相关性分析结果提示,TGF-β1的蛋白表达量与病理学分级均成正相关关系(r=0.873,P<0.01);ET-1、MCP-1的蛋白表达量与病理学分级均成正相关关系(r=0.579、0.637,P<0.05);IGF-1的蛋白表达量与病理学分级无明显的相关性(P>0.05)。
3讨论
肾盂输尿管交界处狭窄是先天性肾积水的主要病因。输尿管梗阻后尿液排出受阻,肾盂肾盏被动扩张,肾间质水肿,从而引发局灶性炎性细胞浸润,肾间质纤维化,最终可导致肾脏萎缩、丧失功能。目前,彩超、病理学分级、ECT等是评估小儿肾积水病肾损害情况的常见方法,但各有其局限性。因此,探寻出一种能准确反映积水肾脏功能的标志物显得尤为重要。分子生物学技术在肾积水发生机制研究领域的应用日益增多,为该标志物的探寻提供了条件。
TGF-β1是TGF-β超家族的创始成员,包括活性成分、可生长因子、可分化因子等,能促进细胞外基质蛋白的生成和聚集。哺乳動物中普遍存在TGF-β1-3,不同种属来源的TGF-β1具有高度同源性,但具有生物活性的仅有二聚体形式的TGF-β1。TGF-β1的免疫调节与促纤维化作用是近些年来的研究热点,国内外学者已有大量报导。TGF-β1可促使肾脏蛋白酶抑制因子的生成,从而促进肾小球的硬化、肾间质的纤维化[5]。另有研究发现[6],在肾积水病肾间质中的TGF-β1 mRNA表达明显增高,而在正常对照组的肾脏组织中则为低表达或阴性。众所周知,病理学检测是反应肾脏损害程度的客观依据。因此,本研究以形态学分级为基础,对新生鼠肾积水病肾组织中的TGF-β1蛋白表达量进行研究,以便证明TGF-β1蛋白表达量能够反映病肾的损害程度。有学者报导[7],应用免疫组织化学方法,可检测到正常人肾脏的系膜、肾小管及肾小球基底膜的TGF-β1蛋白阳性表达。而另有研究表明[8],在正常人肾小管中未检测到TGF-β1蛋白的阳性表达,在肾小球球囊、系膜及内皮细胞可发现TGF-β1蛋白的弱阳性表达。本研究结果提示,在新生鼠积水肾脏内,TGF-β1的阳性表达主要位于近曲小管内皮细胞的胞浆内,而在肾小球及肾间质内未发现。TGF-β1的蛋白表达量随输尿管梗阻解除时间的延长而逐渐下降,梗阻解除后12周,其表达量已降至正常。同时,病肾组织中的TGF-β1蛋白表达量与病理检查分级成正相关,差异有统计学意义(r=0.873,P<0.01),提示病肾组织中TGF-β1的蛋白表达可用于病肾恢复情况的判定。
MCP-1是一种在肾损伤和炎症部位表达的特异性区化因子,在肾小球肾炎、肾小管间质性病变的发病机制中起关键作用,并能够通过多种途径导致病肾不同程度的损害[9]。有研究表明[10],肾积水病肾组织内充满了大量具有免疫活性的单核-巨噬细胞,通过特异性趋化因子MCP-1而被激活,肾小管上皮细胞可大量分泌MCP-1,成为其主要来源的细胞之一[11]。肾脏疾病中MCP-1的蛋白表达量的升高能增强多种细胞因子和黏附分子的表达与合成,诱导炎性介质释放(如NF-α、IL-1等)导致肾间质损伤。动物实验研究证实,MCP-1可作为一种重要的炎症介质参与肾积水的发生机制,MCP-1及其受体可能通过诱导调节成纤维细胞而起到关键性作用,且与病肾损害程度明显相关[12]。本研究应用免疫组织化学方法检测新生鼠积水肾脏组织中MCP-1的蛋白表达,实验结果提示,病肾组织MCP-1的蛋白表达仅能部分反映病肾的损害及恢复程度,提示MCP-1可能参与了肾积水的发病。目前,关于MCP-1是如何参与先天性肾积水病肾损害的机制尚不十分清楚,但以此为依据,将为肾积水的发病机制研究提供新的思路。
ET主要有A型(ETA)和B型(ETB)两种受体。ET-1主要由心血管组织合成,脑和肾脏也可产生ET-1,其中,肾小球毛细血管丛集合系统是肾脏合成ET-1的主要部位。因此,ET-1与肾脏疾病的发生有密切关系[13]。肾脏的肾小球内皮细胞、上皮细胞、系膜细胞和肾小管上皮细胞均能合成内皮素,内皮素是目前已知的体内收缩血管作用最强和最持久的缩血管物质[14]。ET-1可使肾动脉收缩,减少肾小球滤过面积,使肾小球滤过率及肾血流量降低。动物实验表明,ET-1在许多肾脏疾病中呈高表达,大鼠一侧输尿管完全梗阻后,随梗阻时间的延长,梗阻侧肾盂尿中ET-1的蛋白含量较对侧增加1/2至数倍,而梗阻侧肾脏组织ET-1的含量较对照组亦显著增加[15]。梗阻性肾积水动物模型证实,ET-1在肾静脉血流中的表达较肾动脉血流中高,而生理状态下ET-1的浓度极低,提示升高的ET-1是由肾脏产生的[16]。由此可见,肾脏本身就存在ET系统,很多肾脏病的病理生理过程是由肾脏局部的ET介导。马洪等[17]研究证明了肾积水患儿的病肾尿ET-1蛋白水平升高,提示肾盂尿ET-1可反映病肾的损害。因此,本研究应用免疫组化法检测了肾积水病肾组织的ET-1蛋白表达情况。研究结果提示,病肾组织中ET-1的蛋白表达随病理学分级的增加而升高,但Ⅰ、Ⅱ级的ET-1蛋白表达量比较,差异无统计学意义(P>0.05),Ⅲ、Ⅳ级的ET-1蛋白表達量高于Ⅱ级,差异有统计学意义(P<0.05),提示ET-l的蛋白表达情况仅能反映部分病肾的损害程度。该研究结果与Grosjean等[18]的研究结果相一致。
IGF是一种与胰岛素结构类似的广谱促生长因子,包括IGF-1和IGF-2。IGF-1是由70个氨基酸构成的单链多肽,主要由肝脏合成,几乎存在于哺乳动物的所有组织中,是人体重要的生长因子和促有丝分裂原,对正常新陈代谢的维持起着非常重要的作用。肾小管及肾小球中均有IGF-1的蛋白受体表达,IGF-1的蛋白表达与功能紊乱、肾间质纤维化关系密切[19]。研究[20]发现,IGF-1参与了肾单位损伤的康复过程,在慢性肾衰竭的治疗中可加快肾脏的功能恢复。另有学者研究[21]发现,IGF-1通过提高肾血流量和肾小球滤过率来上调肾单位的血流动力学,从而减轻积水肾脏的肾小管囊性变及肾盏扩张,最终缓解肾脏纤维化。本研究结果提示,模型组Ⅱ、Ⅲ、Ⅳ级新生鼠的IGF-1蛋白表达量低于Ⅰ级,模型组Ⅳ级新生鼠的IGF-1蛋白表达量低于Ⅲ级,差异均有统计学意义(P<0.05);模型组Ⅱ级新生鼠的IGF-1蛋白表达量与Ⅲ级比较,差异无统计学意义(P>0.05)。肾积水病肾组织中IGF-1的蛋白表达量较假手术组降低,且随病理学分级的增加而降低,提示IGF-1可能参与了肾积水的发病机制,病肾组织IGF-1的蛋白表达情况不能完全反映病肾的损害程度,IGF-1尚不能作为病肾功能检测的理想指标。
综上所述,本研究通过建立新生鼠肾积水动物模型,检测不同时期病肾组织各指标的蛋白表达情况,并与病理学分级做相关性分析。提示,TGF-β1的蛋白表达情况可用于判定新生鼠肾积水病肾的损害程度以及恢复情况。但是,尽管本实验成功地采用新生鼠建立了梗阻性肾积水动物模型,在一定程度上模拟了人类肾积水的发病过程,但是,人的肾积水发病是一个极为复杂、漫长的慢性肾功能损害过程,上述指标检测能否应用于临床,还需要深入的研究。
[参考文献]
[1]Oliveira EA,Oliveira MC,Mak RH.Evaluation and management of hydronephrosis in the neonate[J].Curr Opin Pediatr,2016,28(2):195-201.
[2]Li X,Liu X,Li J,et al.Semaphorin-3A and Netrin-1 predict the development of kidney injury in children with congenital hydronephrosis[J].Scand J Clin Lab Invest,2018,78(1-2):55-61.
[3]田文超,马洪,杨俊杰,等. 新生鼠部分输尿管梗阻建立及梗阻解除的动物模型制作[J].贵州医药,2010,34(1):7-10.
[4]Meyrier A,Niaudet P.Acute kidney injury complicating nephrotic syndrome of minimal change disease[J].Kidney Int,2018,94(5):861-869.
[5]Li H,Cai H,Deng J,et al.TGF-β-mediated upregulation of Sox9 in fibroblast promotes renal fibrosis[J].Biochim Biophys Acta Mol Basis Dis,2018,1864(2):520-532.
[6]Sureshbabu A,Muhsin SA,Choi ME.TGF-β signaling in the kidney:profibrotic and protective effects[J].Ain J Physilo Renal Physiol,2016,310(7):596-606.
[7]Meng XM,Lan HY.Transforming growth factor-β and renal fibrosis[J].Sheng Li Xue Bao,2018,70(6):612-622.
[8]Chang WC,Lin SL,Chen YM,et al.Urinary kallikrein excretion is related to renal function change and inflammatory status in chronic kidney disease patients receiving angiotensin Ⅱ receptor blocker treatment[J].Nephrology,2008,13(3):198-203.
[9]Bianconi V,Sahebkar A,Atkin SL,et al.The regulation and importance of monocyte chemoattractant protein-1[J].Curr Opin Hematol,2018,25(1):44-51.
[10]Cassini MF,Kakade VR,Kurtz E,et al.Mcp1 Promotes Macrophage-Dependent Cyst Expansion in Autosomal Dominant Polycystic Kidney Disease[J].J Am Soc Nephrol,2018, 29(10):2471-2481.
[11]J■nsson N,Erlandsson E,Gunnarsson L,et al.Monocyte chemoattractant protein-1 in antineutrophil cytoplasmic autoantibody-associated vasculitis:biomarker potential and association with polymorphisms in the MCP-1 and the CC chemokine receptor-2 gene[J].Mediat Inflamm,2018(2018):1-11.
[12]Kirby NA,Stepanek AM,Vernet A,et al.Urinary MCP1 and Microalbumin increase prior to onset of Azotemia in mice with polycystic kidney disease[J].Comp Med,2014,64(2):99-105.
[13]Barton M,Sorokin A.Endothelin and the glomerulus in chronic kidney disease[J].Semin Nephrol,2015,35(2):156-167.
[14]Ahmed M,Rghigh A.Polymorphism in endothelin-1 gene:an overview[J].Curr Clin Pharmacol,2016,11(3):191-210.
[15]De Miguel C1,Speed JS,Kasztan M,et al.Endothelin-1 and the kidney:new perspectives and recent findings[J].Curr Opin Nephrol Hypertens,2016,25(1):35-41.
[16]Dy GW,Ellison JS,Fu BC,et al.Variable resource utilization in the prenatal and postnatal management of isolated hydronephrosis[J].Urology,2017,108:155-160.
[17]馬洪,李旭良,方勇,等.小儿肾积水尿细胞因子IGF-1、ET-1、TGF-β1及MCP-1水平的检测及意义[J].中华小儿外科杂志,2009,30(9):600-603.
[18]Grosjean F,De Amici M,Klersy C,et al.High preoperative plasma endothelin-1 levels are associated with increased acute kidney injury risk after pulmonary endarterectomy[J].J Nephrol,2018,31(6):881-888.
[19]He H,Xiong Y,Li B,et al.Intrauterine programming of the glucocorticoid-insulin-like growth factor1(GC-IGF1) axis mediates glomerulosclerosis in female adult offspring rats induced by prenatal ethanol exposure[J].Toxicol Lett,2019, 311:17-26.
[20]Gu LJ,Zhang YY,Wang L,et al.Changes of insulin-like growth factor 1 axis in chronic kidney disease and its role in skeletal muscle atrophy[J].Zhonghua Yi Xue Za Zhi,2018,98(10):749-754.
[21]Li J,Dong R,Yu J,et al.Inhibitor of IGF1 receptor alleviates the inflammation process in the diabetic kidney mouse model without activating sOcs2[J].Drug Des Devel Ther,2018,12:2887-2896.
(收稿日期:2019-02-12 本文编辑:孟庆卿)
