水中典型光敏剂引发金雀异黄酮三线态敏化光降解机理
2019-11-12杨晨张思玉雷蕾韩雅琦孔宇张雪娇赵青李海波李英华
杨晨,张思玉,雷蕾,3,韩雅琦,3,孔宇,张雪娇,赵青,李海波,李英华,*
1. 东北大学资源与土木工程学院,沈阳 110004 2. 中国科学院沈阳应用生态研究所,沈阳 110016 3. 中国科学院大学,北京 100049
目前水环境中检出的有机污染物高达数千种,且数量仍在不断增加[1-2]。其中,酚类化合物被中国[3]及美国环保局(EPA)列为优先控制的有机污染物[4]。环境中的酚类污染物对人体健康和生态安全构成较大威胁,因此有必要了解其环境转化行为及归趋。金雀异黄酮(genistein, Gs)作为一种多羟基酚类豆科植物雌激素,是一种环境内分泌干扰物(EDCs)[5],对水生生物有一定危害,可能威胁生态系统安全。研究发现,大豆加工废水中Gs浓度为4.8~151 μg·L-1,其他豆科植物加工废水中Gs也高达10.5 μg·L-1[6-7]。Gs在地表水中也被频繁检出,瑞士牧场和爱德华市大豆玉米田的溪流排水中,Gs浓度为6.4~41 ng·L-1[8-9]。日本城市溪流中Gs的浓度高达143.4 μg·L-1[10]。

DOM广泛存在于水体中,是影响有机污染物水环境光化学行为的重要活性物质[13]。酚类有机污染物被3DOM*敏化光降解的研究屡见不鲜。Warren等[15]、Yamaji等[16]研究发现酚类污染物通过质子耦合电子转移机理被敏化光降解;孙国新等[17]发现DOM敏化四溴双酚A光降解受水中Cl-和Br-影响。酚类污染物受水体pH值的影响可能会出现多种解离形态。张燕等[18]研究发现酚类直接光解速率受解离形态差异影响。但3DOM*对酚类污染物不同解离形态的敏化活性差异及敏化机制还未可知。
由于DOM组成较为复杂,前人研究中通常选取亚甲基蓝(MB)或芳香酮等[19-20]小分子敏化剂(Sens)模拟3DOM*的敏化作用。因此,本研究以Gs为研究对象[9],以MB、3-甲氧基苯乙酮(3-MAP)、2-萘乙酮(2-AN)和2-苯甲酮(BP)模拟DOM引发敏化光降解,通过考察4种Sens引发Gs间接光降解的活性差异,阐释Gs间接光降解速率与Sens性质的关系;通过考察pH值对Gs间接光降解表观速率常数的影响,阐明不同解离形态Gs发生敏化光降解的活性差异。结合密度泛函理论(DFT)计算[21],阐明不同解离形态Gs的敏化光降解机理。
1 材料与方法(Materials and methods)
1.1 实验试剂
3-MAP(纯度≥98%)购于麦克林试剂公司;MB(纯度≥98%)、2-AN(纯度≥99%)购于北京百灵威科技有限公司;BP(纯度≥98%)购于上海阿拉丁有限公司;Gs(纯度≥98%)购于梯希爱(上海)化成工业发展有限公司;甲醇(色谱纯,纯度≥99.9%)购于Sigma-Aldrich公司;氢氧化钠、高氯酸和高氯酸钠等为分析纯。
1.2 实验方案
光降解实验装置为南京胥江XPA-7型光化学反应仪,以350 W的氙灯作为实验光源,通过低温恒温槽(YRDC-2020,上海亚荣生化仪器厂)控制反应仪器内温度约为18 ℃。Gs分子结构中存在3个可解离的酚羟基,解离常数依次为pKa1= 7.2、pKa2= 10、pKa3= 13.1[22-23],对应4种解离形态(图1a):中性分子(Gs0)、一价阴离子(Gs-H)、二价阴离子(Gs-2H)和三价阴离子(Gs-3H)。有研究表明,溶液离子强度影响3DOM*敏化有机污染物间接光降解反应[24],因此,实验中以氢氧化钠、高氯酸调节反应溶液的pH值,并通过加入高氯酸钠,使溶液总离子强度为0.1 mol·L-1。
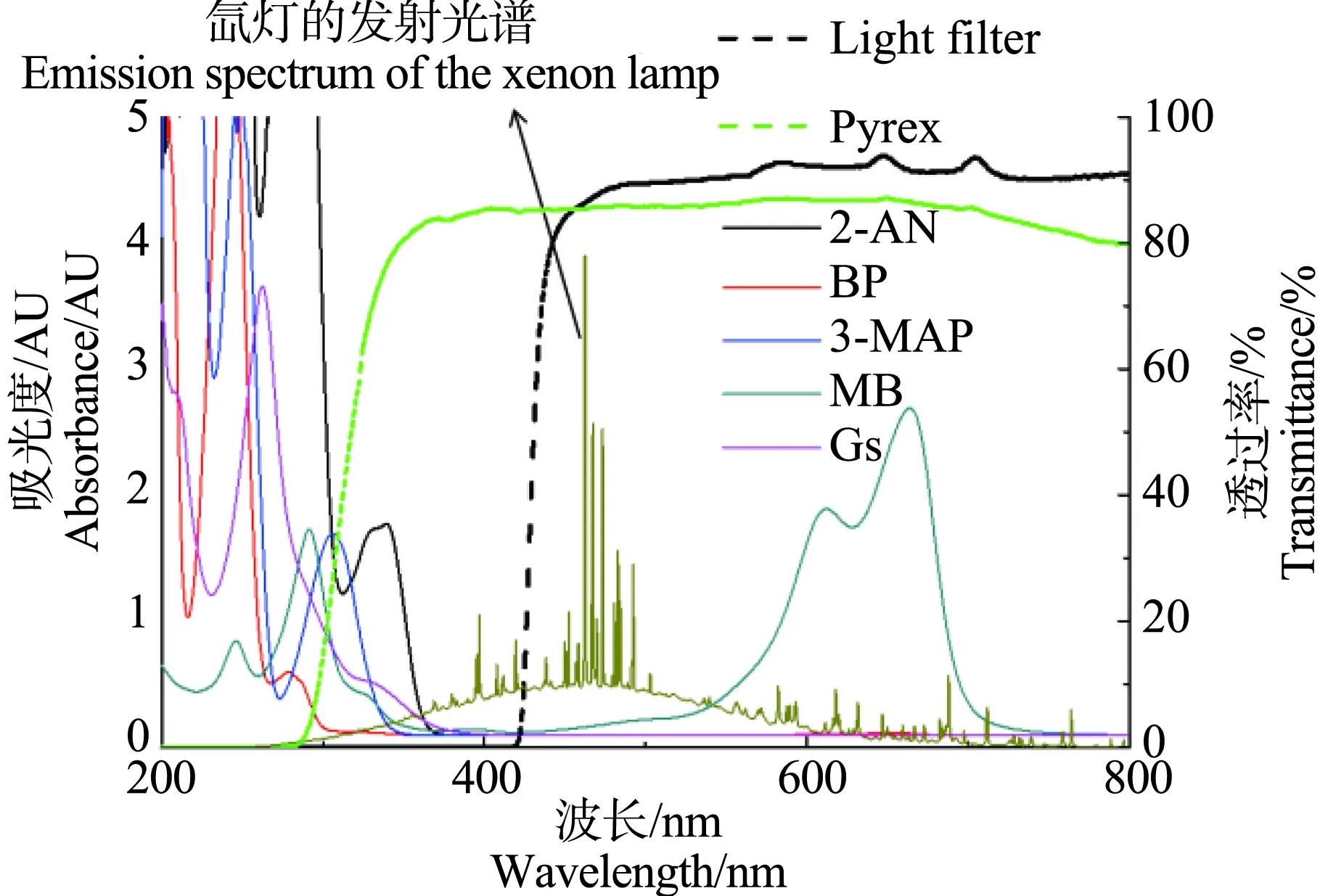
取Gs和Sens溶液配制初始浓度各为5 μmol·L-1的光解反应液,水浴超声20 min使其混合均匀。取50 mL反应液,置于Pyrex玻璃试管中,在350 W氙灯(到达反应溶液的光强约为500 W·m-2)照射下进行光降解反应。Pyrex玻璃用于滤去λ<290 nm的紫外光(图2),以模拟太阳光光谱中λ>290 nm的紫外、可见光。以MB作Sens的实验中,使用滤光片去除λ<420 nm的紫外光(图2),避免MB快速直接光解,导致反应过程中Sens浓度显著变化。光解反应液中加入10%的甲醇消除羟基自由基(HO·)[25]的干扰。光照实验每组重复3次。暗反应实验中,发现Gs几乎不降解。

图1 金雀异黄酮(Gs)的4种解离形态(a)及其随pH值的分布(b)Fig. 1 Four dissociation species of genistein (Gs) and their distribution varied with pH
1.3 分析测试方法
使用UV-2700型紫外分光光度计(岛津公司,日本)测定吸光度和透光率。使用高效液相色谱仪(安捷伦,美国)分析Gs浓度。具体分析条件为:色谱柱使用Agilent Wonda Sil C18 (150 mm × 4.6 mm, 5 μm);流动相为甲醇和0.1%的醋酸水溶液(V∶V = 60∶40),流速1 mL·min-1;紫外检测波长为259 nm;色谱柱温度为25 ℃;进样量为10 μL。通过一级反应动力学方程(1)拟合得到Gs的表观光降解速率常数(kin, min-1):
(1)
式中:ct为t时刻Gs的浓度(μmol·L-1);c0为Gs初始浓度(μmol·L-1);t为光解反应时间(min)。
1.4 计算方法
Sens敏化有机物的主要机理为能量转移[26-27]或电子转移[28],使污染物分子转化为激发三线态或自由基等活性中间物种,进而发生光降解。使用DFT计算Gs的激发能(ET)、垂直电离能(VIE)、垂直电子亲和势(VEA)等参数,以判断反应能否自发进行。其中,MB在水中电离,以带正电的显色基团(MB+)形式存在[19]。因此,计算中考虑MB+的光敏化能力。其余3种Sens均计算分子形态的敏化能力。分别根据式(2)和(3)的VIE和VEA,以评价电子得失能力:
VIE(Gs) = E(Gs+·)-ET(Gs)
(2)
VEA(Gs) = E(Gs-·)-ET(Gs)
(3)
式中:E(Gs)、E(Gs+·)和E(Gs-·)为Gs、其失去一个e和得到一个e后的能量。
通过式(4)和(5)计算Sens激发三线态(3Sens* )的VIE(3Sens* )和VEA(3Sens* ):
VIE(3Sens* ) = E(Sens+·)-E(Sens)-E(3Sens* )
(4)
VEA(3Sens* ) = E(Sens-·)-E(Sens)-E(3Sens* )
(5)
式中:E(Sens)、E(Sens+·)和E(Sens-·)为Sens及其失去一个e和得到一个e后的能量;ET(3Sens* )为Sens激发三线态的垂直跃迁能。
根据式(6)~(8)判断T1态Sens与Gs的光致能量或电子转移反应能否自发进行:
3Sens* + Gs → Sens +3Gs*
ET1(3Sens* ) > ET1(3Gs* )
(6)
3Sens* + Gs → Sens-·+ Gs+·
△G1= VEA(3Sens* ) + VIE(Gs)
(7)
3Sens* + Gs → Sens+·+ Gs-·
△G2= VEA(Gs) + VIE(3Sens* )
(8)
式中:3Gs* 为Gs第一激发三线态;ET1(3Sens* ) > ET1(Gs)表示3Sens* 到Gs的能量转移可以发生;△G为电子转移反应的吉布斯自由能,△G < 0说明电子转移反应可自发进行[29]。
使用DFT方法[30]和B3LYP泛函,在6-31+g(d,p)水平进行结构优化和频率分析,优化得到稳定结构,通过频率分析确定没有虚频。使用B3LYP泛函和6-311++g(2df,3p)基组进行能量计算。以上计算中,均通过基于自洽反应场(SCRF)的极性连续介质模型(IEFPCM)[31]考虑溶剂水的影响。所有计算使用高斯09软件[32]进行。
2 结果(Results)
2.1 Sens性质对Gs光敏化降解的影响
无敏化剂光照实验表明,pH为3或9时,Gs不能直接光解;当pH为12时,Gs的直接光解速率为(2.0±0.1)×10-4min-1,占总降解速率的4.7%~33%。在pH 3时,4种Sens均不能敏化Gs。在pH 9、MB+或2-AN存在时,Gs发生光降解,其中2-AN敏化Gs光降解的速率仅为MB+敏化光降解的1/47 (表1)。在pH 12时,扣除直接光解影响后,4种Sens均能敏化Gs发生间接光降解,其kin的顺序为:kin(BP) = 4/7kin(3-MAP) = 1/10kin(2-AN) = 2/495kin(MB+)。与pH 9相比,Gs在pH 12时的敏化光降解明显加快,对于MB+和2-AN,kin分别增加10.5倍和20倍。
2.2 pH值对Gs光敏化降解的影响
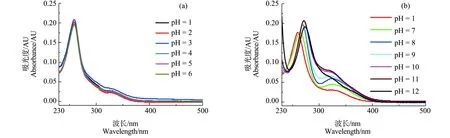
以MB+为例,发现Gs的光敏化降解随pH (1~12)升高而加快(图3)。当pH>5时,Gs的敏化光降解符合准一级反应动力学,且光降解速率随pH升高而增大;当pH≤5时,Gs的降解可忽略(图3)。当5 当pH为1~6时,Gs的最大吸收峰位置(260 nm)几乎无变化;pH为7时,最大吸收波长红移4 nm;pH>7时,最大吸收波长继续红移且吸收增强;pH增至12时,最大吸收波长红移增至14 nm (图4)。这与Gs解离形态随pH变化趋势(图1)基本一致:当pH<6时,94%以上的Gs为分子形态(Gs0),随着pH升高,Gs的3个酚羟基依次失去氢质子(图1a),生成Gs-H、Gs-2H和Gs-3H,最大吸收峰依次发生红移。 4种Sens中,BP的ET值最高,其次为3-MAP和2-AN,MB+的ET值最低;激发态得电子能力(VEAT1)的顺序为:3-MAP > MB+> 2-AN > BP;失电子能力顺序(VIET1)为:BP > 3-MAP > 2-AN > MB+(表2)。Gs各解离形态的激发能介于2.50~2.98 eV。Gs的VEA值随解离程度升高而增大,说明得电子能力逐渐减弱;VIE值变化则相反,说明失电子能力逐渐增强。 根据公式(6),BP或3-MAP的激发能高于Gs各解离形态的激发能,可通过能量转移敏化各种解离形态的Gs;MB+或2-AN的激发能低于Gs各解离形态的激发能,不能通过能量转移敏化各种解离形态的Gs。4种敏化剂均可与Gs-2H或Gs-3H发生电子转移敏化反应(△G1<0);敏化剂激发态失电子反应的△G2>0,不能自发进行(图5)。 表1 Gs光敏化降解速率常数(kin)Table 1 Apparent rate constants of the photosensitized degradation (kin) of Gs 注:a, kobs< 1.0×10-4min-1。 Note: a, kobs< 1.0×10-4min-1. 图2 Gs和4种小分子敏化剂(Sens)的紫外-可见吸收光谱、氙灯发射光谱及Pyrex玻璃、滤光片(Light filter)的透过率注: 2-AN为2-萘乙酮,BP为苯甲酮,3-MAP为3-甲氧基苯乙酮,MB为亚甲基蓝。Fig. 2 UV-vis absorption of Gs and the four triplet sensitizers and transmittance of Pyrex tube, emission spectrum of the xenon lamp and light filterNote: 2-AN represents 2-acetonaphthone; BP represents benzophenone; 3-MAP represents 3-methoxyacetophenone; M represents methylene blue. 图3 MB敏化Gs间接光降解动力学Fig. 3 Indirect photodegradation kinetics of Gs sensitized by MB 不同pH值条件下,4种Sens敏化Gs的kin值均随pH升高而增大,与Suwannee河富里酸或Pony湖富里酸敏化Gs、生物素A和雌马酚光降解的速率随着pH (7、8、10)升高而增大有相同趋势[33]。导致kin随pH变化的主要原因是Gs在不同pH值条件下解离形态分布不同。Gs的酚羟基在碱性条件下脱质子形成氧负离子,与质子化形态的酚羟基相比,氧负离子具有更强的给电子共轭效应[34],苯环电子云密度增大,更易给电子。DFT计算结果也显示,Gs失电子能力随解离程度增大逐渐增强。 图4 Gs的紫外-可见吸收光谱Fig. 4 UV-visible absorption spectra of Gs 图5 3Sens*与Gs电子转移反应的吉布斯自由能(△G1、△G2)Fig. 5 Gibbs free energy (△G1, △G2) of the electron transfer reaction between 3Sens* and Gs 表2 Gs和Sens的三线态跃迁能(ET)、垂直电离能(VIE)和垂直电子亲和力(VEA)的计算值Table 2 Calculated triplet state excitation energy (ET), vertical ionization energy (VIE), and vertical electron affinity (VEA) of Gs and Sens MB+敏化实验结果(图3)进一步证明了Gs阴离子形态比分子态更易发生光敏化反应,且解离程度加深,敏化光解活性增强。当pH为1~5时,Gs0>99% (图1),紫外-可见吸收峰无显著位移(图4),几乎不发生敏化光降解(图3);pH由6升至8时,Gs-H由1%增至86% (图1),紫外-可见最大吸收峰亦相应发生位移(图4),然Gs-H发生敏化反应的能力弱(表2,图5),Gs-2H虽易被敏化发生光降解,然pH为6~8时,该形态所占比例<1%,因此kin增加缓慢;pH>8后,Gs-2H比例迅速增加,且存在敏化反应活性更高的Gs-3H (图1),因此kin迅速增加至百倍。 敏化剂性质亦是Gs敏化光降解的主要因素。BP或3-MAP与Gs-2H或Gs-3H既能发生能量转移反应也能发生电子转移敏化反应。尽管如此,仅当pH 12、Gs-2H的比例为92%的情况下,Gs被BP和3-MAP敏化的效率才略有升高(表1)。这是因为BP和3-MAP的最大吸收峰与模拟太阳光光谱(λ>290 nm)重叠较少(图2),产生激发单线态进而系间窜跃形成激发三线态的产率低,且溶解氧与Gs竞争[35],进一步降低了2种Sens敏化Gs光降解的效率。相反,MB+或2-AN虽然仅能与Gs-2H或Gs-3H发生光致电子转移反应,但kin相对较高。因此2种Sens能吸收较多的模拟太阳光,激发态产率高,敏化效率高于BP或3-MAP。MB+比2-AN敏化光降解Gs具有更高的效率,主要因为Gs阴离子更易发生敏化光降解反应,而MB+或其激发三线态带正电,易与Gs阴离子发生电荷相互作用,有利于激发态电子转移反应。 综上,本研究通过光化学实验和DFT计算,阐明了三线态光敏剂性质及pH值对以Gs为例的多羟基可解离酚类污染物敏化光降解的影响机理,为深入探讨化学组成复杂的DOM的光化学活性及评价酚类污染物的环境光化学行为奠定了理论基础。因Gs敏化光降解活性及反应途径与pH值、DOM组分性质有关,因此有必要研究不同pH值、不同来源DOM敏化Gs间接光降解的过程产物或终产物,为判断降解产物的内分泌干扰等负面效应提供依据,有助于Gs在水环境中生态风险的评价。 致谢:感谢国家自然科学基金(21607165, 41603120, 41703107, 418773891, 41571455, 51578115),“十三五”国家重点研发计划“农田和农产品重金属源解析与污染特征研究”(2016YFD0800305),沈阳市中青年科技创新人才团队支持计划(RC170020)及中国科学院青年创新促进会项目(2017242)资助。感谢中国科学院超级计算中心提供计算资源。2.3 Gs与Sens的光致能量、电子转移反应计算


3 讨论(Discussion)