小檗碱和miRNA-18b对猪IVF胚胎HIF-1α的调控作用
2019-11-04王俊丽戴佳格张紫薇高建明
王俊丽,刘 兵,张 超,戴佳格,张紫薇,于 博,高建明*
(1.北京农学院 动物科学技术学院,北京 102206;2.中国农业大学 动物科学院,北京 100193)
在哺乳动物中,体外培养的附植前胚胎在化学成分确定的培养基中, 大部分胚胎不能发育到囊胚阶段,而是停留在一定的发育阶段,这种现象称为体外胚胎发育阻滞[1]。不同动物的早期胚胎发育阻滞的时间是不同的, 例如, 小鼠发生在2-细胞时期[2],猪在4-细胞时期[3],牛、绵羊和山羊均在8-~16-细胞时期[4], 人在4-~8-细胞时期[5]。人类体外培养的胚胎在第一周内有50%停止发育[6],优质囊胚形成率为30%左右[7]。牛体外培养囊胚发育率一般为45.29%左右[8],猪体外受精(InVitroFertilization, IVF)囊胚发育率平均为14.5%~19.93%[9-16]。可见,附植前胚胎发育停滞极大的阻碍了人类辅助生殖和畜牧生产的发展。因此,阐明附植前胚胎体外发育阻滞的机制十分重要,但相关机制至今仍不十分清楚。
小鼠胚胎中microRNA(miRNA)参与了母型基因向合子型基因组过渡(maternal to zygote transition,MZT)的过程[17]。miRNA也在猪配子发生和胚胎发育过程中调控mRNA的表达[18]。Ohnishi等报道miRNA的差异表达、合成是小鼠附植前胚胎的发育动力,miRNA在附植前胚胎中起重要作用[19]。Zhang等发现miRNA-21低表达剂处理后的囊胚发育率和细胞数量均降低,而凋亡细胞数增加;miRNA-21低表达显著降低了Bcl-2转录水平,显著增加了caspase-3和PTEN转录水平,此研究揭示了miRNA-21对于附植前胚胎发育非常重要,降低miRNA-21表达会引起小鼠胚胎细胞凋亡和抑制生长[20]。小檗碱(berberine, Ber)对猪体外受精IVF胚胎发育的效果及其miRNA的差异表达分析的研究证明,Ber可能主要是通过调控8-细胞中miRNA的表达,对猪IVF胚胎发育起作用,其中miRNA-18b下调最明显[21]。研究表明,恶性黑色素瘤中miRNA-18b通过调节其靶基因缺氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)来抑制细胞增殖[22]。HIF是螺旋-环-螺旋PAS蛋白家族的成员。HIF是各种细胞中急性和慢性缺氧时转录和代谢反应必需的介质[23]。低水平的氧中,HIF-1α被激活并与组成型表达的HIF-1β二聚化,并且该复合物和靶基因启动子中的顺式作用缺氧反应元件结合,最终调节涉及氧的许多细胞活动态[24]。HIF-1α和胚胎发育有着密切的联系。有研究表明,HIF-1α的表达在猪附植前胚胎代谢的调节中具有重要作用,并且低氧张力使猪胚胎囊胚率增加,促进胚胎的发育[25]。然而,有关Ber和miRNA-18b对猪IVF胚胎细胞中HIF-1α的作用尚不清楚。因此,本试验在前期研究基础上,在猪IVF原核胚中显微注射过/低表达miRNA-18b,探明miRNA-18b和HIF-1α之间的关系,阐明miRNA-18b对猪IVF胚胎发育的作用,并通过向体外培养液中添加Ber,探讨其提高猪IVF胚胎发育质量的可能途径。
1 材料方法
1.1 猪体外受精胚胎的获得和体外培养
从北京第五肉联厂采集新鲜的猪卵巢,放入35 ℃含双抗的生理盐水中,1 h内运回实验室。北京近郊种猪场获取新鲜长白猪精液,控温18 ℃左右1 h内运回实验室。按前文[21]方法进行卵母细胞体外成熟和IVF。将IVF 6 h的受精卵用添加0.4% BSA的NCSU-23胚胎基础培养液清洗3遍,然后按试验进行分组处理,之后分别移入39 ℃、5%CO2、95%空气、100%相对湿度的CO2培养箱中平衡4 h的NCSU-23培养液的50 μL液滴中,每滴15~20枚,进行体外培养(InVitroCulture, IVC)。分别于培养48、72、96、120、168 h 观察其2-、4-、8-细胞和桑椹胚、囊胚率,间隔48 h换液。本研究中使用的化学试剂除非另有说明均购置于Sigma公司(美国)。
组别:NCSU-23胚胎基础培养液为对照组,将Ber(0.1 μg/mL,纯度≥ 99.97%,中国药品生物制品检定所)[21,26]加入NCSU-23培养液中为Ber组。将100 nmol/L miRNA-18b agomir、miRNA-18b antagomir和阴性片段分别显微注射入IVC 18~24 h后的对照组原核胚细胞质中,注射量为10 pL,分别为miRNA-18b agomir组、miRNA-18b antagomir组和NC组。
1.2 qRT-PCR检测胚胎HIF-1α基因转录水平
分别将各组别收集的4-细胞、8-细胞、桑椹胚期的胚胎(各时期每组100枚)于1.5 mL离心管中,按照RNA提取试剂盒(CWbio.Co.Ltd)说明提取总RNA,按照PCR试剂盒(CWbio.Co.Ltd)操作说明进行反转录和Real-time PCR。取12 μL RNA样本,依次加入5×Buffer 4 μL,10×Reverse Transcriptase Mix 2 μL,制备20 μL反转录反应体系,混合均匀,37 ℃孵育60 min,95 ℃孵育5 min,反转录产物于-20 ℃保存。反应在STRATA GENE荧光实时定量分析系统中按照miScript PCR Starter Kit试剂盒(CWbio.Co.Ltd)操作说明进行。GAPDH为HIF-1α的内参基因。PCR反应条件为:95 ℃预变性2 min;95 ℃变性15 s,退火20 s,72 ℃延伸30 s,共45个循环。采用2-△△CT法进行基因的相对定量。试验重复3次。

表1 目的基因引物及qRT-PCR反应条件参数Tab.1 Primers and qRT-PCR conditions for target genes
1.3 Western-blot检测
分别将各组别收集的4-细胞、8-细胞、桑椹胚(各时期每组300枚)与包含蛋白酶抑制剂和磷酸酶抑制剂的缓冲液混合,4 ℃静置30 min,每隔1 min敲打混匀,之后向其中加入加样缓冲液,沸水加热5 min,冷却并置于-80 ℃中保存。蛋白在聚丙烯酰胺凝胶电泳液中进行分离,使用5%积层凝胶在80 V下20 min,12%分离凝胶在120 V下2 h。电转移用硝酸纤维素膜在 300 mA下30 min,1%BSA,5%的脱脂奶粉(BD Biosciences, China)封闭(室温2 h)后,分别加入内参β-actin(ZSGB-BIO ,Beijing,China)和目的基因HIF-1α的一抗稀释液4 ℃过夜(1∶1 000稀释,abcam),TBST清洗后,二抗(1∶5 000)孵育50 min,TBST清洗。将PVDF膜浸泡于ECL显色液中1 min,暗室中曝光、显影并定影。采用Quantity One v.4.6.2软件进行读取条带灰度值。试验重复3次。
1.4 双荧光素酶报告基因检测
将预测含有miRNA-18b结合位点的HIF-1α 的野生型(wt)、突变型(mut)目的基因克隆到pmirGlo载体(LP0041,OXOID, USA)中(ssc-miRNA-18b和HIF-1α的3’UTR序列比对及可能结合位点请见图2-A),然后,将5 ng每种pmirGlo重构载体分别与ssc-miR-18b agomir和阴性对照(NC)加到24孔板的HEK293T细胞中,每孔加入2 μL Lipofectamine 2000(11668-019,Invitrogen, USA)进行转染,在 37 ℃,5%二氧化碳培养箱中温育5 h。吸弃转染液并加入含 10% FBS的完全培养液,37 ℃ 5% CO2继续培养,于24 h、48 h按双荧光素酶检测试剂盒(E1910 ,Promega,USA)方法进行细胞收样。采用双荧光素酶报告系统测量萤火虫荧光素酶活性和海肾荧光素酶活性。
应用SPSS17.0统计软件的单向方差分析和SNK多重比较法对数据进行分析和差异显著性比较。结果以平均值±标准差表示,P<0.05 表示差异显著,P<0.01表示差异极显著,P>0.05表示无显著差异。
2 结 果
2.1 Ber和miRNA-18b 对猪IVF胚胎细胞发育的作用
由表2可见,各胚胎发育时期,Ber组极显著高于其他各组(P<0.01);miRNA-18b antagomir组和对照组极显著高于NC组和miRNA-18b agomir组(P<0.01),而二者之间无显著差异(P>0.05);miRNA-18b agomir极显著低于NC组(P<0.01)。
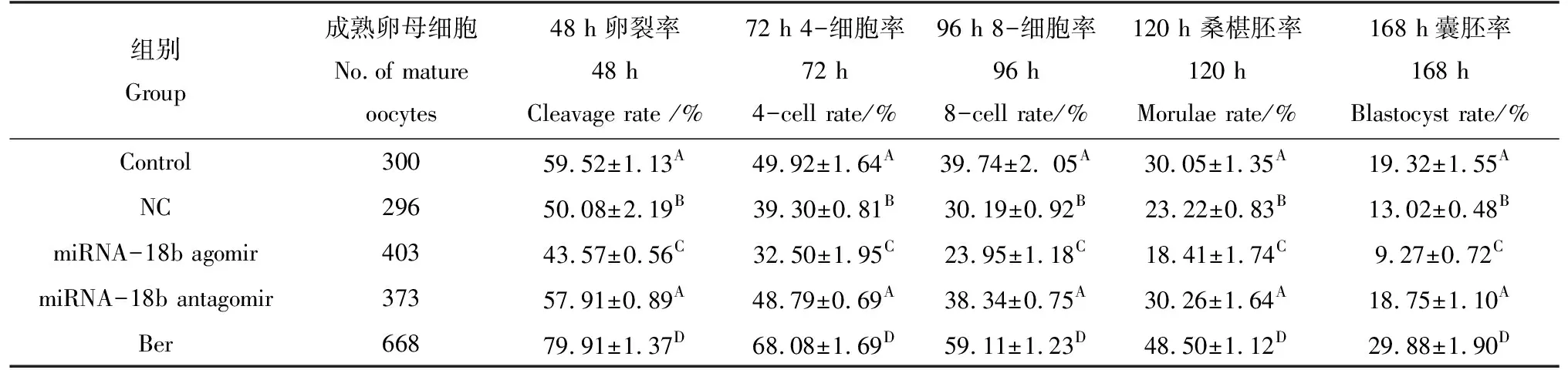
表2 Ber和miRNA -18b对猪IVF胚胎体外发育效果Tab.2 Effects of Ber and miRNA-18bon in vitro development of porcine IVF embryos
注:同一竖栏肩著不同大写字母之间表示差异极显著(P<0.01),相同字母之间表示差异不显著(P>0.05)
Note:The values in the same column with different uppercase letters represent significant differences ofP<0.01, the same letters represent no significant difference (P>0.05)
2.2 猪IVF胚胎miRNA-18b靶基因的验证
2.2.1 Ber和miRNA-18b的过/低表达对HIF-1α表达水平的影响 由图1-A可知,在HIF-1α基因转录水平上,4-、8-细胞和桑椹胚期,Ber组均显著高于其他各组(P<0.05),miRNA-18b antagomir组均与对照组和NC组无差异(P>0.05);在4-细胞时期,miRNA-18b agomir组与miRNA-18b antagomir组和NC组无显著差异;在8-细胞和桑椹胚2个时期,miRNA-18b agomir组均显著低于miRNA-18b antagomir和NC组(P<0.05)。

A:HIF-1α的转录水平;B、C: HIF-1α的翻译水平A: Transcription level of HIF-1α, B and C: Translation level of HIF-1α注:不同小写字母之间表示差异显著(P<0.05),不同大写字母之间表示差异极显著(P<0.01),相同字母之间表示差异不显著(P>0.05)。图2同Different uppercase letters represent significantdifferences of P<0.01, and different lowercase letters represent significant differences of P <0.05, the same letters represent no significant difference (P>0.05), the same below图1 猪IVF胚胎中HIF-1α的表达水平Fig.1 Expression of HIF-1α,IGF-I and IGF-IR in porcine IVF embryos
由图1-B、C可知,在HIF-1α基因翻译水平上,4-、8-细胞和桑椹胚期,Ber组均极显著高于其他各组(P<0.01),miRNA-18b agomir组均极显著低于其他各组(P<0.01),miRNA-18b antagomir组在8-细胞和桑椹胚时期均极显著高于NC组(P<0.01),与对照组均无显著差异(P>0.05),但4-细胞时期显著低于对照组(P<0.05),与NC组无差异(P>0.05)。
说明,Ber和miRNA-18b低表达能提高猪IVF胚胎中HIF-1α表达水平,miRNA-18b 过表达能下调HIF-1α表达水平,HIF-1α的表达水平随着胚胎发育呈上升趋势,4- ~8-细胞阶段更为明显。
2.2.2 荧光素报告基因检测miRNA-18b靶基因 猪HIF-1α 3’UTRwt与miRNA-18b之间推测均有结合位点(图2-A);为证实miR-18b与HIF-1α 3’UTR直接结合可调控HIF-1α的表达,将野生型HIF-1α 3’非翻译区(Wt 3’UTR)和突变序列(MT3’UTR)分别克隆到荧光素酶报告载体中。图2-B表明,miRNA-18b组中双萤光素酶活性均与NC组均无显著差异(P>0.05)。可见,所推测的miRNA-18b和HIF-1α基因的结合位点检测结果HIF-1α不是miRNA-18b的直接靶基因。

WT:野生型;MT:突变型;NC: 阴性对照WT: The wild type, MT: mutant type, NC: Negative controlA为ssc-mir-18b和HIF-1α的3’UTR序列比对及可能结合位点;B为HIF-1α的24h和48h相对荧光活性A represent the 3'UTR sequence alignment and possible binding sites of ssc-mir-18b and HIF-1α, respectively; B represent 24h and 48h relative luciferase activity of HIF-1α, respectively图2 转染HIF-1α载体质粒的双荧光素酶报告基因活性的结果Fig.2 The double luciferase reporter gene activity results of transfecting into HIF-1αvector plasmid
3 讨 论
Ber是从黄连种植物中提取的一种异喹啉生物碱化合物,有很广的生物学效应。将Ber添加于胚胎培养液中,能调控小鼠附殖前胚胎抗调亡基因miR-21[20],显著促进小鼠体外培养的囊胚移植妊娠率和窝成活率[27]降低猪卵母细胞中脂滴的含量、促进猪卵母细胞体外成熟[28,29],也能使猪的孤雌及IVF胚胎的体外发育囊胚率显著提高,并促进猪囊胚内细胞团和总细胞数量增多,降低了细胞凋亡指数,改善了培养环境中的NO水平,抑制了MDA生成,减少了自由基对胚胎的损伤[30,31]。本试验Ber对猪IVF胚胎体外发育的作用与之相一致。Ber也可调节miRNA-18b在猪IVF胚胎中的差异表达[21]。本试验结果表明了抑制miRNA-18b 的表达可极显著提高猪IVF胚胎发育率。
Berchner等研究了HIF在胚胎中可能参与的分子机制,通过在小鼠和牛胚泡中使HIF-1α,-2α和-1β基因表达来响应胚胎发育过程中氧状态的变化,HIF-1α易位至细胞核并与HIF-1β二聚化,然后HIF-1复合物与HIF-1靶基因的DNA调节序列结合[24]。HIF-1α蛋白仅定位于细胞质中,这与Thompson等先前进行的研究一致[32]。在以低(2%)氧浓度培养时,在小鼠囊胚的细胞质中检测到HIF-1α[33]。低氧条件中HIF-1α可刺激猪胚胎滋养层细胞的分化、增殖[34],进而促进胚胎发育。Yoon[35]等为了探究HIF-1α在缺氧条件和常氧条件下培养的小鼠囊胚中的表达,确定氧张力是否通过刺激HIF-1α表达影响胚胎发育,将小鼠胚胎在5%或20%O2下从1细胞培养至囊胚期,发现囊胚发育阶段的胚胎发育率不受氧张力的影响,HIF-1α蛋白定位于囊胚的细胞质,5%O2培养的相比20%O2培养的囊胚总细胞数更高,细胞凋亡数更低(P<0.05),且5%O2条件下的囊胚细胞中的HIF-1α水平显著高于20%O2条件。这些结果表明小鼠胚胎中HIF-1α表达增加能促进胚胎发育。本试验中,小檗碱和miRNA-18b低表达促进了4-、8-细胞和桑椹胚时期HIF-1α的表达,进而促进了猪体外受精胚胎的发育。然而,本试验双荧光酶素报告基因结果表明猪IVF胚胎中miRNA-18b的直接靶基因不是HIF-1α,推测可能是目前现有的猪源基因数据库资源较少,因而荧光素报告基因的靶基因检测结果与实时荧光定量PCR和western blot的结果不相符,也可能还有miRNA-18b与IGF-I、IGF-IR其他的结合位点,有待今后进一步探索。
MZT是胚胎发育中合子基因组激活,同时大量的母源mRNA被降解并合成了新的mRNA的一过程[36]。在小鼠胚胎中,母体mRNA的某些部分在MZT时期被降解,母体mRNA受到某些miRNAs的调控[37]。猪胚胎中的MZT是4细胞期[38]。本试验结果显示,miRNA-18b低表达和小檗碱在 4- ~8-细胞时期促进HIF-1α的表达更为明显。这可能是由于Ber可能主要是通过调控8-细胞中miRNAs的表达,有利于猪胚胎跨越母源型-合子型基因调控过渡后提供物质储备,从而提高了猪IVF胚胎的发育率[21]。
综上所述,在猪体IVF胚胎体外发育过程中,Ber和miRNA-18b可通过促进HIF-1α的表达调控了猪IVF胚胎体的体外发育,其中4- ~8-细胞时期作用更为明显。而有关Ber和miRNA-18b对猪IVF胚胎HIF-1α的调控作用有待进一步研究。
