ATP5B蛋白在乳腺癌中的表达及对其功能的初步探究
2019-11-01魏翔何崇武盛励张建刘力源谢新华韩佳邬黎青
魏翔 ,何崇武 ,盛励 ,张建 ,刘力源 ,谢新华 ,韩佳 ,邬黎青
(1.南昌大学第三附属医院病理科,江西 南昌 330006;2.江西省肿瘤医院乳腺外科,江西 南昌330006;3.江西中医药大学附属医院发热门诊,江西 南昌 330006;4.赣州市人民医院病理科,江西 赣州341000
乳腺癌是全球女性最高发的恶性肿瘤之一,其占到所有女性肿瘤的25%,也是女性肿瘤死亡的主要原因[1]。据统计在中国仅2015新发乳腺癌高达26万,死亡7万余例,位居中国女性所有肿瘤发病率之首,其最主要的死亡原因是肿瘤的侵袭及转移[2]。探究肿瘤侵袭、转移的机制成为目前研究的热点问题。肿瘤的侵袭、转移与肿瘤细胞自身的能量代谢密切相关,ATP合酶是线粒体中参与能量代谢的酶,其功能是将ADP和无机磷酸盐(Pi)合成ATP,以支持细胞的各种生物学功能。目前研究表明ATP合酶既在组织器官中参与能量代谢,也参与肿瘤组织的信号转导[3]。ATP合酶由F0结构域F1结构域两部分组成,而ATP5B基因编码F1单位上的β亚基,ATP5B表达的高低直接影响ATP合酶的功能。目前研究发现,在不同肿瘤中ATP5B表达不一,高表达的有胶质母细胞瘤[4]、Barrett食管病[5]、卵巢癌[6]等;低表达的有骨肉瘤。结直肠癌[8]、胆囊癌[9]等。ATP5B表达的高低与肿瘤的生物学行为亦不同,在结直肠癌及胆囊癌低表达ATP5B与肿瘤高侵袭性相关;在卵巢癌、胶质母细胞瘤中高表达ATP5B与肿瘤高侵袭性相关。在乳腺癌中ATP5B蛋白的研究不多,在乳腺癌中ATP5B蛋白表达的高低及对乳腺癌细胞生物学功能的影响并不明确。本文旨在探究乳腺癌组织中ATP5B蛋白的表达情况及对乳腺癌细胞生物学功能的初步探究。
1 材料与方法
1.1 材料
1.1.1 组织标本的收集 经患者同意,收集本院乳腺癌组织病理标本30例,均为女性患者,每例标本均取癌组织及癌旁乳腺组织(距癌组织5cm处的形态学正常的乳腺组织)。
1.1.2 实验细胞株 实验所使用的细胞株均是课题组以前储备的,五种细胞株均购自中国科学院上海分院,其中1株乳腺正常上皮细胞:HBL-100,4株 乳 腺 癌 细 胞 :MCF-7、T-47D、MDA-MB-231、BT-549。所有细胞株均在37℃,5%CO2培养箱中培养。HBL-100、T-47D及 BT-549用 90%1640+10%FBS 培养 ,MCF-7、MDA-MB-231 细 胞 株 用90%DMEN+10%FBS培养。
1.1.3 ATP5B siRNA质粒序列检测 ATP5B单克隆抗体购于Abcam公司,ATP5B siRNA购于锐博生物科技有限公司,ER、PR、HER2、Ki-67 抗体均购自北京中杉金桥。ATP5B siRNA质粒序列见表1。

表1 ATP5B siRNA质粒序列
1.2 方法
1.2.1 免疫组化检测 ATP5B抗体按1:500稀释,二抗用通用型鼠/兔二抗-HRP聚合物;ER、PR、HER2及Ki-67抗体均为即用型工作液。按照SP法免疫组化步骤进行操作;阴性对照以磷酸盐缓冲液代替一抗。
1.2.2 免疫组化结果判读 ATP5B免疫组化染色定位于细胞质或细胞膜。结果判定采用半定量积分法:(1)按染色强弱计分:深褐色3分,褐色2分,淡褐色1分,无着色0分;(2)根据阳性肿瘤细胞百分比计分:阴性0分,<25%计1分,25%~50% 计2分,51%~75% 计3分,≥75% 计4分。将上述2项得分相乘即为最后评分结果,0~3分为 (-),3~5分为(+),6~8 分为(++),>9 分为(+++)。 同时,我们将(++)和(+++)定义为高表达,(-)和(+)定义为低表达。每张切片均由两名高年资的病理医师判读,判读结果不一致时讨论决定。ER、PR免疫染色定位于细胞核,采用CPA/ASCO指南的评分标准:免疫组化染色阳性细胞数≥1%既判为阳性。Ki-67免疫组化染色定位于细胞核,按阳性肿瘤细胞所占百分比判读。HER2免疫组化染色定位于细胞膜,其评分标准按2014版乳腺癌HER2检测指南[10]。
1.2.3 Western Blot检测 ATP5B蛋白在各乳腺癌细胞株中的表达,选择高表达ATP5B蛋白的细胞株,ATP5B siRNA质粒转染 48h后,Western Blot检测其沉默效果,选择沉默效果最佳的质粒沉默ATP5B蛋白后,通过细胞划痕实验、Transwell侵移实验、MTT法分析ATP5B的沉默对乳腺癌细胞生物学功能的影响。
1.2.4 数据分析 所得实验结果数据采用统计学分析软件SPSS 21.0进行统计分析,两组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 ATP5B蛋白在乳腺癌组织中的表达高于癌旁乳腺组织 通过观察镜下免疫组化染色,我们发现,ATP5B蛋白在乳腺癌组织及癌旁组织中均有表达,主要表达在细胞浆,见图1、图2。将ATP5B蛋白免疫组化评分(-)及(+)定义为低表达,(++)及(+++)定义为高表达。将乳腺癌组织和癌旁组织ATP5B蛋白表达高低情况做统计学分析,见表2。ATP5B蛋白在乳腺癌组织中的表达显著高于癌旁正常乳腺组织,P<0.05,差异具有统计学意义。
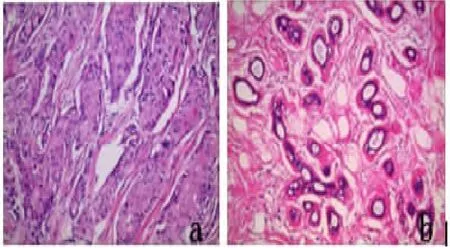
图1 HE(×200)乳腺癌组织及癌旁乳腺组织

图2 IHC(×200)ATP5B蛋白在乳腺癌组织及癌旁乳腺组织中的表达

表2 乳腺癌组织和癌旁乳腺组织ATP5B蛋白表达统计分析
2.2 ATP5B蛋白的表达与乳腺癌患者的年龄、ER、PR、HER2、Ki-67及淋巴结癌转移情况均无明显相关性 收集的30例乳腺癌标本均为女性,均为非特殊型浸润性癌;患者的中位数年龄为52岁,平均年龄为53.9岁。ATP5B蛋白的表达与临床病理参数的关系见表3,示乳腺癌患者ATP5B蛋白的表达水平与患者的年龄、ER、PR、HER2、Ki-67 及淋巴结癌转移情况均无明显相关性(P>0.05)。
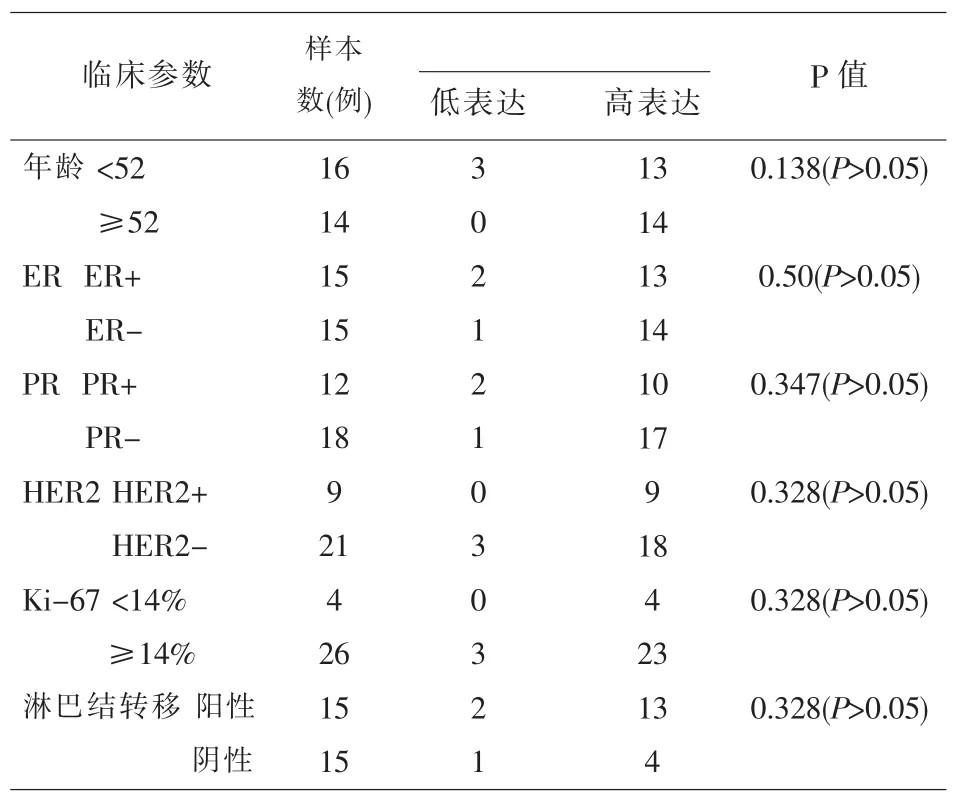
表3 乳腺癌患者ATP5B蛋白的表达与临床参数的关系
2.3 ATP5B蛋白在T-47D乳腺癌细胞中表达最高通过 Western Blot检测 HBL-100、MCF-7、T-47D、MDA-MB-231及BT-549细胞中ATP5B蛋白的表达情况 以β-actin作为参照蛋白,在5种乳腺细胞中,均有ATP5B蛋白的表达,以T-47D乳腺癌细胞表达量最高。见图3。

图3 Western Blot检测各细胞ATP5B的表达
2.4 si-h-ATP5F1B-002质粒沉默T-47D乳腺癌细胞ATP5B蛋白表达的效果最佳 在2.3实验结果中,以T-47D乳腺癌细胞ATP5B蛋白表达量最高,选择该细胞进行转染实验。根据ATP5B siRNA质粒的转染说明,利用riboFECTTM CP转染试剂,按操作说明进行转染。转染48h后提取蛋白,Western Blot检测各转染质粒组ATP5B蛋白的表达量,以空白组作为对照,ATP5B蛋白表达越低,说明质粒的转染效力越高。si-h-ATP5F1B-002组ATP5B蛋白表达最低,其转染效力最高。见图4。

图4 Western Blot检测各质粒沉默ATP5B的表达
2.5 沉默ATP5B可以显著抑制乳腺癌细胞T-47D的运动能力 我们选择ATP5B蛋白表达量最高的乳腺癌细胞T-47D,以及转染效力最高的质粒sih-ATP5F1B-002进行实验。在24h及48h,质粒sih-ATP5F1B-002组细胞迁移率比对照组和NControl组显著减小,且差异具有统计学意义(P<0.05),说明沉默ATP5B可以显著抑制乳腺癌细胞T-47D的运动能力。见图5、表4。

图5 细胞划痕实验分析ATP5B的沉默对癌细胞运动能力的影响(×100)

表4 细胞划痕实验细胞移动距离统计分析
2.6 沉默ATP5B可以显著抑制乳腺癌细胞T-47D的迁移能力 我们选择ATP5B蛋白表达量最高的乳腺癌细胞T-47D,以及转染效力最高的质粒sih-ATP5F1B-002进行实验。质粒si-h-ATP5F1B-002组癌细胞的穿过膜的细胞数量显著比对照组及空载组(NControl)的细胞数量少,且差异具有统计学意义(P<0.05),而对照组与NControl组穿过膜的细胞数量基本一致,差异无统计学意义(P>0.05);说明ATP5B的沉默抑制了乳腺癌细胞T-47D的迁移能力。见图6、表5。

图6 Transwell迁移实验结果(×200)
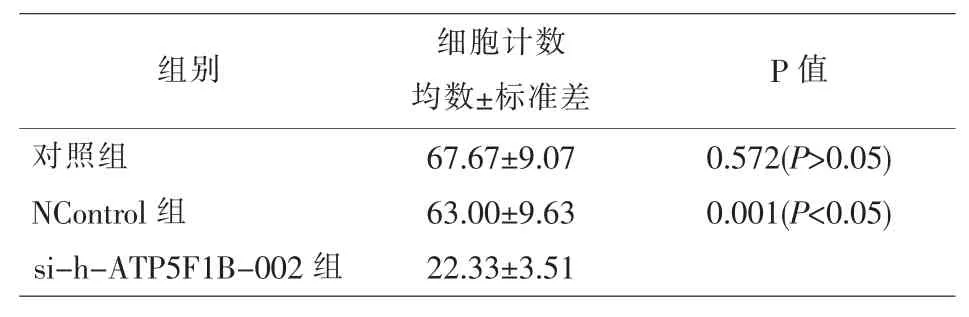
表5 Transwell迁移实验细胞计数统计分析
2.7 沉默ATP5B可以显著抑制乳腺癌细胞株T-47D的增殖活性 我们选择ATP5B蛋白表达量最高的乳腺癌细胞T-47D,以及转染效力最高的质粒si-h-ATP5F1B-002进行实验。质粒si-h-ATP5F1B-002组癌细胞的OD值显著比对照组及空载组(NControl)的OD值低,且差异具有统计学意义(P<0.05);对照组与NControl组癌细胞的 OD值差异无统计学意义。说明质粒si-h-ATP5F1B-002组癌细胞的增殖活性比对照组及空载组(NControl)低,ATP5B的沉默抑制了乳腺癌细胞株T-47D的增殖活性。见表6。
3 讨论
ATP5B基因其主要功能是转录、翻译成ATP合酶的F1结构域的β亚基,是ATP合酶参与细胞线粒体能量代谢较为重要的亚基[11]。一直以来,ATP合酶被认为只参与细胞的能量代谢,但近年研究发现其与肿瘤细胞的增殖、侵袭的许多机制有关;包括作为内皮细胞表面的血管抑制素受体,参与肿瘤微血管形成的调控,参与肿瘤细胞的信号转导,进而调控肿瘤细胞的生物学功能。在过去的十年中,ATP合酶已经被证明在癌症中发挥作用[12-14]。并被认为是一种可能的肿瘤非特异性治疗靶点,尤其是在细胞表面表达时[15-17]。
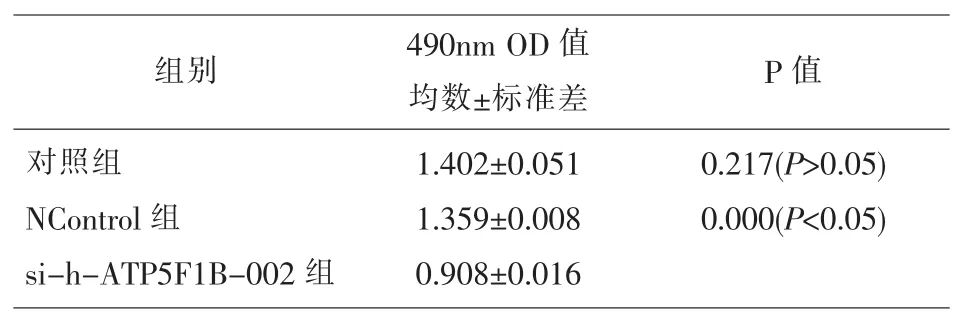
表6 MTT法分析癌细胞ATP5B沉默对增殖活性的影响
在众多研究中均发现ATP5B蛋白表达的高低对肿瘤的生物学影响不同。在大多数体外肿瘤细胞株实验中高ATP5B蛋白的表达是促进肿瘤的增殖及侵袭,例如在前列腺癌细胞系中。其机制并不明确,目前有学者提出两种可能的机制:(1)细胞表面ATP5B参与产生的ATP产物通过嘌呤受体P2X和嘌呤受体P2Y参与嘌呤能信号转导。ATP合成产物可以刺激嘌呤受体,而嘌呤受体具有多种生物学功能,包括促进内皮细胞增殖和血管生成[18]。ATP合成产物作为小窝内的自分泌因子,可刺激嘌呤受体P2Y促进细胞增殖,导致肿瘤生长和血管生成。P2X受体是ATP门控的,Ca2+渗透通道,介导阳离子(Na+,K+和Ca2+)的快速非选择性通道,导致细胞内Ca2+增加,进而激活细胞内P2X受体[19]。(2)ATP合酶在内皮细胞表面具有活性,具有转运质子和合成ATP的能力,肿瘤细胞异位或高表达ATP5B蛋白,增加ATP合酶的活性,可以增加肿瘤细胞内的质子的转运,创造肿瘤细胞内生理性的pH环境和细胞外的酸性环境,帮助肿瘤细胞在高酸性环境中存活下来;同时细胞外的酸性微环境可引起细胞外基质的局部失稳,促进肿瘤生长和组织侵袭[20]。
亦有研究显示ATP5B蛋白的低表达与肿瘤的不良预后有关。研究显示在胆囊癌中ATP5B蛋白表达的丢失与肿瘤的大小、高TNM分期、远处转移及淋巴结转移呈正相关,尤其是与较短的生存率有显著的相关性[9]。其可能的机制是:(1)Moser等[21-22]发现内皮细胞表面ATP酶是血管抑制素的受体,通过抑制内皮细胞表面ATP代谢来抑制血管生成。Notari[23]报道,色素上皮衍生因子(Pigment Epithelium Derived Factor,PEDF)作为体内血管生成的有效阻滞剂,抑制内皮细胞迁移和血管形成,减少内皮细胞产生的细胞外ATP的数量,并与内皮细胞表面的ATP5B具有较高的亲和力,并且还能阻断ATP5B与血管抑制素的结合。(2)线粒体除了合成人体所需的ATP以外,它在细胞死亡的过程中也起着至关重要的作用,而ATP5B合酶是线粒体在细胞死亡过程中发挥作用的关键物质。ATP5B合酶通过生成活性氧(ROS)来发挥作用,而ROS又可以对细胞及线粒体产生严重的氧化损害[9]。ATP5B的高表达已被证实可以在细胞毒性物质的作用下增加细胞的死亡,而线粒体的失活可以导致ROS信号的减弱及增强对细胞毒因子的耐受。
在本次研究中,我们发现乳腺癌组织中ATP5B蛋白的表达明显高于癌旁的正常乳腺组织。是否能说明乳腺癌细胞的能量代谢较正常乳腺细胞高,其较高的能量代谢是导致肿瘤细胞增殖、侵袭的始动因素,还是为适应肿瘤细胞自身的生物学功能而被动的调节呢,这值得我们深入研究。目前在肿瘤中ATP5B蛋白高表达的机制并不明确,目前对ATP5B蛋白高表达机制研究较为深入的是在胶质母细胞瘤中。Guiyan Xu等[4]在研究胶质母细胞瘤(GBM)的发病机理中发现,利用线粒体和代谢PCR基因阵列对GBM微血管 (从GBM中分离出来的微血管)、正常脑血管和GBM肿瘤细胞之间的ATP5B mRNA表达谱进行评价,结果显示GBM肿瘤细胞和GBM微血管中ATP5B的mRNA水平显著高于正常脑血管。且组织微阵列免疫组化染色,也显示ATP5B在GBM肿瘤细胞和GBM微血管中强烈阳性,而在正常血管中为阴性。通过分析281个GBM病例和其他癌症的癌症基因组图谱数据集发现,只有很少比例的GBM病例有ATP5B的突变或扩增,没有病例出现ATP5B基因被删除。并且ATP5B基因扩增的GBM病例ATP5B信使RNA表达增加并不显著。可见GBM基因组ATP5B DNA的改变并不是GBM高表达ATP5B的主要原因,由此推测在GBM发病机制中存在对ATP5B基因组转录的调控机制。在乳腺癌中是否存在类似的机制,亦需进一步的深入研究。
肿瘤对机体最大的损害是在人体内的侵袭和转移,在乳腺癌中HER2的高表达或扩增及高的Ki-67增殖指数预示着乳腺癌患者较差的预后。那么乳腺癌ATP5B蛋白的高表达与乳腺癌的预后是否具有相关性,通过统计学分析ATP5B蛋白的表达与乳腺癌预后差的指标HER2及Ki-67的相关性,以及直接统计ATP5B蛋白的表达与患者预后差的指标淋巴结癌转移的相关性。本研究中,我们发现ATP5B蛋白的表达与乳腺癌HER2及Ki-67并无明显相关性,且与另一个反映预后的指标淋巴结癌转移也无明显相关性。不排除我们研究的标本量太小,存在统计学上的误差的可能。
在进一步实验中,我们运用了RNA干扰技术,这是一种在基因转录后沉默其目标mRNA的技术。利用脂质体转染导入大量siRNA可以在短时间内对特定基因进行沉默,从而进行基因功能的研究[24]。在我们的研究中,发现沉默ATP5B蛋白的表达可以显著抑制乳腺肿瘤细胞的增殖、侵袭性。实验结果进一步验证了在乳腺癌细胞中ATP5B蛋白的高表达可以促进肿瘤细胞的增殖、侵袭能力,而抑制ATP5B蛋白的表达可以抑制乳腺癌细胞的增殖、侵袭能力。这为ATP5B抑制剂的研发提供了契机,也为乳腺癌的非特异性的靶向治疗提供了可能。
尽管ATP5B抑制剂具有抑制肿瘤细胞增殖、侵袭的功能,但目前为止并没有很特异的ATP5B抑制剂应用于肿瘤的靶向治疗。其原因是ATP合酶在人体许多细胞膜表面都表达,虽然在ATP5B在肿瘤中和正常组织的表达量不是一样,但一样会引起人体的不良反应,尤其是包括心脏在内的人体重要器官的损害。所以在使用ATP5B抑制剂时,必须要对人体器官功能进行监测。但是,如果这些抑制剂可以对肿瘤只起局部作用,比如肿瘤内给药或灌注,对其他器官的副作用可能是最小的,亦有希望应用于临床肿瘤患者的治疗。
(收稿日期2018-07-16,修回日期2018-11-03)
