美国FDA哨点行动及启示
2019-10-31郑晓琼
文/郑晓琼
一、概述
2007年,美国国会通过《食品药品管理局修正案》(2007年),即FDAAA,要求FDA 建设一个主动识别与分析上市后风险的系统,将不同来源的数据关联并进行安全性分析。法律要求数据来自公共及民营卫生相关电子数据收集单位,目标是以更接近实时的方式加强FDA 识别并调查安全性问题,开展被动监测系统难以进行的问题研究。为履行法律要求,FDA 推出哨点行动,建立了哨点系统及FDA-催化剂两个项目,本文重点探讨哨点系统。
哨点系统的核心是电子健康数据、专家组及特别计算机程序。电子健康数据绝大部分来自医疗保险账单,少量来自医疗记录;特别计算机程序帮助回答药品及疫苗如何发挥作用,可查询用药或疫苗接种后出现不良事件的某类患者,但无法看到患者身份及隐私信息。
哨点系统为分布式数据网络,现有数据合作伙伴18 家,电子健康数据覆盖上亿人。FDA 用哨点定期分析患者住院、门诊、药房取药及药物配送情况。过去两年,FDA 用哨点数据形成多个监管决策:5个产品的9个潜在安全性问题得到排除,这些产品不必再耗时耗力开展上市后研究,通常则需要花费数年,成本高达数百万美元;研究阿片类和其他药品是否依照适应证使用或孕期使用情况;量化医疗失误率,并评估突发公共卫生事件应对效果。
哨点系统改变了以往上市医疗产品不良反应系统数据来自消费者、医务人员及企业报送的被动数据收集方式,用真实世界数据评估上市后产品的安全性信号,监管部门拥有了主动识别和分析上市后风险的能力。
从2009年“迷你哨点”试点到2016年哨点系统全面运行,哨点系统已发展成FDA 安全性监测工具库的核心资源(图1)。2019年初,FDA 发布《哨点系统五年战略规划:2019-2023》,规划明确了今后五年优先投入数据科学相关领域创新,继续扩大电子健康记录的获取和使用,2023年将哨点系统建成可持续发展的国家资源,在用于监测已上市医疗产品安全性的同时,扩大真实世界数据用于医疗产品性能评价的探索。
二、基本情况
(一)合作网络
哨点系统合作伙伴包括FDA、系统协调中心及数据合作伙伴。合作网络现有18 个数据合作伙伴,来自医疗保险机构、学术机构和医疗机构(表1)。
(二)数据规模
数据是哨点系统应用基础,包括注册登记、基本情况、医疗服务、诊断、手术、检查结果及生命体征等。哨点分布式数据库经过质量确认,通过美国医疗卫生体系的保险机构和卫生机构获取患者的就医数据。FDAAA 对电子健康数据的人群覆盖提出明确要求,要求2010年7月前至少获取2500 万人的电子健康数据,2012年7月前达上亿人。2000~2018年,分布式数据库累计识别人数达到3.10 亿人(图2)。
(三)监测工具
主动分析识别与分析系统(ARIA)是哨点系统的特别计算机程序,是数据应用的基础。ARIA 通过预设参数、常规查询工具,实现高效安全性监测分析。常规查询工具包括模块化程序、摘要表及工具包,各种方式都可用于安全性调查。按分析层级包括汇总表、1 级分析、2 级分析和3 级分析。

表1 数据合作伙伴
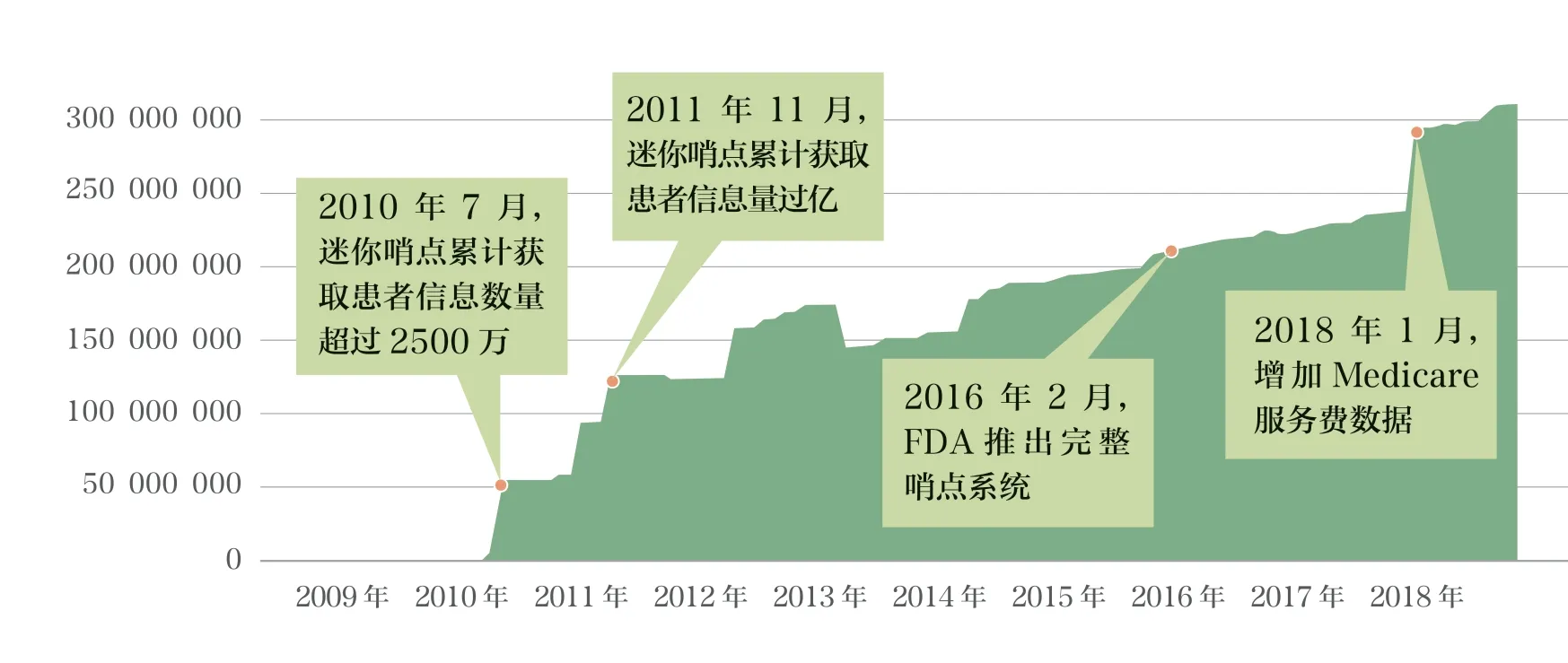
图2 哨点分布式数据库增长情况
(四)应用情况
哨点系统自2016年全面运行以来,以多种形式推动FDA 监管工作,包括提供证据进行支持标签变更,回应社会请愿或成为专家咨询委员会议题,一些信息提供了证据,消除了FDA 因潜在的安全问题可能采取的进一步监管行动。截至2019年上半年,已经开展研究369 项,形成探索性分析及安全性分析报告,这些报告在FDA 哨点行动网站全文发布。(注:探索性分析,显示结果发生率,分析医疗产品使用情况,并探索进一步评估的可行性;安全性分析,基于探索性分析基础上,使用更先进的研究设计和统计方法来控制混淆因素,评价产品与结果的相关性)(图3)。
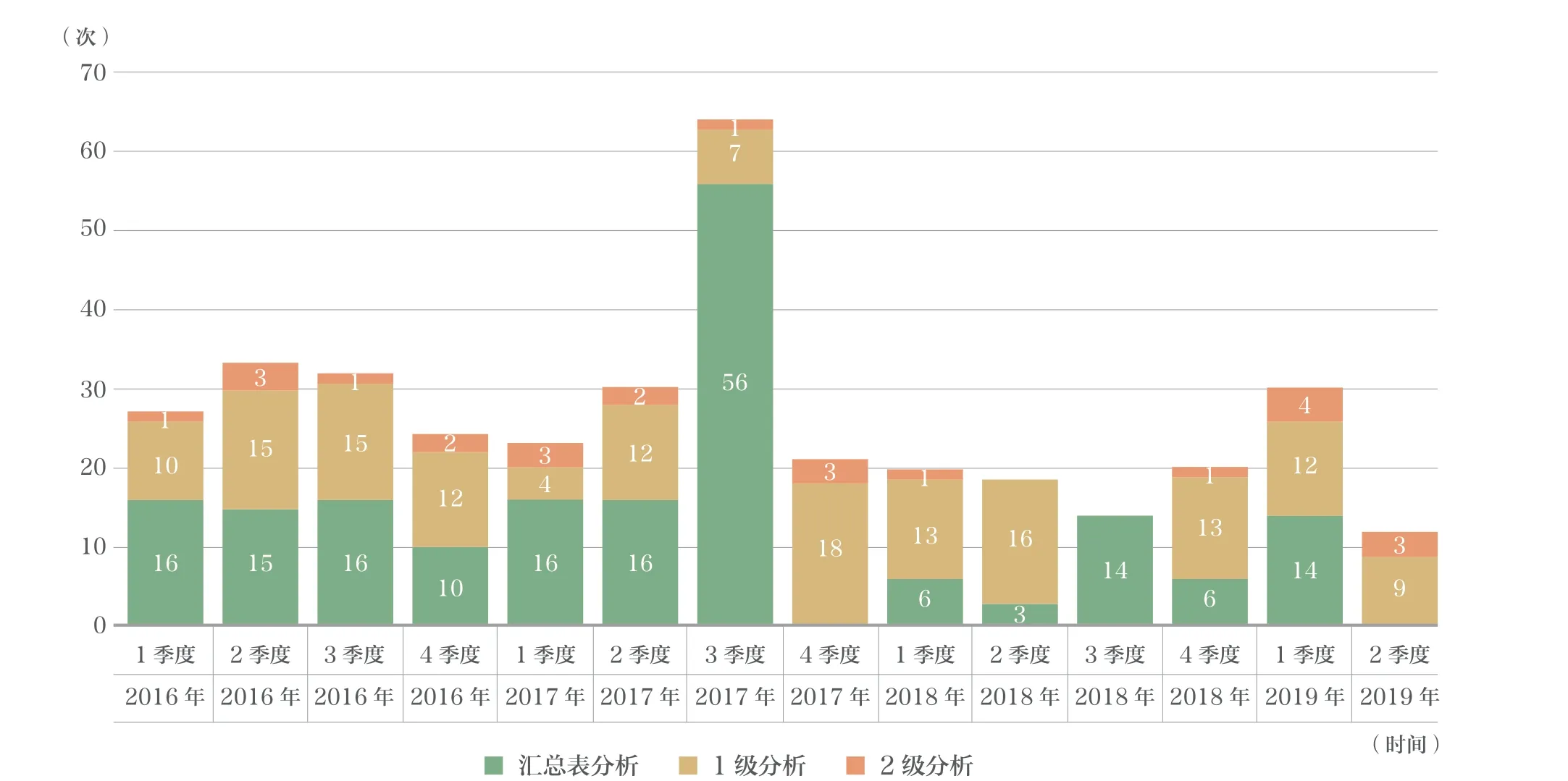
图3 哨点系统ARIS 分析,2016年1 季度至2019年2 季度

表2 FDA 基于哨点系统评估结果发布的安全公告
1.哨点系统
FDA 用哨点系统开展医疗产品安全性监测,可根据安全性问题,基于年龄段、时间段进行研究。一些研究可分析10年之久的数据(表2)。
1.1 药品审评和研究中心(CDER)
CDER 用哨点系统的主动风险识别和分析系统进行产品安全性和有效性主动评估,数据用来补充不良事件报告、公开发表的研究结果、临床试验等其他数据,形成监管决策。已开展探索性分析256个,进行安全性分析25 个,发布4 份药品安全公告。
1.2 生物制品审评和研究中心(CBER)
CBER 用哨点系统的上市后快速免疫安全监测(PRISM)系统及血液安全持续主动监控网络(BloodSCAN),对疫苗及血液制品和细胞、组织和基因疗法等生物制品的安全性进行监测,评估产品上市前和上市后的安全性,评估数据用来补充疫苗不良事件报告系统(VAERS)数据。现已开展探索性分析16 个,安全性分析13 个,发布3 份安全公告。
1.3 医疗器械和放射健康中心(CDRH)
CDRH 将哨点用于某些医疗器械上市后安全性评价,并充分考虑不同监测资源及其优势和局限性,形成更好的监管决策。已经完成并发布两份研究报告。2017年报告针对子宫肌瘤手术和动力分碎术使用情况研究,时间跨度为2008年1月1日-2016年6月30日。2018年发布2000年至2012年支架使用的安全性评估报告。
2.FDA-催化剂
“FDA-催化剂”是哨点系统的平行项目,它利用哨点基础设施,用哨点数据伙伴的数据并结合其他数据开展研究,可回答更广的问题。
截至目前已经开展4 项研究。2017年通过移动设备应用程序收集患者提供的信息,比较研究药品的有效性和安全性研究。另一项正在开展的研究是IMPACT-AFib 临床试验,对教育干预对8000 名房颤患者增加抗凝药使用的情况进行研究,这是真实世界数据用于临床试验的转型行动,将为未来公共卫生干预研究提供试点。
哨点系统使用案例
案例 1 2012年,FDA 收到来自医生报告——患者服用预防血栓新药后出血太多。通过使用哨点系统对数款新药使用者观察,并对照观察数款老药使用者,结果未表明新药比老药更不安全,基于此FDA 做出决定:患者可继续服 药,同时进一步进行研究。
案例 2 2013年FDA 用哨点系统对一种接种量达 50 万人的疫苗的安全性进行了研究。结果表明:有些接种婴儿出现了副作用,但非常罕见,每10 万婴儿不足2 人。基于此,FDA 告知医生和家长,接种疫苗更有益健康。但医生应注意此罕见的副作用,一旦出现应进行针对性治疗。
三、启示
哨点系统已成为FDA 安全性监测体系的核心工具,从2009年“迷你哨点”试点起步到2016年全面实施,其在业务模式、数据组织、技术路线等方面的探索,有许多经验。
(一)确定管理模式,协同建设合理分工
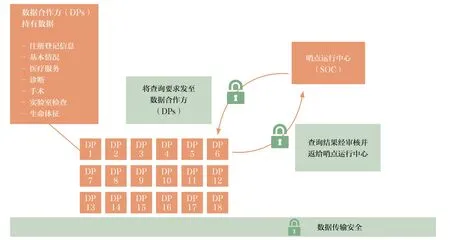
图 4 哨点系统管理与运行模式
哨点系统协作伙伴由FDA、哨点系统协调中心和协作研究机构组成(图4)。FDA 为决策部门,负责管理哨点系统合同、确定战略重点、明确项目要求、检查工作成果;哨点系统协调中心负责领导由数据和学术合作伙伴组成的协调机构网络,提供医疗卫生数据研讨科学技术,组织相关机构专家。
协调中心设在哈佛Pilgrim 卫生保健研究所,包括数据运行、基础设施及管理部门:
- 数据运行部:哨点方法核心,应用监测核心,负责对哨点方法学和流行病学监督
- 基础设施部:哨点数据核心,负责数据、程序和日常查询工具开发监督
- 管理部:为数据运行和基础设施部门提供管理支持,包括规划委员会、隐私保护委员会以及利益冲突委员会。规划委员代表来自FDA、协调机构及患者组织,为FDA 和运行中心提供咨询,为各方提供沟通平台。
(二)采取分布式系统和数据库,确保患者隐私
哨点系统采取分布式系统和数据库建设模式,数据由电子数据持有人保有并运行,不属于FDA 或哨点运行中心。每个数据伙伴按照通用数据模型复制数据,并将数据置于防火墙内,将安全性问题转为哨点分布式数据库查询,一方面实现监测医疗产品性能的目标,同时也针对患者信息提供最高级别的保护。查询结果多方共享。
(三)不断开发监测工具,实现主动监测
目前FDA 已开发出主动安全性监测的各种自动化工具,包括可在分布式数据环境中快速使用的常规查询工具,如汇总表、模块化程序和软件工具包。这些工具共同支持 FDA 的主动风险识别与分析计划(表3,表4)。
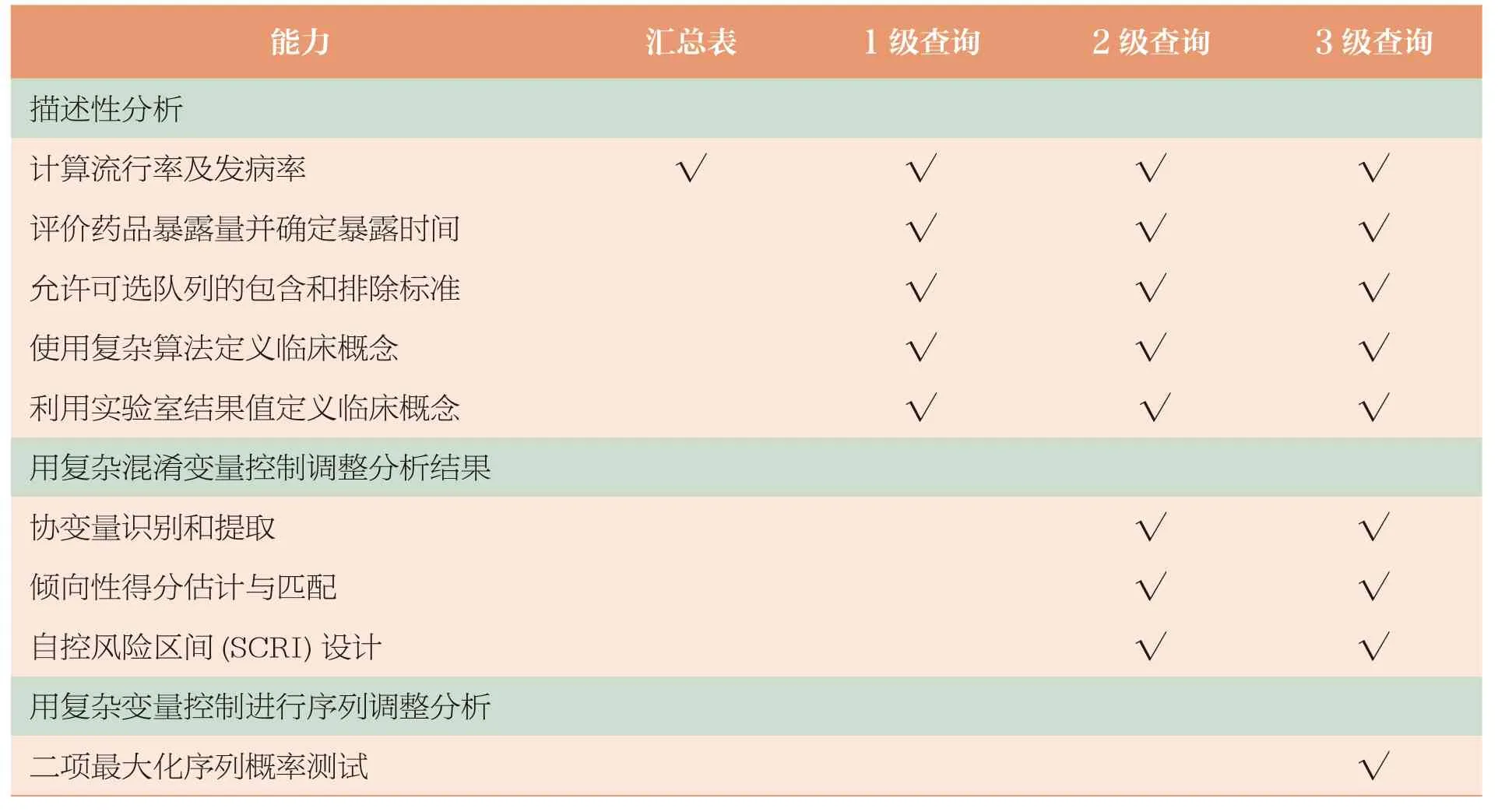
表3 监测工具与功能
(四)注重方法创新与应用,分阶段提升系统能力
哨点系统推出多种评估方法,助力FDA 加强医疗产品的安全评估。早期方法项目,代表了新颖想法和创新,需要完成概念验证工作。中期方法项目,侧重于方法学技术,这些技术在统计或流行病学上已证明是有价值的,但还没有完全应用于哨点分布式数据库。后期方法项目,使用原型来促进分析工具的开发、实施和增强。
(五)建立哨点通用数据标准,实现跨表数据关联
哨点系统的通用数据标准通过唯一人员标识符PatID 实现跨表链接,数据伙伴可在本地迅速运行分布式程序,进行数据分析(图5)。
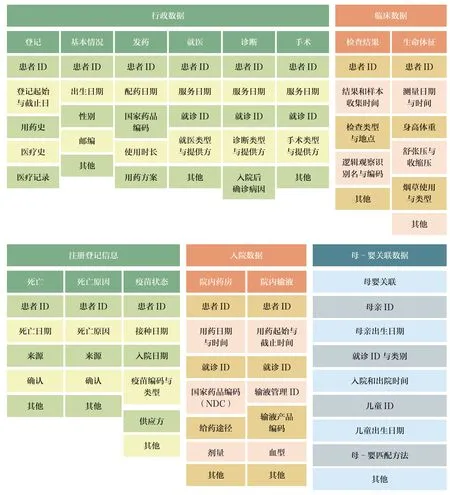
图 5 哨点通用数据模型(7.00 版本)
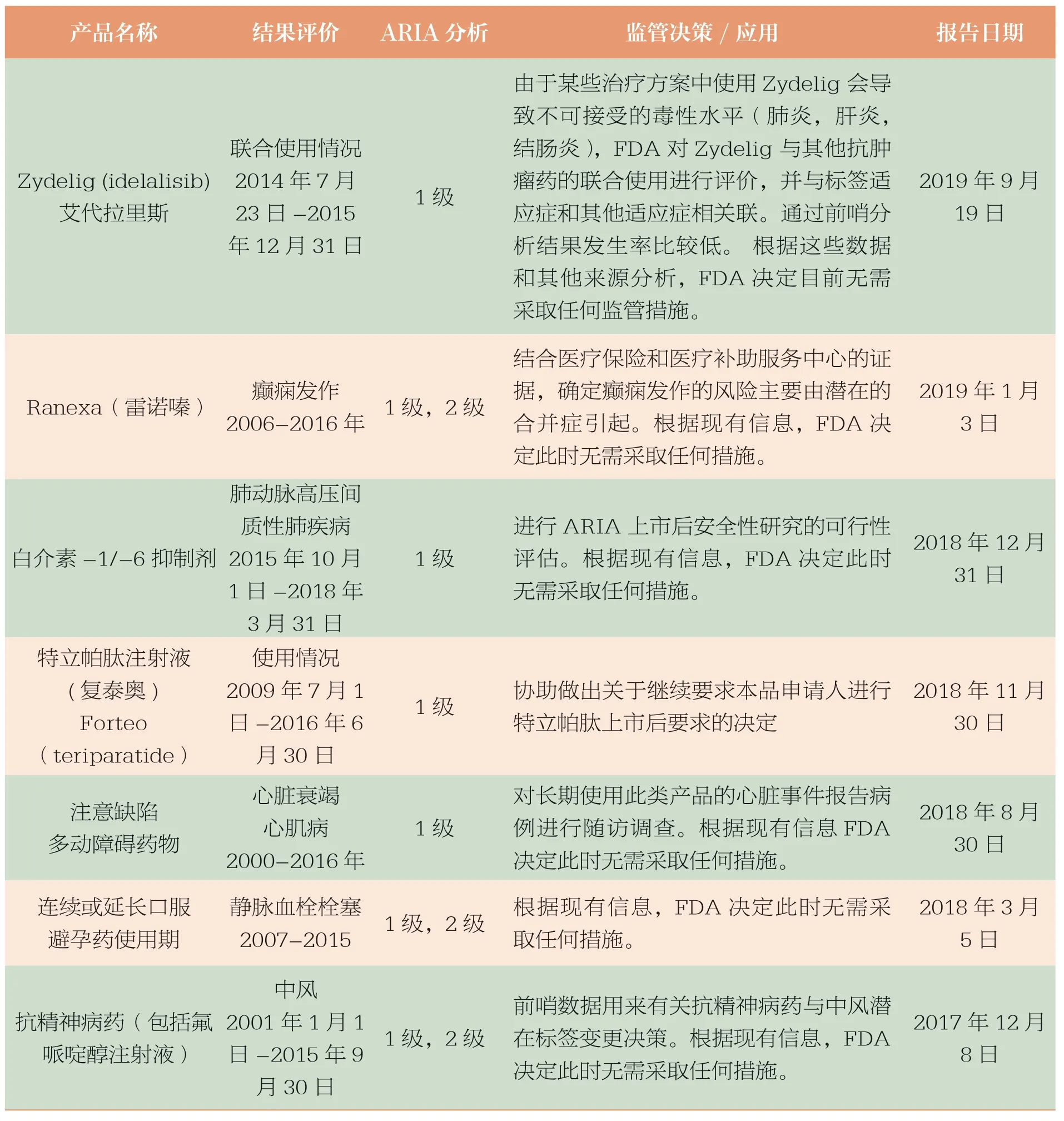
表4 部分ARIA 分析与监管行动表
