钙与乳蛋白的相互作用机制及对其功能特性的影响研究进展
2019-10-30李向莹秦于思王存芳
李向莹,赵 烜,秦于思,陈 笛,王存芳*
(齐鲁工业大学(山东省科学院)食品科学与工程学院,山东 济南 250353)
乳中蛋白质主要由酪蛋白和乳清蛋白组成,其中酪蛋白是由磷酸盐基团和丝氨酸酯化得到的结合蛋白,约占乳中蛋白质80%,乳清蛋白是球状蛋白,约占乳蛋白的20%[1]。钙是人体的重要组成成分,参与人体重要的生理活性过程,能够有效维持体内酸碱平衡,具有控制新陈代谢、激素分泌等多种生理活性[2]。乳制品是人类膳食摄取钙的最佳途径,能为人体提供合理的钙磷比。由于乳蛋白自身结构的不同,钙离子与酪蛋白、乳清蛋白发生相互作用。该反应不仅影响酪蛋白胶束结构的稳定性,对其自身的热稳定性、乳化性、溶解性、起泡性和凝胶性等功能特性也会产生影响。因此,研究钙与乳蛋白的相互作用以及对乳蛋白的功能性调控具有重要意义。
1 乳中钙的组成
钙在乳中主要以胶束钙和可溶性钙两种形式存在,这两种形式的钙在胶束相和乳清相中形成动态平衡[3]。在胶束相中,钙主要是作为无定形胶体磷酸钙(colloidal calcium phosphate,CCP)存在于酪蛋白胶束中或作为与磷酸丝氨酸残基结合的钙离子的形式存在[4]。其中,CCP中的胶束钙可参与中和磷酸丝氨酸残基中的负电荷,起到连接酪蛋白的作用。而乳清相中的可溶性钙则以柠檬酸钙、磷酸盐或游离钙离子的形式存在[5]。不同乳源中钙的含量不同,其在胶束相和乳清相中的分布也不尽相同(表1)。
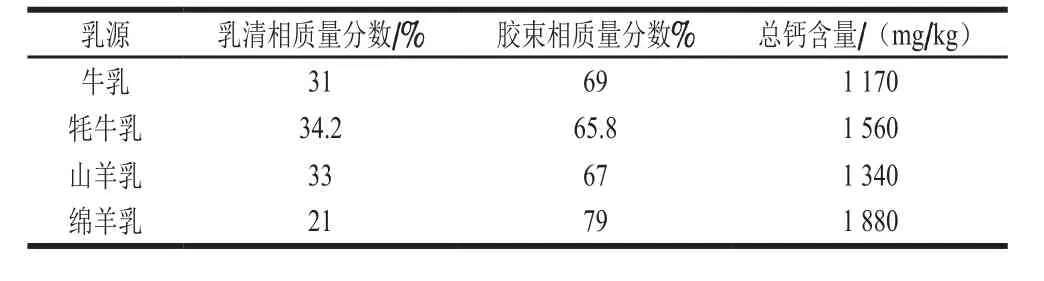
表1 不同乳源中钙的含量及其分布[6-7]Table 1 Calcium contents and distribution in different milk sources[6-7]
2 钙与酪蛋白的相互作用机制
酪蛋白主要由αs-酪蛋白、β-酪蛋白和κ-酪蛋白构成,其自身的交联和聚合的产生均与钙离子有关[8]。酪蛋白单体组分含有多个磷酸丝氨酸残基的磷酸基团,可与钙离子有效结合,降低静电稳定机制作用,从而导致酪蛋白酸盐亚胶束的缔合,对稳定酪蛋白胶束的结构具有重要作用[9]。由于酪蛋白单体中磷酸盐含量不同,其对钙离子的敏感性从高到低依次为αs-酪蛋白、β-酪蛋白和κ-酪蛋白[10]。此外,在钙离子存在的情况下形成的酪蛋白络合物与单个酪蛋白聚合体相比,酪蛋白络合物较聚合体对钙具有更强的亲和性[11]。
2.1 钙与αs-酪蛋白和β-酪蛋白的相互作用

图1 钙与酪蛋白的相互作用机制Fig. 1 Mechanism of interaction between calcium and casein
αs-酪蛋白可分为αs1-酪蛋白和αs2-酪蛋白。αs1-酪蛋白由199 个氨基酸组成,没有半胱氨酸残基,有结合8 个磷酸根离子的丝氨酸[12]。αs1-酪蛋白与钙结合的机制如图1A所示,αs1-酪蛋白含有3 个疏水性区域(残基1~44、90~113和132~199),两个亲水性区域将其进行区分,其中45~89序列的亲水性区域含有磷酸酯基团的结合位点,经酶解后可与钙离子结合。与含有的磷酸根离子相似,在中性pH值下,每摩尔磷酸酯基团可结合8 mol Ca2+[13]。Ca2+与αs1-酪蛋白发生吸附作用,随着钙离子浓度提高,αs1-酪蛋白表面电荷减少,Zeta电位下降,导致CCP盐含量增加,胶体发生凝集作用,稳定性降低[14]。而通过添加柠檬酸盐或磷酸盐可减少乳中的钙离子含量,CCP减少,乳稳定性增加[10]。
如图1B所示,与αs1-酪蛋白相比,αs2-酪蛋白含有2 个半胱氨酸残基,形成二硫桥,在丝氨酸上可结合10 个磷酸根离子,对Ca2+较为敏感[15]。另外,其含有2 个磷酸化丝氨酸残基簇(SerP-SerP-SerP-Glu-Glu),使其结合Ca2+的能力增强。αs2-酪蛋白含有2 个疏水性区域(残基90~120、160~207)和2 个亲水性区域,含有磷酸酯基团的结合位点大致位于8~12、56~63、129~133序列中,在中性pH值条件下,每摩尔αs2-酪蛋白可与10 mol Ca2+进行结合[12]。
如图1C所示,β-酪蛋白含有一个疏水性的C端区域和高电荷的N端区域,是疏水性最强的蛋白质,在丝氨酸残基上可结合5 个磷酸根离子。β-酪蛋白在亲水性区域(残基1~44)含有磷酸酯基团结合位点,主要位于14~21序列中,在中性条件下,每摩尔磷酸酯基团可结合5 mol Ca2+[16]。相对于αs1-酪蛋白和αs2-酪蛋白,β-酪蛋白对Ca2+的敏感性较低。
总之,钙与酪蛋白相互作用机制在于αs-酪蛋白的磷酸基团以及β-酪蛋白N端的羧基,两者均具有SerP-SerP-SerPX-SerP序列,共同构成酪蛋白的中心位置,对钙离子较敏感,易于与大量钙离子结合,从而产生酪蛋白沉淀[17-18]。
2.2 钙与κ-酪蛋白的相互作用
κ-酪蛋白位于酪蛋白胶束外围,是酪蛋白中唯一一个被糖基化的蛋白质。与其他酪蛋白不同,κ-酪蛋白没有磷酸丝氨酸簇和苏氨酸糖苷化残基,只含有1 个磷酸丝氨酸残基,不能强烈地与钙离子结合,对钙离子诱导沉淀不敏感[19]。在pH 6.6时,每摩尔的κ-酪蛋白只能结合2 mol Ca2+。κ-酪蛋白这种特殊的化学结构,使其具有较强的亲水能力,在Ca2+存在时,它可以抑制对钙离子敏感的αs-酪蛋白和β-酪蛋白发生沉淀,具有稳定酪蛋白胶束空间结构的作用[20-21]。同时,钙离子也可通过屏蔽带负电荷的基团来减少胶束电荷,防止κ-酪蛋白在特定pH值下的解离。当κ-酪蛋白中Phe105-Met106肽键被酶分解为副-κ-酪蛋白和酪蛋白糖巨肽时,前者随酪蛋白胶束一同沉淀,后者由于高负电荷和强极性存在于溶液中,稳定作用丧失[22](图2)。
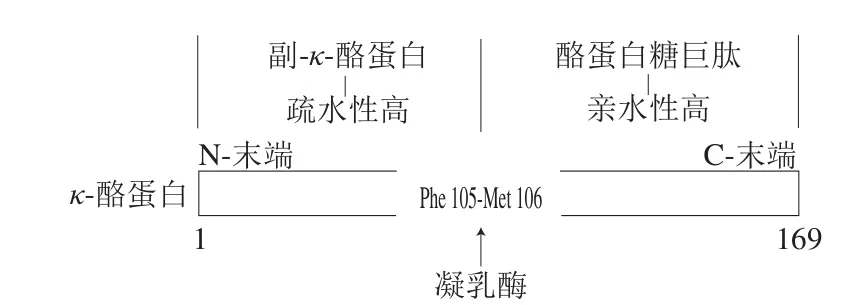
图2 凝乳酶对κ-酪蛋白的分解示意图[22]Fig. 2 Schematic diagram of the decomposition of κ-casein by chimosin[22]
3 钙与乳清蛋白的相互作用机制
乳清蛋白主要由α-乳白蛋白、β-乳球蛋白、血清白蛋白、乳铁蛋白、免疫球蛋白等微量小分子蛋白构成[1]。在乳清相中,可溶性钙质量占牛乳中总钙的31%,主要位于α-乳白蛋白中。与含有较多钙离子结合位点的αs-酪蛋白和β-酪蛋白不同,α-乳白蛋白含有1 个钙活性中心,可以和钙离子结合[23]。
3.1 钙与α-乳白蛋白的相互作用
α-乳白蛋白是金属结合蛋白,与钙的相互作用机制在于其含有α-螺旋和β-片状2 个固有结构域。该结构域由半胱氨酸残基Cys73和Cys91之间的二硫桥连接,形成Ca2+结合环。蛋白分子中的天冬氨酸残基Asp82、Asp87、Asp88的羧基氧配体和Asp84、Lys79的羰基氧化物以及1 个或2 个水分子均可与1 分子的Ca2+强烈结合,形成五角双锥结构[24](图3)。Ca2+与α-乳白蛋白结合影响其三级结构以及分子稳定性。在pH值低于3.5时,α-乳白蛋白发生构象的酸转变,其原因在于,高浓度的H+对Ca2+结合部位进行竞争,从而减弱α-乳白蛋白与Ca2+的结合,引起构象的转变[25]。另外,Ca2+与α-乳白蛋白结合在抵抗热变性方面具有稳定性:在Ca2+存在下,α-乳白蛋白与钙发生聚合,其自然态和变性态的热转变温度超过40 ℃,热稳定性提高,即使在低温下变性后仍可复性。但当pH值低于5时,α-乳白蛋白由于温度和浓度的变化发生构象的改变,Asp残基质子化,结合Ca2+的能力减弱甚至丧失[26],热稳定性降低,低温下发生变性,变性后不再复性。由于α-乳白蛋白具有良好的Ca2+亲合力,当Ca2+重新与α-乳白蛋白结合时,在低温下可恢复其天然结构[12]。

图3 钙与α-乳白蛋白的相互作用Fig. 3 Interaction between calcium and α-lactalbumin
3.2 钙对β-乳球蛋白和κ-酪蛋白相互作用的影响
乳清蛋白与酪蛋白胶束在经过高温处理时,两者通过巯基-二硫键反应发生相互作用,而钙离子的存在促进了β-乳球蛋白的热变性以及其与κ-酪蛋白间的相互作用,使得胶束表面κ-酪蛋白C-末端的“毛发”部分变得僵直,从而降低胶束的静电排斥作用和位阻作用,在酪蛋白分子间形成钙桥,导致乳蛋白产生絮凝[27]。关于钙对β-乳球蛋白和κ-酪蛋白相互作用的影响机制,目前研究较少。Smits等[28]发现,Ca2+可能通过与蛋白质中的离子基团形成复合Ca2+键,导致分子间排斥减少以及分子间疏水键的形成,对于较低浓度的β-乳球蛋白和酪蛋白胶束的热诱导结合具有促进作用。另外,在乳清相中添加钙离子可明显减少酪蛋白胶束中κ-酪蛋白的解离[29]。由此表明,增加乳清中钙离子含量可促进热处理后酪蛋白胶束-乳清蛋白聚集体的生成,而降低乳清蛋白聚集体在乳清相中的比例。
4 钙对乳蛋白功能特性的影响
4.1 钙对乳蛋白热稳定性的影响
钙离子在乳热处理时对酪蛋白胶束完整性具有重要作用。85 ℃及以上温度进行热处理时,对钙离子敏感的αs酪蛋白暴露,与游离的钙离子结合,从而减少表面电荷量,产生活性位点,胶束平衡发生破坏,酪蛋白发生凝聚,产生沉淀[17,30]。Singh等[29]发现,将不同钙含量乳在90 ℃处理10 min后,可溶性钙含量低于326 mg/kg时,所有酪蛋白发生解离,而增加乳中可溶性钙含量至434 mg/kg时,胶束中αs1酪蛋白、β-酪蛋白和κ-酪蛋白的解离则会被抑制。此时,钙离子与游离无机磷酸盐和柠檬酸盐的结合增加,促进磷酸钙和柠檬酸钙复合物在胶束中的形成,pH值降低,Zeta电位增加,同时酪蛋白与CCP通过非共价二硫键生成酪蛋白聚合体,导致乳中可溶性酪蛋白含量降低,胶束体系不稳定,热稳定性降低[31-33]。
当乳清蛋白溶液在65 ℃以上进行高温处理时,蛋白构象展开,活性氨基酸暴露,疏水作用增强。钙离子的存在不仅提高了α-乳白蛋白和β-乳球蛋白的热变性敏感度,还促进了乳清蛋白与钙离子结合形成钙-蛋白复合物,分子间的静电斥力减小,溶液产生絮凝,乳热稳定性降低[34]。
另外,螯合剂与钙离子结合对乳蛋白的热稳定性也会产生重要影响。当添加螯合剂时,乳中钙盐的含量和形式发生重要变化,可溶性钙浓度显著上升,而胶体钙浓度显著下降。郭本恒[35]认为,在pH 6.6~7.0范围内,初乳中加入0.002~0.020 mol/L的螯合剂乙二胺四乙酸,其可与乳中的游离钙结合,提高乳蛋白质的热稳定性(图4);加入0.2 mol/L乙二胺四乙酸,其在与游离钙结合的同时还会与CCP、酪蛋白争夺钙离子,从而破坏胶体平衡体系,降低乳蛋白的热稳定性。
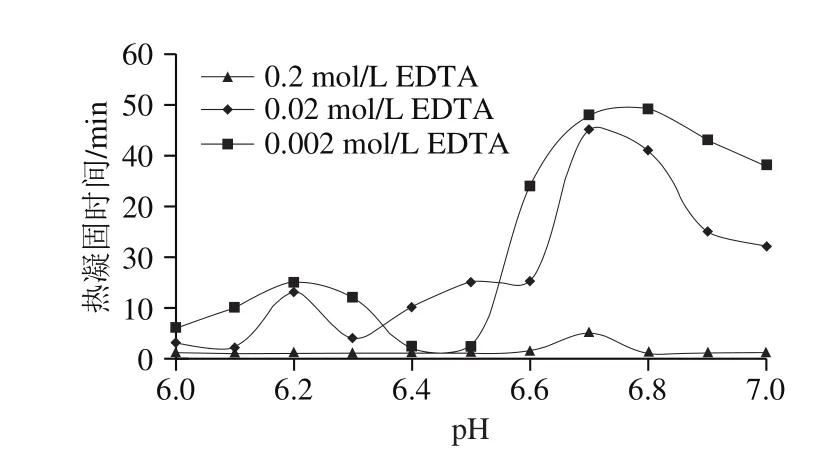
图4 钙对乳蛋白的稳定性的影响[35]Fig. 4 Effect of calcium on the stability of milk proteins[35]
4.2 钙对乳蛋白乳化特性的影响
钙离子与蛋白质结合,对蛋白质在油-水界面的吸附行为以及乳浊液的稳定性具有重要影响。如图5所示,浓缩乳蛋白(milk protein concentrate,MPC)溶液的乳化活性与其脱钙程度呈正相关,其乳化稳定性在脱钙率为20%~40%时逐步增强,特别是脱钙率40%的MPC溶液可获得较好的乳化活性和乳化稳定性[36]。其原因在于,酪蛋白胶束随钙离子的脱除发生一定程度的解离,蛋白分子在油-水界面的吸附性增强,与油相更好地结合,同时由于邻近蛋白间通过疏水相互作用在溶液表面形成薄膜,界面张力降低,表面活性蛋白增加,形成稳定的乳浊液,乳化能力增强[37-38]。
王耿等[39]指出,乳化前后添加钙离子均会导致乳浊液的稳定性降低。乳化前添加钙离子,乳蛋白特别是吸附在油滴表面的蛋白质会发生聚集,表面蛋白有效扩散受到限制,从而导致乳化液滴产生絮凝,其粒径增大,分子排列更加致密,蛋白间排斥力下降,表面蛋白负载增加,乳浊液的稳定性降低[40-41];在乳化后添加钙离子,亲和钙离子基团暴露,形成蛋白质-钙-蛋白质交联,从而造成蛋白质絮凝。

图5 钙对乳蛋白的乳化特性影响[36]Fig. 5 Effect of calcium on emulsifying properties of milk proteins[36]
4.3 钙对乳蛋白溶解性的影响
αs1酪蛋白、αs2-酪蛋白和β-酪蛋白的溶解性与钙离子浓度有关,而κ-酪蛋白的溶解性不受钙离子浓度变化的影响。钙离子浓度能够明显影响乳蛋白的溶解性。在钙离子浓度为1~3 mmol/L时,钙离子与磷酸丝氨酸基团和羧基化基团结合,大部分结合酪蛋白仍保持溶解,浊度稍微增加;在钙离子浓度达到3~5 mmol/L时,钙离子继续与羧基化基团结合,减少静电排斥,酪蛋白溶解性呈现急剧下降,溶液浊度迅速增加最终形成沉淀[11]。有研究学者认为,酪蛋白的聚集导致MPC溶解度的降低,而钙离子的脱除减少了蛋白之间的非共价交联,促进MPC的溶解[42]。刘大松等[43]通过测定不同脱钙程度的MPC在不同贮藏时间的溶解度(图6)发现,脱钙率11%~37%的MPC溶液初始溶解度较未脱钙MPC溶液的初始溶解度高,脱钙程度与初始溶解度呈正相关;35 ℃培养箱中贮藏112 d,脱钙率越高的MPC,溶解度随贮藏时间延长降低得越慢,脱钙率11%~19%对MPC溶液溶解度的降低具有延缓作用,脱钙率19%及以上对MPC溶液溶解度降低具有显著的控制作用,在此条件下,溶解度良好且均达到90%以上。
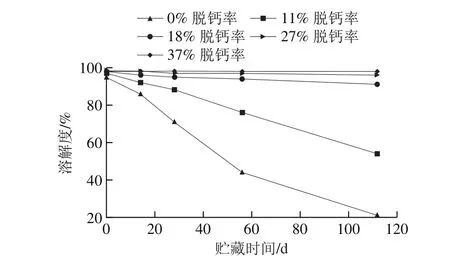
图6 钙对乳蛋白的溶解性影响[43]Fig. 6 Effect of calcium on the solubility of milk proteins[43]
4.4 钙对乳蛋白起泡特性的影响
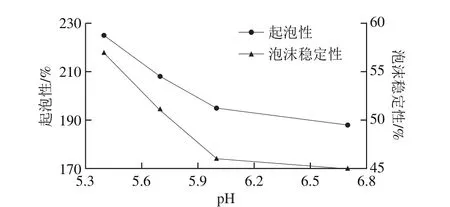
图7 钙对乳蛋白的起泡特性影响[47]Fig. 7 Effect of calcium on foaming properties of milk proteins[47]
乳蛋白的起泡特性不仅与其在空气-水界面的表面张力有关,其亦与钙离子浓度相关[44-45]。在乳清蛋白溶液中,Ca2+浓度为0.02~0.40 mol/L时,蛋白质分子发生交联,形成黏弹性较好的膜,蛋白溶液的起泡性得到显著改善[46]。乳中钙离子的脱除对浓缩乳蛋白的起泡性具有促进作用。刘大松[47]通过对不同pH值诱导脱钙处理的MPC溶液进行起泡性和泡沫稳定性(图7)的测定时发现,pH值从6.7降低到6.0的酸化条件下,脱钙率从37%增加到55%,MPC溶液的起泡性和泡沫稳定性略有增加;pH值从6.0降低到5.4的酸化条件下,脱钙率从55%增加到82%,MPC溶液的起泡性和泡沫稳定性显著提高,且脱钙程度与起泡性和泡沫稳定性呈正相关。钙离子的脱除使得胶束酪蛋白解离速度加快,游离酪蛋白含量增多,从而加快在泡沫体系中形成稳定的界面膜,界面张力降低,泡沫体系黏度增加,溶液的起泡性和泡沫稳定性增加[48]。
4.5 钙对乳蛋白凝胶特性的影响
研究表明,牛奶的凝胶化可能由多种因素共同引起,比如CCP含量的增加;通过钙离子聚集牛奶中加热的乳清蛋白;钙离子诱导乳的pH值降低等。因此,钙与乳蛋白的凝胶特性具有明显相关性[49-50]。Ramasubramanian等[51]研究表明,在未预热的牛乳中添加10 mmol/L和12.5 mmol/L氯化钙,加热不会导致乳凝胶的产生,但会明显增加牛乳样品的黏度;而分别在未预热的牛乳中添加15、17.5 mmol/L和20 mmol/L氯化钙时,牛乳样品的黏度增加,并且伴随着凝胶的形成。其原因在于,在乳中添加可溶性钙盐,乳中钙离子含量增加,引起CCP含量增加,乳中pH值降低,胶束之间的静电排斥作用下降,从而诱导加热乳凝胶的发生[52]。
钙的脱除对乳凝胶形成具有抑制作用。徐雨婷[36]将脱钙MPC凝胶进行激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)和扫描电子显微镜(scanning electron microscope,SEM)观察,发现未脱钙MPC凝胶的组织结构紧密,蛋白分布均匀;11.1%钙脱除使得凝胶出现空隙,结构变得疏松,影响形成凝胶的强度,但并未阻碍其凝胶结构的形成;18.6%~37.1%钙脱除使得凝胶结构卷曲程度增加,空隙数量增多,孔径增大,凝胶强度降低,阻碍凝胶网络结构的形成(图8中A1~A4、I~IV)。当用氯化钙来回补脱钙MPC系统时,发现可溶性钙的回补可促进蛋白间的交联,使其形成凝胶结构。11.1%~18.6%脱钙MPC溶液进行钙的回补后,可基本恢复未脱钙时的凝胶结构,37.1%脱钙MPC溶液进行钙的回补后,则无法恢复原状(图8B1~B4、V~VIII)。
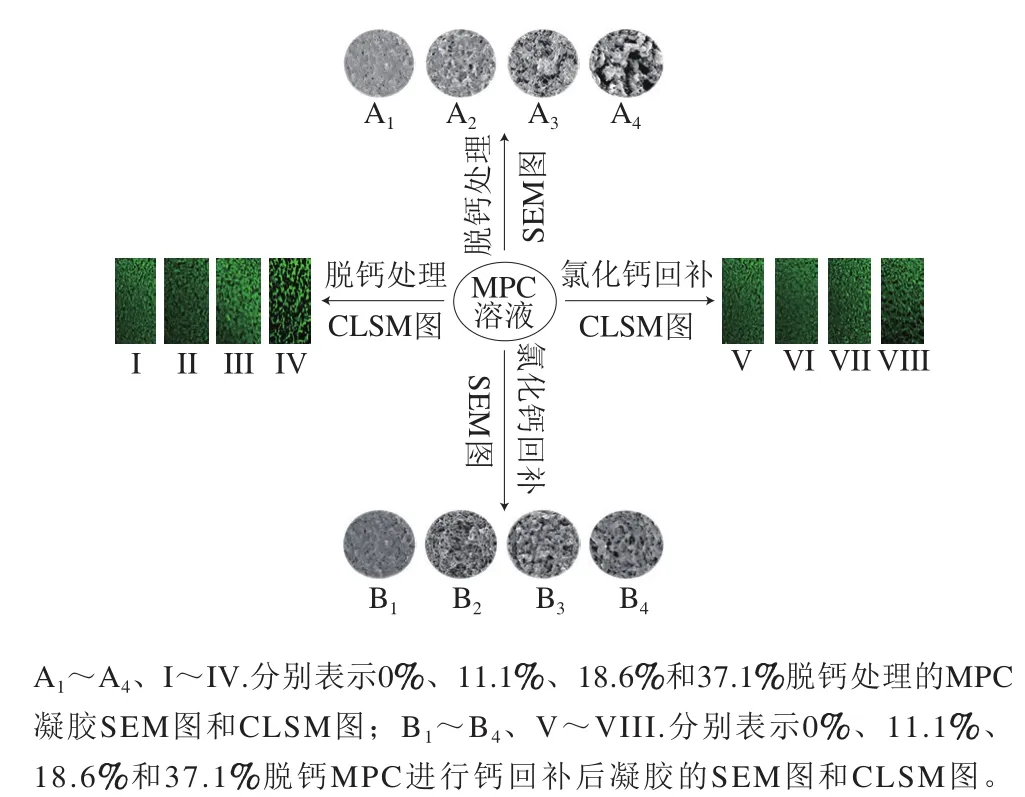
图8 不同脱钙处理MPC的凝胶特性[36]Fig. 8 Gel characteristics of milk protein with different decalcification treatments[36]
5 结 语
随着对钙与乳蛋白相互作用的深入研究,针对其功能特性应用于乳品生产中,具有巨大的潜在市场。胡锦华等[27]通过蛋白与难溶性钙盐的相互作用制得一种新型钙增强剂,可将其应用于速溶型高钙乳粉的生产中。Ganugapati[53]通过离子交换脱钙处理乳蛋白保留物得到一种干燥蛋白成分,可将其应用于乳化或蛋白质稳定的食品生产中。钙的脱除引起乳的起泡性和泡沫稳定性增强,这可扩宽其在搅拌奶油、奶油蛋糕等食品中的应用;脱钙引起乳化能力增强,可扩宽其在巧克力、饼干等食品中的应用;脱钙引起溶解性增强,可扩宽其在半透明或透明饮料中的应用;而对于钙含量增加使乳凝胶性增强这一特点,可将其应用于酸奶等发酵食品中。因此,乳中钙离子含量的高低是获得不同需求乳制品的关键。目前,虽有许多研究报道了钙与乳蛋白的相互作用及其功能特性,但是研究内容较片面。不同乳源所含蛋白质组成不同,其与钙离子的作用机理也不尽相同,由此所产生的功能性质有待进一步的研究。继续开展不同乳源中钙与蛋白质相互作用的研究,根据其不同的功能特性将其应用于功能性乳制品的生产中具有重要实际意义,可为实际生产提供理论支持。
