没食子酸酯类化合物对食品中1,2-二羰基产物的清除效果
2019-10-30王佳琦肖留榜章鼎敏郑铁松吕丽爽
王佳琦,肖留榜,王 茜,章鼎敏,郑铁松,吕丽爽*
(南京师范大学食品与制药工程学院,江苏 南京 210097)
20世纪以来,因1,2-二羰基化合物(乙二醛(glyoxal,GO)、甲基乙二醛(methylglyoxal,MGO))对生物体健康存在一定毒害作用,受到食品、医药领域广泛关注。GO与MGO结构如图1所示。GO、MGO均具有细胞毒性,GO能抑制细胞中DNA的合成,并可损伤线粒体功能[1],MGO则通过特定的凋亡信号引起细胞凋亡[2-3]。此外,GO、MGO属于高反应活性糖基化因子[4],因而可与氨基酸及蛋白质的游离氨基发生反应形成一系列不可逆转、稳定的晚期糖基化终末产物(advanced glycation end products,AGEs)。AGEs在体内会引起羰基应激和氧化应激反应,导致组织损伤[5],损害机体免疫系统,诱发糖尿病及糖尿病并发症[6]、阿尔茨海默症[7]、动脉粥样硬化[8]等。
图1 GO(A)与MGO(B)的结构Fig. 1 Structures of GO (A) and MGO (B)
GO和MGO的来源主要分为内源性和外源性,内源性GO和MGO的来源包括体内糖降解、非酶糖化、丙酮体内代谢及氨基丙酮氧化分解等;外源性GO和MGO的来源主要为蛋白质和糖含量高的加工类食品及饮料,如曲奇饼干、蛋糕、酸奶、蜂蜜等[9-11]。食品经热加工处理或长期贮藏中发生的Maillard反应[12]、油脂的氧化[13]、焦糖化反应[14]以及微生物发酵过程[15]均能导致食物中1,2-二羰基化合物含量增高。
目前,国内外关于清除1,2-二羰基化合物的研究主要集中于天然黄酮类、酚酸类物质[16]。Wu等[17]发现芦丁和木犀草素对MGO及AGEs有清除效果,部分归因于黄酮类化合物的抗氧化性。此外,白藜芦醇也被报道有清除MGO活性的作用[18]。Liu Guimei等[19]发现槲皮素不仅可以捕获MGO,而且其与MGO的加合产物仍有清除α-羰基化合物的能力。Sang Shengmin[20]、Shao Xi[21]及Lü Lishuang[22]等研究表明,儿茶素、根皮素、根皮苷可以有效地捕获体系中GO或MGO,与其形成相应的加合产物,进而清除由GO、MGO介导的蛋白质糖基化形成的AGEs;尽管黄酮、酚酸类物质大多为天然活性产物,有良好的清除效果,但考虑到黄酮类化合物尚未获批为食品添加剂被广泛应用于食品工业,且溶解性、稳定性不佳,以及部分色泽鲜艳及具有特殊气味,使得其应用存在局限性。因此,寻找在食品中能广泛使用的GO、MGO清除剂,对减少外源性1,2-二羰基化合物的摄入、提高食品安全性、预防因不良饮食引发慢性疾病具有重要理论和现实意义。
具有优良抗氧化活性的没食子酸酯类物质由没食子酸与相应的醇酯化反应生成,碳链的延长使其脂溶性与安全性得到增强[23],其中可作为食品抗氧化剂的没食子酸酯类包括没食子酸丙酯(propyl gallate,PG)、没食子酸辛酯(octyl gallate,OG)、没食子酸十二烷酯(dodecyl gallate,DG)等,PG、OG、DG的结构式见图2。目前国内外对于没食子酸酯类物质的研究主要集中在抗氧化活性、抑菌活性以及分析检测方面[23-25]。Shao Xi等[26]研究发现没食子酸清除MGO的能力较差,37 ℃条件下没食子酸与MGO反应24 h后,对MGO的清除率仅为14.9%,但对焦没食子酸清除率达90%;而关于没食子酸酯类物质PG、OG、DG对GO、MGO的清除能力及作用机理有待进一步考证。本课题组前期研究了PG对MGO的捕获机理[27],本实验侧重研究PG、OG、DG对GO、MGO的作用活性,考察影响PG、OG、DG清除GO、MGO的因素,以及其在食品中的具体应用。
图2 PG(A)、OG(B)和DG(C)的化学结构Fig. 2 Chemical structures of PG (A), OG (B) and DG (C)
本研究通过气相色谱法探究食品添加剂没食子酸酯类物质(PG、OG、DG)对1,2-二羰基化合物的清除率,考察清除剂浓度、反应体系pH值、反应温度与时间对PG、OG、DG清除GO和MGO效果的影响。此外,选择蛋白、糖及油脂含量高的休闲类烘烤食品曲奇饼干,验证PG、OG、DG对GO和MGO的清除效果,并采用高效液相色谱-串联质谱(high performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)技术分析曲奇饼干中PG、OG、DG清除GO和MGO的途径及机制,以期为调控食物加工贮藏过程中有害物质(GO、MGO)含量提供有效的理论指导,从而保障食品安全。
1 材料与方法
1.1 材料与试剂
鸡蛋、黄油及白砂糖购自南京鼓楼区苏果超市;高筋小麦粉及低筋小麦粉购自深圳南海粮食工业有限公司。
MGO(质量分数40%溶液)、GO(质量分数40%溶液)、邻苯二胺(分析纯) 美国Sigma-Aldrich公司;OG、DG(分析纯) 日本东京化成工业株式会社;PG、2,3-丁二酮、乙醛、乙酸、二氯甲烷、葡萄糖、甲醇(色谱纯)、乙腈(色谱纯) 上海国药集团化学试剂有限公司;精氨酸 上海生工生物工程有限公司。除特殊说明外,其他试剂均为分析纯。
1.2 仪器与设备
7820A气相色谱仪(HP-5色谱柱、火焰离子化检测器)、1290/6460 Triple Quad LC/MS HPLC-MS/MS仪美国Agilent公司;CentriVap离心浓缩仪 美国Labconco公司;Biofuge Stratos离心机、ULT1386-3V型超低温冰箱美国Thermo Scientific公司;SHZ-82型水浴振荡器 常州华怡仪器制造有限公司;HH-S型恒温油浴锅 金坛市医疗仪器厂;KQ-300B型超声波清洗器 昆山超声仪器有限公司;AUY220型分析天平 日本岛津公司;PHS-3C型数字式pH计 上海三信仪表厂;XW-80A型微型漩涡混合仪 上海沪西分析仪器厂有限公司;YXP 101-2型商用电烤炉 上海早苗食品有限公司;FW177型高速万能粉碎机 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 气相色谱法分析GO、MGO的含量
气相色谱条件参照本实验室建立的方法[28],衍生化方法优化如下:于样品管内依次加入1 mL待测反应液、0.5 mL 0.1 mmol/L 2,3-丁二酮(内标)及1 mL 0.1 mol/L邻苯二胺(衍生化试剂),漩涡混匀,37 ℃水浴振荡60 min,冰浴后加入1 mL 2 mol/L乙醛,混匀,37 ℃水浴振荡60 min,冰浴后加入3 mL二氯甲烷,漩涡混匀、超声萃取2 次。离心浓缩至干,加入200 μL二氯甲烷复溶,取1 μL进行气相色谱仪检测。按下式计算清除率。

1.3.2 HPLC-MS/MS分析PG、OG、DG结构变化
1.3.2.1 HPLC条件
Kromasil100-5 C18色谱柱(250 mm×4.6 mm,5 μm);紫外检测器;柱温30 ℃;进样量10 μL;检测波长270 nm;流动相流速0.6 mL/min;流动相A:水,流动相B:乙腈,流动相C:甲醇。PG洗脱程序:0~3 min,30% C;3~20 min,30%~70% C;20~30 min,70% C。OG洗脱程序:0~3 min,70% B;3~10 min,70%~80% B;10~13 min,80%~100% B;13~19 min,100%~30% B;19 min,30% B。DG洗脱程序:0~3 min,90% B;3~15 min,90%~100% B;15~16 min,100% B。
1.3.2.2 MS/MS条件
电喷雾负离子模式电离,MS1为MS2Scan模式,MS2为Product Ion模式,扫描范围为m/z 100~500;喷雾电压3 500 kV;雾化气压力45 psi;辅助气压力5 psi;相对碰撞能量20 eV;毛细管温度300 ℃;裂解电压200 eV;气体流速5.1 L/min。数据采集使用Masshunter软件进行定性分析。
1.3.3 影响PG、OG、DG清除GO、MGO效果的因素分析
1.3.3.1 PG、OG、DG浓度对清除GO、MGO效果的影响
向玻璃小瓶中分别加入2.0 mL浓度分别为0.01、0.1、1.0、2.0、4.0 mmol/L的PG(或OG、DG)甲醇溶液和2.0 mL 0.1 mol/L pH 7.0的磷酸盐缓冲液(phosphate buffered saline,PBS)(含0.33 mmol/L GO或MGO),漩涡混匀,90 ℃油浴锅中避光反应30 min后迅速取出置于冰水浴中冷却。对照组为GO/MGO溶液和甲醇溶液(无PG/OG/DG)的反应液。取1.0 mL样品按照1.3.1节方法测定并计算体系中GO或MGO清除率。每个样品做3 组平行。
1.3.3.2 pH值对PG、OG、DG清除GO、MGO效果的影响
向玻璃小瓶中分别加入pH值为5.5、6.5、7.0、8.0的PBS配制的0.33 mmol/L GO(或MGO)溶液2.0 mL,加入1.0 mmol/L的PG(或OG、DG)甲醇溶液2.0 mL,漩涡混匀,在90 ℃油浴锅中避光反应30 min后迅速取出置于冰水浴中冷却。取1.0 mL样品按照1.3.1节方法测定并计算体系中GO或MGO清除率。每个样品做3 组平行。
1.3.3.3 不同反应温度与反应时间对PG、OG、DG清除GO、MGO的影响
向玻璃小瓶中分别加入2.0 mL 0.1mol/L pH 7.0的PBS(含0.33 mmol/L GO或MGO)和2.0 mL 1.0 mmol/L PG(或OG、DG)甲醇溶液,漩涡混匀后分成3 个温度处理组,分别为:90 ℃水浴加热5、10、15、30、40 min;60 ℃水浴加热10、30、60、120、240 min;25 ℃水浴锅中避光反应1、2、3、5、8 d。加热后迅速取出置于冰水浴中冷却。取1.0 mL样品按照1.3.1节方法测定并计算体系中GO或MGO清除率。每个样品做3 组平行。
1.3.4 PG、OG、DG对氨基酸-糖体系中GO、MGO形成的影响
1.3.4.1 精氨酸-葡萄糖体系中GO、MGO形成过程研究
向耐高温玻璃小瓶中分别加入2 mL 180 mmol/L精氨酸溶液(0.2 mol/L、pH 7.0的PBS配制)和2 mL 180 mmol/L葡萄糖溶液(0.2 mol/L、pH 7.0的PBS配制),再加入2 mL PBS使其终体积为6 mL。漩涡混匀后170 ℃油浴加热,分别反应0、5、15、30、40、60 min后迅速取出置于冰水浴中冷却。取1.0 mL样品按照1.3.1节方法测定并计算体系中GO或MGO清除率。每个样品做3 组平行。
1.3.4.2 PG、OG、DG对精氨酸-葡萄糖体系中形成的GO、MGO清除效果的影响
参考文献[19]方法,将1.3.4.1节中的2 mL PBS替换成2 mL浓度为5、20、100、200 μmol/L PG(或OG、DG)甲醇溶液,漩涡混匀,170 ℃油浴加热30 min后迅速取出,置于冰水浴中冷却。取1.0 mL样品按照1.3.1节方法测定并计算体系中GO或MGO清除率。每个样品做3 组平行。
1.3.5 PG、OG、DG清除曲奇饼干中GO、MGO的能力及机制分析
1.3.5.1 曲奇样品的制备
称取两份54 g黄油,加热融化后,向实验组黄油中添加5.4 mg PG(或OG、DG),对照组不添加,分别融化搅拌均匀后,加入40 g高筋面粉与20 g低筋面粉,充分搅拌后,放入裱花袋挤至烤盘,每个曲奇质量为5 g。之后置于烤箱,上火180 ℃,下火170 ℃,烘烤15 min。
1.3.5.2 PG、OG、DG清除曲奇饼干中GO、MGO的活性分析
称取1 g粉碎的曲奇样品置于15 mL离心管中,加入5 mL蒸馏水,漩涡混合3 min,8 000 r/min离心10 min,取上清液。向离心管中再加入5 mL、体积分数50%甲醇水溶液,漩涡混合后超声萃取1 h,8 000 r/min离心10 min,取出上清液。两次上清液合并均匀后,取出3 mL样品按照1.3.1节方法测定并计算体系中GO或MGO清除率。每个样品做3 组平行。
1.3.5.3 HPLC-MS/MS分析曲奇饼干中PG、OG、DG清除GO、MGO的机制
称取30 g曲奇样品,置于250 mL锥形瓶,加入120 mL甲醇,磁力搅拌提取2 h,离心浓缩后过滤膜收集滤液备用,按照1.3.2节方法进行HPLC-MS/MS检测。
1.4 数据处理与分析
实验均做3 组平行,采用Excel 2013软件作图,SPSS 13.0软件进行数据统计分析,采用Duncan’s检验,显著性水平为P<0.05。
2 结果与分析
2.1 PG、OG、DG浓度对清除GO和MGO能力的影响
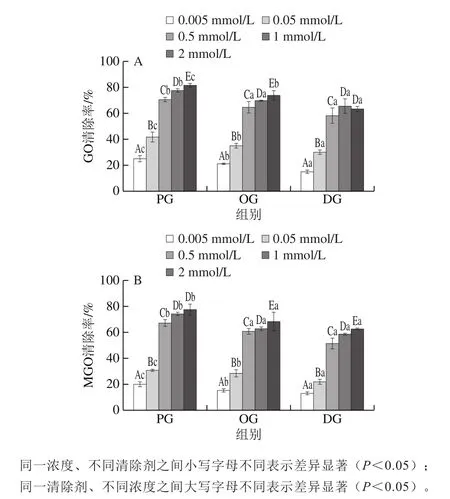
图3 不同浓度PG、OG、DG对GO(A)和MGO(B)的清除效果Fig. 3 Scavenging effects of different concentrations of PG, OG and DG on GO (A) and MGO (B)
由图3可知,PG、OG、DG对GO、MGO的清除效果均随着浓度的升高而增强。当清除剂终浓度由0.05 mmol/L提高至0.5 mmol/L时,对GO、MGO的清除率显著增加,终浓度0.5 mmol/L PG、OG、DG对GO的清除率分别为70.5%、64.8%、58.5%,对MGO的清除率分别为67.6%、61.3%、51.8%,对MGO清除效果略低于GO。此外,在相同的添加浓度下,3 种清除剂的清除效果为PG>OG>DG,推测应为随着没食子酸烷基酯(PG、OG、DG)碳链的增长,空间位阻增大,相应减少了活性位点与1,2-二羰基化合物的接触,进而影响了清除效果。
2.2 体系pH值对PG、OG、DG清除GO和MGO能力的影响
pH值是影响酚酸类化合物捕获二羰基化合物的重要因素[29-30]。如图4所示,随着pH值增大(5.5~8.0),3 种清除剂对GO、MGO的清除率显著升高(P<0.05),当pH值为8.0时,PG、OG、DG对GO和MGO的清除率均达75%以上,其中PG对GO的清除率为89.1%,为pH 5.5时(22.3%)的4.0 倍。Cui Hengqing等[27]研究发现,PG捕获MGO是通过由酚羟基邻位的苯环碳进攻MGO的不饱和碳碳双键,发生迈克尔加成反应,而迈克尔加成反应更易发生于碱性条件,因此相比于酸性条件,中性及碱性条件下酚酸类化合物清除二羰基化合物效果更好。

图4 不同pH值下PG、OG、DG对GO(A)、MGO(B)的清除效果Fig. 4 Scavenging effects of PG, OG and DG on GO (A) and MGO (B)under different pH levels
2.3 反应温度与时间对PG、OG、DG清除GO、MGO能力的影响
2.3.1 加热条件下反应时间对PG、OG、DG清除GO、MGO能力的影响
2.3.1.1 90 ℃条件下反应时间对PG、OG、DG清除GO、MGO能力的影响
如图5所示,90 ℃反应条件下,0~15 min内,随着反应时间的延长,清除剂对GO、MGO的清除率快速增加,其中反应5 min时PG对GO的清除率已达30.4%,但对MGO的清除率仅为15.3%;15 min以后清除率上升变缓,30 min后逐渐趋于稳定。整个过程中,清除效果为PG>OG>DG。


图5 90 ℃条件下PG、OG、DG对GO(A)、MGO(B)的清除效果Fig. 5 Scavenging effects of PG, OG and DG on GO (A) and MGO (B)at 90 ℃
2.3.1.2 60 ℃条件下反应时间对PG、OG、DG清除GO、MGO能力的影响
60 ℃中温加热条件下,随反应时间延长(0~240 min),PG、OG、DG对GO、MGO清除率不断升高,并且3 种清除剂的清除效果差别越来越大。30 min内,OG、DG对GO清除率仅相差0.2%,但240 min时已相差15.9%;相比于OG、DG,PG具有更高的清除GO、MGO能力。此外,PG、OG、DG对GO的清除效果优于MGO,在加热240 min时,PG、OG、DG对GO的清除率分别为81.9%、76.2%、60.1%,而对MGO的清除率则为65.1%、58.8%、42.4%。
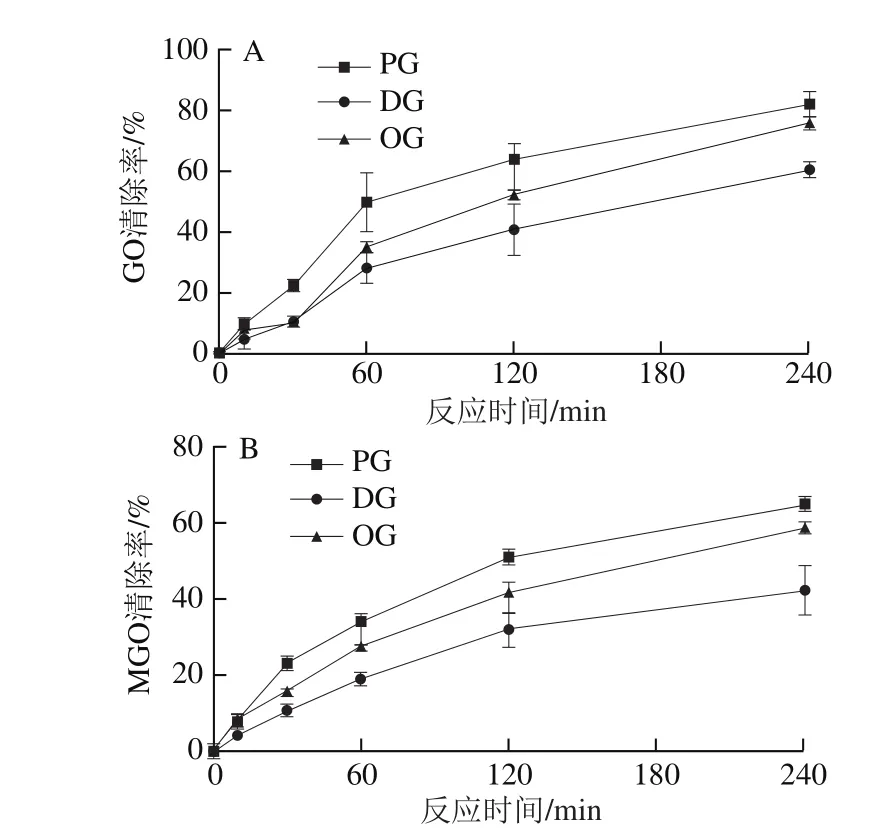
图6 60 ℃条件下PG、OG、DG对GO(A)、MGO(B)的清除效果Fig. 6 Scavenging effects of PG, OG and DG on GO (A) and MGO (B)at 60 ℃
2.3.2 室温条件下反应时间对PG、OG、DG清除GO、MGO能力的影响

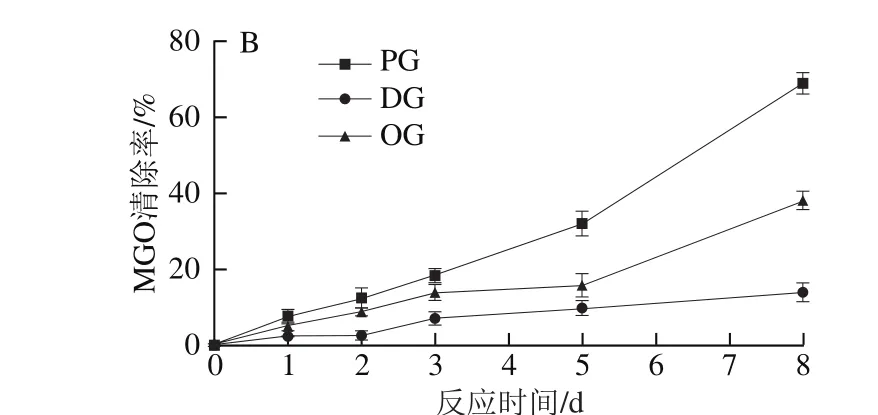
图7 室温条件(25 ℃)下PG、OG、DG对GO(A)、MGO(B)的清除效果Fig. 7 Scavenging effects of PG, OG and DG on GO (A) and MGO (B)at 25 ℃
富含蛋白质和还原糖的食品在贮藏过程中也易发生美拉德反应,产生晚期糖基化终末产物及其中间产物GO、MGO[9,31],从而降低食品的品质和安全性,因此本实验在室温贮藏(25 ℃)条件下,考察PG、OG、DG对GO、MGO的清除效果。如图7所示,随着反应时间(0~8 d)的延长,PG、OG、DG对GO、MGO的清除率不断增加。0~2 d时3 种清除剂清除GO、MGO的能力均差异不大,3 d后差异逐渐明显,第8天时PG对GO、MGO的清除率分别为82.8%、69.1%,分别为DG对GO、MGO清除能力的3.4、4.9 倍。对比来看,3 种清除剂对GO的清除效果整体高于对MGO的清除效果,对GO、MGO清除效果由强至弱为PG>OG>DG。可见PG更适宜用作GO、MGO的长效清除剂。
前文的分析中,详细描述了这种列车网络通信故障产生的原因,既有线路通信质量的原因,又有源设备与RPT配合的原因。根据笔者的项目经验,给出针对这种故障的解决方案。
2.4 PG、OG、DG对氨基酸-糖体系中GO、MGO形成的影响
2.4.1 精氨酸-葡萄糖体系中GO、MGO变化过程

图8 精氨酸-葡萄糖体系中GO、MGO的生成量Fig. 8 Production of GO and MGO in Arg-glucose system
如图8所示,170 ℃加热条件下精氨酸-葡萄糖体系中,随着反应时间的延长(0~60 min),GO、MGO的生成量逐渐增加,在0~5 min内,GO、MGO浓度增加最为迅速。在体系反应的整个过程中,MGO的生成量高于GO,60 min时GO、MGO浓度分别为0.349、0.731 mmol/L,MGO浓度为GO的2.09 倍。这与马毛毛[32]的研究结果一致。GO、MGO来源主要为:氨基酸与还原糖发生美拉德反应,反应初期形成Amadori产物,产物重排后经过缩合降解反应生成GO、MGO[33]。此外,单糖自氧化会产生MGO并不断积累[34],这是该体系MGO生成量高于GO的原因之一。
2.4.2 PG、OG、DG清除氨基酸-糖体系中GO、MGO的效果
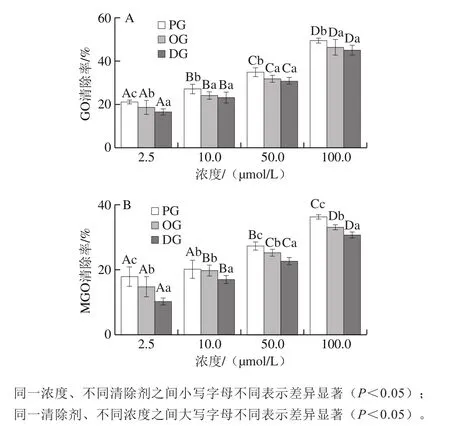
图9 精氨酸-葡萄糖体系中PG、OG、DG对GO(A)、MGO(B)的清除效果Fig. 9 Scavenging effects of PG, OG and DG on GO (A) and MGO (B)in Arg-glucose system
如图9所示,在精氨酸-葡萄糖体系中PG、OG、DG对GO、MGO均有清除效果,并且PG、OG、DG的清除能力依次递减;随着体系清除剂浓度的增加,对GO、MGO的清除效果逐渐增加。当PG终浓度为2.5 μmol/L时,对GO、MGO的清除率分别为21.2%、18.0%,差异较小;而PG终浓度提高至100 μmol/L时,对GO、MGO的清除率分别达到49.8%、36.2%,两者相差13.6%。
2.5 PG、OG、DG对曲奇饼干中GO、MGO清除能力的研究

图10 曲奇饼干中PG、OG、DG对GO、MGO的清除效果Fig. 10 Scavenging effects of PG, OG and DG on GO and MGO in cookies
如图10所示,PG、OG、DG在曲奇饼干中仍具有清除GO、MGO的活性,并且活性由强至弱依次为PG、OG、DG。相比于清除MGO,清除剂对GO的清除能力更强。其中,PG对GO的清除效果最佳,为44.51%;DG对MGO的清除率最低,为21.19%。
2.6 PG、OG、DG清除GO和MGO的机制分析
2.6.1 PG清除曲奇饼干中GO、MGO机制
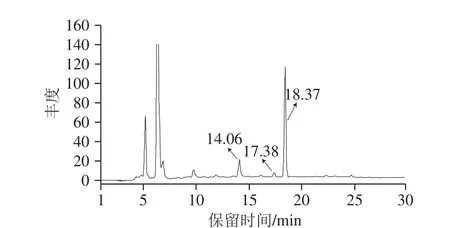
图11 PG清除曲奇饼干中GO和MGO的HPLC图Fig. 11 High performance liquid chromatogram showing PG scavenging of GO and MGO in cookies
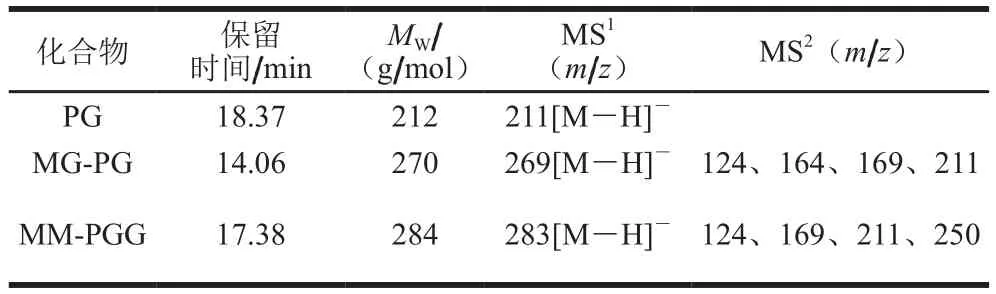
表1 曲奇饼干中MG-PG及MM-PG的ESI-MS/MS碎片离子Table 1 ESI-MS/MS fragment ions of MG-PG and MM-PG in cookies
如图11所示,除检测到PG主峰(18.37 min)外,出现了保留时间为14.06 min的色谱峰。在MS1质谱中(表1)ESI-MS(m/z)准分子离子峰是269[M-H]-,比PG(m/z 211)高58;在MS2质谱中出现m/z 211(PG),推测MG-PG为PG与1 分子GO形成的加合产物。
2.6.2 OG清除曲奇饼干中GO、MGO机制
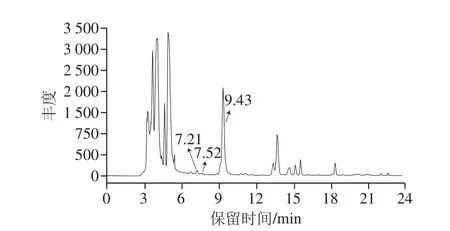
图12 OG清除曲奇饼干中GO和MGO的HPLC图Fig. 12 High performance liquid chromatogram showing OG scavenging of GO and MGO in cookies
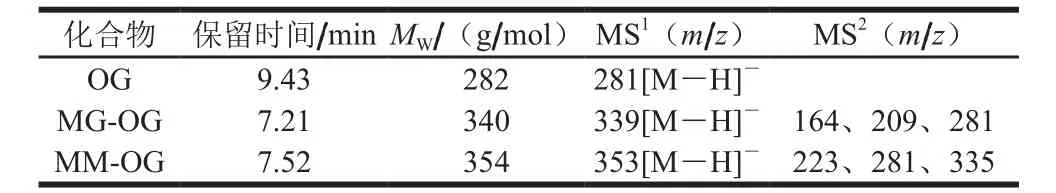
表2 曲奇饼干中MG-OG及MM-OG的ESI-MS/MS碎片离子Table 2 ESI-MS/MS fragment ions of MG-OG and MM-OG in cookies
由图12可知,液相色谱图中除出现OG色谱峰外,还出现了保留时间分别为7.21、7.52 min的两个色谱峰。对于保留时间7.21 min的峰,其MS1质谱中(表2)ESI-MS(m/z)准分子离子峰为339[M-H]-,比OG(m/z 281)高58;在MS2质谱中,出现碎片离子m/z 281(OG),推测为OG与1 分子GO形成的加合产物MG-OG。
对于保留时间7.52 min的峰,MS1质谱中ESI-MS(m/z)准分子离子峰为353[M-H]-,比OG高72;在MS2质谱中,出现碎片离子m/z 281,推测为OG与1 分子MGO形成的加合产物MM-OG。因此,OG在曲奇饼干加工过程中,可以有效捕获1 分子GO或MGO形成单加合产物MG-OG或MM-OG,从而达到清除GO、MGO的效果,此作用机制与PG相同。
2.6.3 DG清除曲奇饼干中GO、MGO机制
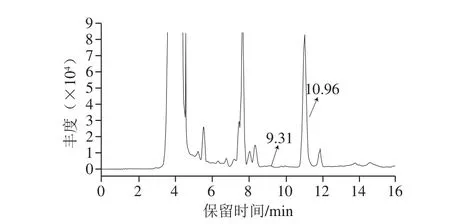
图13 DG清除曲奇饼干中GO和MGO的HPLC图Fig. 13 High performance liquid chromatogram showing DG scavenging of GO and MGO in cookies

表3 曲奇饼干中MG-DG的ESI-MS/MS碎片离子Table 3 ESI-MS/MS fragment ions of MG-DG in cookies
由图13可知,添加了DG的曲奇饼干的HPLC图中,尽管响应值低,但出现保留时间9.31 min的色谱峰,其MS1质谱中(表3)ESI-MS准分子离子峰是395[M-H]-,比DG(m/z 337)高58;在MS2质谱中,出现碎片离子m/z 337(OG),推测为DG与1 分子GO形成的加合产物MG-DG。该体系中未检出DG与MGO形成的加合产物,这可能与DG对MGO清除率较低有关。
3 结 论
本实验证明了PG、OG、DG具有清除1,2-二羰基化合物GO和MGO的活性。PG、OG、DG对GO和MGO的清除能力均随着浓度的升高而增强,在相同的添加浓度下,清除能力从大到小依次为PG>OG>DG。随着体系pH值(5.5~8.0)增加,3 种清除剂对GO和MGO的清除率显著升高;在不同温度下(25~90 ℃),PG、OG、DG均随反应时间的延长对GO、MGO清除率逐步增大,并且对GO的清除能力优于MGO。PG对GO、MGO清除能力最佳,适合作为长效清除剂使用,25 ℃反应8 d后对GO、MGO清除率分别为82.8%、69.1%。此外,在模拟食品加工精氨酸-葡萄糖体系及食品加工体系曲奇饼干中验证了PG、OG、DG对GO、MGO存在清除效果,并在曲奇饼干体系采用HPLC-MS/MS技术分析其清除机制为:PG、OG、DG能捕获GO、MGO,形成相应加合产物。
