谷子对黑粉菌侵染的生物学响应
2019-10-25闫志鹏仪慧兰张艾英郭二虎
闫志鹏,仪慧兰,张艾英,郭二虎
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院谷子研究所,山西长治046011)
谷子(Setaria italica(L.)Beauv.),属禾本科,又称稷或粟,最早起源于我国,在我国有8 000 多年的种植历史。由于其具有耐旱、耐瘠、抗逆性强、适应性广等生物学特性,在我国北方的干旱和半干旱地区广泛种植[1]。近年来,谷子种植面积不断增大,各类病害的发生率也随之增大,对其产量和品质造成严重影响[2]。其中,谷子黑穗病是谷子生产中的一种常见病害,按照发病特征分为粒黑穗病、腥黑穗病和黑粉病3 种类型,山西产区内谷子粒黑穗病占绝大部分[3]。谷子粒黑穗病由真菌性病原菌——黑粉菌引发,主要通过种子传播[4],传播的主要途径为:谷子采收过程中病原菌污染种子,次年播种时随着种子进入谷田并同时萌发,从而侵入幼苗,在植株体内生长蔓延,最终侵入子房,产生孢子,形成黑穗[5]。
在遭遇病原菌时,植物可依靠自身固有的免疫系统和诱导抗性抵御病原菌侵染。植物能产生多种抗菌物质,病原菌可诱导植物细胞活性氧爆发,介导苯丙烷合成途径产生较多的类黄酮、木质素、总酚等,使抗氧化酶和病程相关蛋白(PR)表达增强、抗病相关酶(几丁质酶和β-1,3-葡聚糖酶)活性提高,植株获得系统抗性。有研究表明,谷子感染黑粉菌后,抗病品种体内超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)活性都显著高于感病品种,表明这些酶活性的增强有助于谷子对黑粉菌的防御[6]。不同品种谷子的遗传基础不同,对黑穗病的抗性存在一定差异。但目前关于谷子抗黑穗病的作用机制尚不清楚。
本研究在筛选谷子黑穗病高抗品种冀谷20 和敏感品种长农35 的基础上,对植株抗病生理过程中次生代谢途径及其产物量、抗病酶活性及抗病相关基因转录进行分析,以期为谷子抗病机制的研究和抗性育种提供试验依据。
1 材料和方法
1.1 试验材料
连续3 a 田间试验统计不同谷子品种黑穗病发病率,参照温琪汾等[7]关于谷子黑穗病抗性水平分级标准,选出对黑粉菌抗性水平差异较大的2 个品种(表1)[8]作为室内试验供试品种。供试黑粉菌菌种为2017 年采集于试验田中发病植株的黑穗病菌冬孢子,经揉搓、过筛得到[8]。
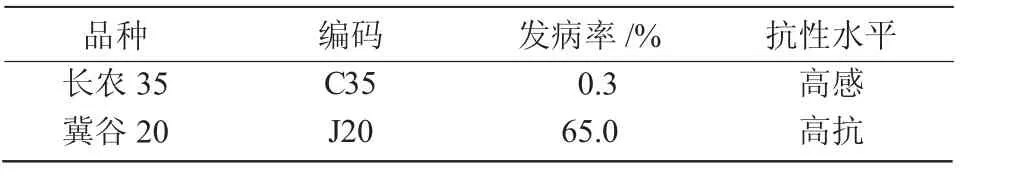
表1 供试谷子品种的发病率及抗性水平
1.2 试验方法
试验设对照组谷种(CK-J20、CK-C35)未拌菌,拌菌组谷种(I-J20、I-C35)人工拌黑粉菌,对照组与拌菌组同期播种于育苗盆中,于室内(25±2.0)℃培养,相对湿度47%~63%,光照强度≥3 000 lx,光照/黑暗周期为16 h/8 h。待谷子生长至五叶期,取植株地上部分检测苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、β-1,3-葡聚糖酶和几丁质酶活性,以及总酚、类黄酮和木质素含量。
1.3 测定项目及方法
1.3.1 酶活性检测 取拌菌组与对照组植株地上部分用于酶活测定。PAL 活性参考ROMERO 等[9]的方法进行测定;PPO 活性采用邻苯二酚比色法进行测定;几丁质酶活性参考BOLLER 等[10]的方法进行测定;β-1,3-葡聚糖酶活性参考JIANG 等[11]的方法进行测定。
1.3.2 次生代谢产物含量测定 采用Folin 酚法测定总酚含量,总酚的量用每克样品含有的焦性没食子酸毫克数(mg/g)表示。采用NaNO2-AlCl3-NaOH比色法测定类黄酮含量,其含量用每克样品中的芦丁毫克数表示。参照CHEN 等[12]的方法提取和测定木质素的含量,木质素的量用每克样品在280 nm处的吸光度表示。
1.3.3 基因表达水平检测 通过RT-PCR 检测抗性相关基因(4CL、CCR、CHIB 和WRKY22)与受体蛋白FLS2 的表达水平。以J20 为试验材料,采用Trizol 法提取总RNA;根据反转录试剂盒说明,将2 μg 总RNA 用Oligo(dT18)引物和反转录酶混合物转录合成cDNA;以cDNA 为模板,谷子Actin 基因作为内参,使用表2 中的基因特异性引物进行PCR扩增。

表2 RT-PCR 引物序列
1.4 数据分析
试验取每组3 次重复的平均值作为该组的检测值,使用IBM SPSS 24.0 软件进行ANOVA 单因素方差分析,并采用Duncan's 新复极差法进行多重比较。
2 结果与分析
2.1 黑粉菌对谷子幼苗次生代谢的影响
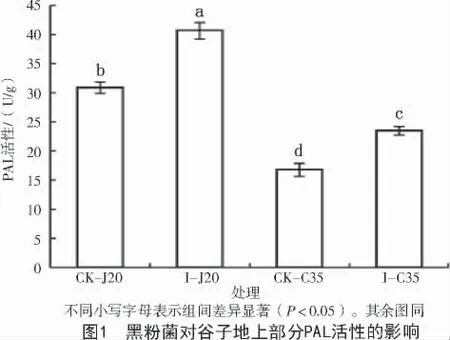
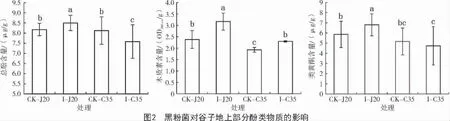
采用室内盆栽试验,分析高抗品种J20 和高感品种C35 的抗病生理过程,发现谷种拌菌后2 个品种谷子植株地上部分PAL 活性均显著提高,但是抗病品种J20 的PAL 活性水平显著高于C35(图1)。拌菌组与对照组相比,不同抗性品种的酚类物质含量变化趋势不同,其中,I-J20 的酚类物质含量较CK-J20 显著升高,而I-C35 总酚含量下降,类黄酮含量保持不变;I-J20 的总酚、类黄酮和木质素含量均显著高于I-C35(图2)。结果显示,谷子在受到黑粉菌侵染后,品种抗性越强,PAL 酶活性增幅越大,酚类物质含量积累越多,由此表明,谷子对黑粉菌的抗性与植株次生代谢途径激活和产物量积累有关。
2.2 黑粉菌对谷子幼苗PPO 活性的影响
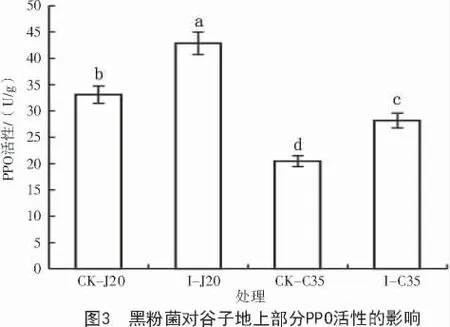
多酚氧化酶活性检测结果显示,谷种拌菌组2 个品种的酶活均显著高于对照组,且I-J20 酶活性比I-C35 整体偏高(图3),表明谷子幼苗PPO 活性的增加与品种的抗病性和黑粉菌的诱导都有关,谷子PPO 活性增加有利于增强谷子幼苗对黑粉菌的抵抗作用。
2.3 黑粉菌对谷子幼苗抗病相关酶活性的影响
2 个不同抗性品种的谷子,在谷种拌菌后几丁质酶活性均显著升高,但不同品种间酶活性无显著差异;谷种拌菌组β-1,3-葡聚糖酶活性与未拌菌对照组间无显著性差异,但I-J20 的β-1,3-葡聚糖酶活性显著高于I-C35(图4)。结果表明,谷子幼苗几丁质酶活性与品种的不同抗性没有直接对应关系,C35 的β-1,3-葡聚糖酶对黑粉菌不敏感,可能与植株对病菌的敏感性有一定关系。

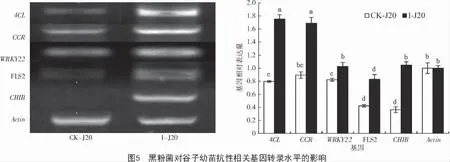
2.4 黑粉菌对谷子幼苗抗性相关基因转录水平的影响
基因转录分析结果表明,拌菌组中谷子的4 个抗性相关基因(4CL、CCR、WRKY22 和CHIB)和受体蛋白FLS2 都不同程度地转录上调(图5),其中,CHIB 和4CL 分别上调188%和120%,FLS2、CCR和WRKY22 的上调幅度分别为97%,89%和25%。结果表明,以上基因及受体蛋白在谷子抗黑穗病的生理过程中发挥了重要作用。
3 讨论
病原菌侵入植物后,受病原菌影响,植物体内多种酶类、氧化还原物质和抗病相关基因等都发生了相应的变化,在生理、生化和分子水平启动对应的防御应答使植株获得系统抗性,抗性强弱直接决定了植物是否发病以及发病程度[13]。本研究表明,谷种拌黑粉菌后,植株出现了基因转录、抗病相关酶活性、次生代谢途径及产物量的改变,说明谷子对黑粉菌的响应是一个涉及基因转录调控、细胞代谢过程改变的系统性生物学过程。
本研究表明,拌菌后2 个品种比较,抗病品种J20 的PAL 活性、PPO 活性以及总酚、类黄酮、木质素含量均增加,而感病品种C35 酚类物质增量不大或保持不变,总酚含量甚至呈下降趋势。苯丙烷代谢途径是植物次生代谢产物合成的主要途径,其中,酚类物质是一类重要的次生代谢产物,在植物抗病过程中同时兼有抗氧化性和抗病性[14]。在病原菌—植物互作过程中,次生代谢产物可作为保护屏障防御病原物侵染,其中有些物质还可作为信号分子参与植物的抗病防御反应[15]。由此推测,感病品种C35 总酚含量下降与其对黑粉菌的抗性较弱有着直接关系,即酚类物质的大量合成有助于增强谷子对黑粉菌的抗性。参与酚类物质代谢过程的PAL和PPO 在植物抗病生理中具有重要作用,其中,PAL 通过次生代谢途径参与调控植物抗病性化合物的生物合成过程[16];PPO 能够将植物体内的酚类物质氧化成对病原菌有毒性作用的醌类物质,从而直接抑制病原菌在植物内的生长与扩散[17]。本研究所检不同抗性谷子品种间PAL 和PPO 活性的显著差异可能与其对病原菌的敏感性不同有关。前人在糜子、玉米和甘蔗[18-20]等的研究中也发现,这些作物在受到外界病原真菌侵染后,作物体内PAL、PPO和POD 等活性上升,且与品种抗性存在正相关性,证明了与本研究类似的结论。
抗病相关酶β-1,3-葡聚糖酶和几丁质酶可通过分解病原菌细胞壁、诱导抗病相关酶促反应,促使抗病物质的累积,增强植物抗病能力。本研究中,几丁质酶活性在拌菌组和对照组间显著不同,但是在2 个品种间无显著差异,没有体现出与谷子品种抗病能力的对应关系;β-1,3-葡聚糖酶活性在敏感品种C35 拌菌组中无明显响应,不利于植物的抗病防御。本研究结果与文献报道的β-1,3-葡聚糖酶和几丁质酶活性与作物品种抗病性呈正相关[18]不一致,可能与谷子品种、发育阶段以及环境因素影响有关。
基因转录应答是植物适应环境的基础。本研究检测了2 个谷子抗病生理相关基因的转录水平,证实这些基因在拌菌组上调表达。研究显示,将几丁质酶基因CHIB 导入一些作物中,可使转基因作物株系抗病性显著增强;基因4CL 编码4-香豆素辅酶A 连接酶,是木质素合成途径的限速酶;基因CCR 是肉桂酰coA 还原酶(一种木质素合成酶),该酶通过调控木质素等次生代谢产物的合成参与植物抗病。本研究中,谷子拌菌组中上述基因转录上调,与本研究检测的相应酶活性提高、次生代谢产物量增加相一致,是植物获得抗性的生物学基础。FLS2 是一类植物模式识别受体,其通过感知和识别病原菌鞭毛蛋白并启动免疫信号传导,随即触发植物先天免疫反应,在植物抗病过程中发挥重要作用。转录因子WRKY22 能够对多种非生物胁迫和稻瘟病菌快速响应[21]。本研究中高抗品种J20 拌菌组与对照组间相关基因的差异转录,提示植株受体蛋白FLS2 对病原菌进行识别,转录因子WRKY22由此激活,进而调节抗病相关基因(CHIB、4CL 和CCR)的表达,以增强植株对病原物的防御应答。
综上所述,谷子对黑粉菌的抗性与品种的遗传基础有关,植株基因转录应答、细胞生理代谢改变提供了抗病生理的物质基础,抗病相关酶、次生代谢途径及其产物在谷子诱导抗性中发挥了积极作用。
