食源性金黄色葡萄球菌产肠毒素情况及耐药性分析
2019-10-23章海通邢家溧傅晓王绍辉承海周霞霞吴莹莹陈灿灿
章海通,邢家溧,2,*,傅晓,王绍辉,承海,周霞霞,吴莹莹,陈灿灿
(1.宁波市食品检验检测研究院,浙江宁波315048;2.宁波大学海洋学院,浙江宁波315211)
金黄色葡萄球菌(Staphlococcus aureus,SA)是一种常见的病原菌,为葡萄球菌属,革兰氏阳性球菌,排列呈葡萄球状,无芽胞,无荚膜,广泛存在于自然界、健康人体的皮肤和咽喉部等,易引起食品污染,是一种重要的食源性病原菌[1]。该菌在适宜的基质和环境条件下可产生肠毒素-葡萄球菌肠毒素(Staphylococcal enterotoxin,SE),是该菌分泌的外毒素,为一组可溶性单链蛋白,在结构和功能上有一定相似性。根据SE 的抗原性可将其分为5 个经典的血清型,分别为:SEA、SEB、SEC、SED 和 SEE 5 种类型[2],近些年也陆续发现其他类型的肠毒素[3]。金黄色葡萄球菌引起食物中毒的主要症状为呕吐和腹泻,鉴于肠毒素是其主要致病因子,因此开展肠毒素检测和分型工作对鉴别金黄色葡萄球菌引起的食物中毒有重要意义。
另一方面,当发生金黄色葡萄球菌引起的食物中毒时,突发的食物中毒事件往往在实验室药敏试验之前就已经给患者给药,临床上首选是用抗生素治疗。而细菌耐药性的出现容易导致错误的药物使用。那么食源性致病菌耐药性与临床治疗相关病症的关联性引起了关注[4]。
由于抗生素在禽畜、畜牧养殖行业的不合理使用导致抗生素残留问题在相关食品中出现,从而使食源性金黄色葡萄球菌的耐药性不断增多,食源性细菌耐药性的增强逐渐成为令人关注的公共食品卫生和安全问题[5-6]。通过全自动荧光酶联免疫法对从食品中分离得到的金黄色葡萄球菌进行肠毒素总量检测,并采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)方法对产肠毒素的菌株进行肠毒素分型,获得相关的肠毒素血清型分布状况,再将分离株进行药敏试验,分析其耐药谱。了解日常检测分离株产肠毒素和耐药情况,探讨食源性金黄色葡萄球菌所产毒素的类型及分布状况,研究其耐药特性,为相关的监测和预警提供一定的参考。
1 材料与方法
1.1 样品
2016~2017年间共采集5 类食品(包括散装熟肉、餐饮食品、米面制品、蛋制品、蔬菜及其制品)及食物中毒样共计370 份。其中散装熟肉采自熟食店,餐饮食品采自中式快餐店,米面制品来自食品加工厂,蛋制品和蔬菜及其制品均为市售。质控对照菌株为标准储备菌株金黄色葡萄球菌(ATCC25923)。
1.2 主要培养基和试剂
脑心浸出液肉汤(brain heart infusion broth,BHI)、血琼脂平板:北京陆桥技术股份有限责任公司;VIDAS 葡萄球菌肠毒素检测试剂盒:法国生物梅里埃;金黄色葡萄球菌肠毒素分型试剂盒:德国拜发公司;革兰氏阳性菌鉴定药敏板条:美国BD 公司。
1.3 主要仪器
IF750 恒温培养箱:德国 memmert 公司;mini-VIDAS 全自动荧光酶联免疫检测仪:法国生物梅里埃公司;1378 二级生物安全柜、902 超低温冰箱、MK3 酶标仪:美国 Thermo Fisher 公司;Phoenix M50 全自动微生物鉴定药敏分析系统:美国BD 公司。
1.4 试验与方法
1.4.1 目标菌分离鉴定
所有样品按照GB 4789.10-2016《食品安全国家标准金黄色葡萄球菌检验》增菌分离、鉴定[7]。然后利用Phoenix M50 全自动微生物鉴定系统进行确认,将结果为金黄色葡萄球菌的菌株,-70 ℃磁珠保藏。
1.4.2 肠毒素总量检测
将保存于磁珠的29 株金黄色葡萄球菌分离株,接种于血平板36 ℃培养18 h,再分别挑取单个菌落接种于BHI 36 ℃过夜培养。然后吸取上述培养液1 mL 放入1.5 mL 无菌离心管,4 500 g 离心5 min,取上清液无菌过滤,吸取滤液0.5 mL 加入葡萄球菌肠毒素检测试剂条中,按全自动微生物鉴定药敏分析系统操作规程上机检测。每株菌株重复3 次试验。
1.4.3 肠毒素分型
将1.4.2 肠毒素检测结果为阳性的菌株,再次接种于BHI 36 ℃过夜培养。吸取上述培养液1 mL 放入1.5 mL 无菌离心管,4 500 g 离心5 min,取上清液无菌过滤。通过肠毒素分型试剂盒对肠毒素A~E 进行分型。每株菌株重复3 次试验。
1.4.4 金黄色葡萄球菌耐药性试验
利用全自动微生物鉴定药敏分析系统(Phoenix M50)进行药敏试验。用接种培养液配制0.5 麦氏浊度菌悬液,在药敏试验肉汤中垂直滴加一滴药敏指示剂,从接种培养液中转移25 μL 菌悬液至药敏试验肉汤,颠倒混匀,将接种培养液和药敏试验肉汤分别倾倒入鉴定/药敏板,用密封条将鉴定/药敏板封好,扫描鉴定/药敏板条形码,上机试验。每株菌株重复3 次试验。
1.4.5 数据处理
采用Excel 2010 和SPSS 16.0 数据统计软件处理分析试验数据。
2 结果与分析
2.1 金黄色葡萄球菌检出率及产肠毒素情况
不同来源食品金黄色葡萄球菌检出率及肠毒素阳性情况如表1 所示。

表1 不同来源食品金黄色葡萄球菌检出率及肠毒素阳性情况Table 1 Detection rate of Staphylococcus aureus and enterotoxin positive from different sources
在5 类食品及食物中毒样共370 份样品中分离得到29 株金黄色葡萄球菌,通过肠毒素试验发现产肠毒素的有16 株,产肠毒素率为55.2%,这表明并不是所有被金黄色葡萄球菌污染的食品都会产肠毒素,而肠毒素是该菌引起的食物中毒的直接原因,有研究表明,95%的金黄色葡萄球菌引起的食物中毒,都是由SEA~SEE 这5 种肠毒素导致的[8]。其中从食物中毒样品中分离的5 株都为肠毒素阳性,肠毒素阳性率为100%。
虽然热处理可杀死金黄色葡萄球菌,但肠毒素对热稳定,在高温下仍能保持活性[9]。从表1 的试验结果可知,食物中毒样品分离的菌株都能检出肠毒素,这与临床表现相符,且与沈玄艺等[10]研究结果一致。试验结果显示,常规食品分离株肠毒素阳性率较高,达到55.2 %,由表1 可见,散装熟肉肠毒素的检出率为57.1%,餐饮食品的肠毒素的检出率为62.5%,高于米面制品(20.0%)和蔬菜的检出率(33.3%),这与苏静等[11]的报道相符,这些食品在食品安全监管和风险监测中予以重点关注。
2.2 金黄色葡萄球菌肠毒素分型结果
肠毒素分型结果如表2 所示。
分型试验发现,产2 种及以上肠毒素的菌株为12株,占41.4%。A 型~E 型常见肠毒素都有检出,产SEE的菌株最多,有12 株,占41.4%,产SEA 的菌株次之,有11 株,占39.3%。其中16 株肠毒素阳性的菌株中有12 株菌产至少2 种肠毒素,占比达到75.0%,菌株产肠毒素的种类越多,引起食物中毒的风险也越大,相对应的临床表现越严重,危害越大。

表2 食品分离株肠毒素分型结果Table 2 Typing results of enterotoxin in food isolates
2.3 金黄色葡萄球菌药敏试验结果
将食品中分离到的29 株金黄色葡萄球菌用20 种不同的抗菌药物进行药敏试验,结果见表3 和表4。
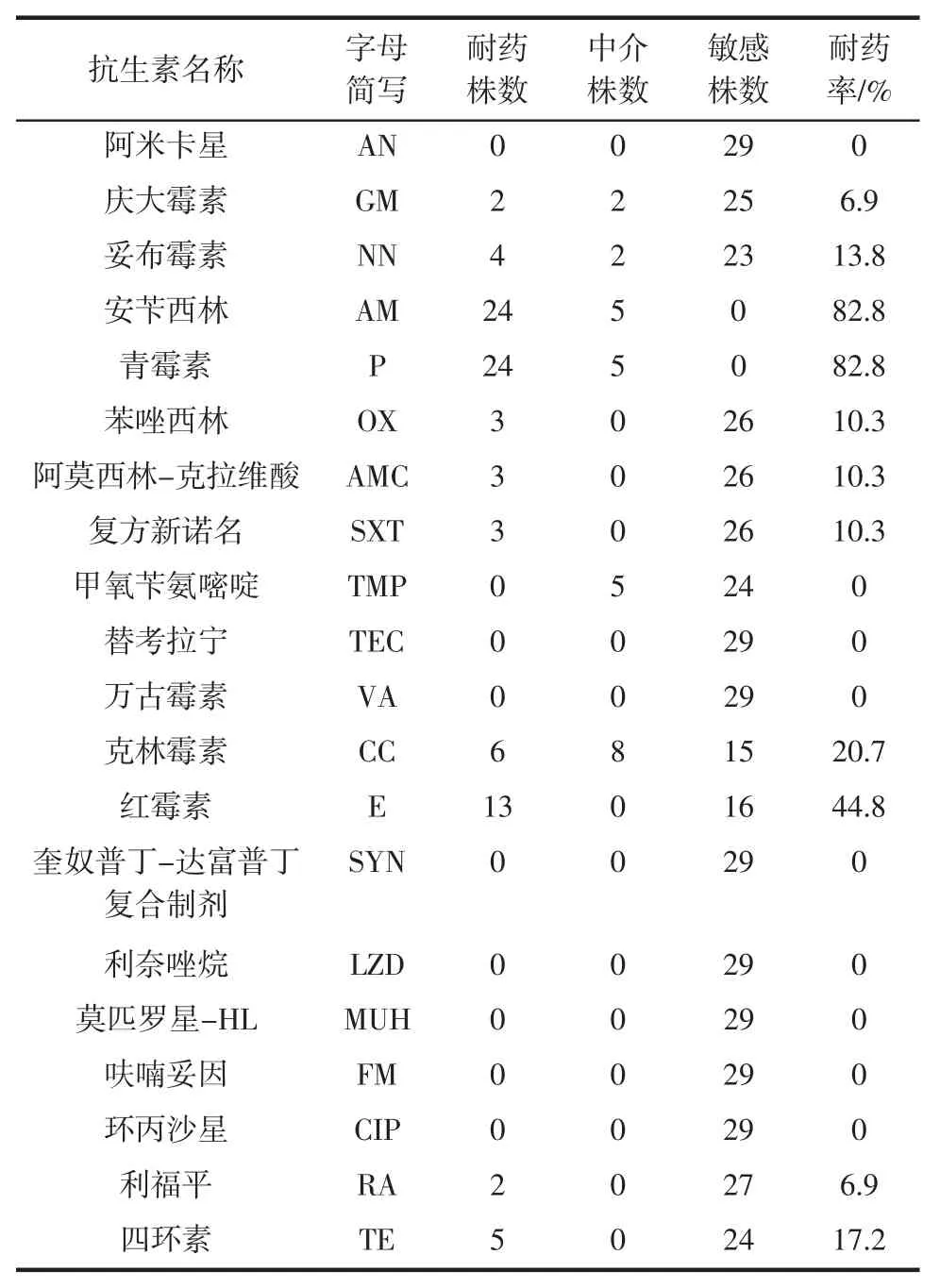
表3 食品分离菌株对20 种抗生素的药敏试验结果Table 3 Results of drug sensitivity test of food isolates to 20 antibiotics

表4 金黄色葡萄球菌耐药普Table 4 Staphylococcus aureus resistance
菌株对庆大霉素(gentamicin,GM)、妥布霉素(tobramycin,NN)、青霉素(penicillin,P)、安苄西林(ampicillin,AM)、苯唑西林(oxacillin,OX)、阿莫西林-克拉维酸(amoxicillin-clavulanic acid,AMC)、复方新诺名(paediatric compound sulfamethoxazole tablets,SXT)、克林霉素(clindamycin,CC)、红霉素(erythromycin,E)、利福平(rifampicin,RA)、四环素(tetracycline,TE)均有不同程度的耐药性,耐药率分别为6.9%、13.8%、82.8%、8.2.8%、10.3%、10.3%、10.3%、20.7%、44.8%、6.9%、17.2%。分离菌株除了4 株全部都敏感外,其他25 株都有不同程度的耐药,整体耐药率为86.2%,并发现多重耐药现象。
细菌的耐药性在临床研究较多,对于食源性致病菌耐药性的关注相对较少。近些年,抗生素在养殖环节的广泛使用,食源性细菌的抗药性出现且呈上升的趋势,对人体健康威胁不断增大。细菌的耐药性通过动物源性的食物链传播给人类并成为人类病原菌耐药重要原因,抗菌药物的使用还影响人体内的微生态及其生存环境[12]。药敏试验的结果发现,除对阿米卡星(amikacin,AN)、甲氧苄氨嘧啶(trimethoprim,TMP)、替考拉宁 (teicoplanin,TEC)、万古霉素(vancomycin,VA)、奎奴普丁/达富普丁的复合制剂(synercid,SYN)、利奈唑烷(linezolid,LZD)、莫匹罗星-HL(mopirocin-HL,MUH)、呋喃妥因 (furadantin,FM)、环丙沙星(ciprofloxacin,CIP)9 种抗菌药物敏感外,其余 11 种均有不同程度的耐药,尤其是青霉素和安苄西林与2001年中国耐药监测研究组对全国98 株临床金黄色葡萄球菌的耐药结果83.67%基本一致[13],两者结果统计学比较无显著差异(P>0.05),说明食源性金黄色葡萄球菌耐药性与临床菌株耐药性高度相关。
临床上万古霉素(VA)是治疗感染耐甲氧西林金黄色葡萄球菌(MRSA)的金标准,本次试验未发现有耐万古霉素(VA)的菌株,这与相关文献报道一致[14]。对单种抗生素的耐药率由高到低依次为青霉素(P)82.8%、安苄西林(AM)82.8%、红霉素(E)44.8%、克林霉素(CC)20.7%、四环素(TE)17.2%、妥布霉素(NN)13.8%、苯唑西林(OX)10.3%、阿莫西林-克拉维酸(AMC)10.3%、复方新诺名(SXT)10.3%、庆大霉素(GM)6.9%、利福平(RA)6.9%。
试验发现有多重耐药现象,同时对2 种抗生素耐药的菌株为8 株,占27.6%,三重耐药菌株也是8 株,占比27.6%,3 株菌对4 种抗菌药物都耐药,各有一株金黄色葡萄球菌分别对5 种和6 种抗菌药物耐药,耐药情况最严重的3 株菌同时对8 种抗菌药物耐药,占比为10.3%。多重耐药金黄色葡萄球菌的出现,预示着食用由这类菌污染的食品带来更大的安全风险,同时为临床给药和治疗带来更大的挑战。食源性金黄色葡萄球菌产生耐药性主要是动物饲养过程中使用抗生素导致食源性耐药菌的产生和扩散,且在食品中的药物残留可能干扰人肠道内的正常菌丛和诱导临床耐药病原菌株,动物排泄物中的抗生素和耐药菌排入环境并长期保持耐药性质[15]。因此应加强耐药监测,在养殖环节加大宣传力度,减少抗生素滥用,从源头上控制细菌耐药性的增强。
3 结论
本文通过对5 类食品(包括散装熟肉、餐饮食品、米面制品、蛋制品、蔬菜及其制品)及食物中毒样共计370 份样品分离得到的29 株金黄色葡萄球菌进行肠毒素分析与分型研究,发现产肠毒素的有16 株,产肠毒素率为55.2%,其中熟肉制品和餐饮食品更容易受到金黄色葡萄球菌及其肠毒素的污染;通过分型试验发现,产SEE 的菌株最多,有12 株,占41.4%,产SEA的菌株次之,有11 株,占39.3%。其中16 株肠毒素阳性的菌株中有12 株菌产至少2 种肠毒素,占比达到75.0%。现行的食品致病菌限量标准对金黄色葡萄球菌有一个安全限量指标,低于这个指标即被认为可接受。实际情况是少量的产肠毒素的金黄色葡萄球菌污染了相关食品,这些肠毒素阳性株在适宜的条件下大量繁殖,进而产生大量的肠毒素,最终也会引起食物中毒事件的发生。由此对食品中分离的金黄色葡萄球菌进行肠毒素检测和分型分析有较高的现实意义。
考虑到食源性致病菌耐药性与临床治疗相关病症的关联性,对29 株食源性金黄色葡萄球菌对庆大霉素(GM)、妥布霉素(NN)、青霉素(P)、安苄西林(AM)、苯唑西林(OX)、阿莫西林-克拉维酸(AMC)、复方新诺名(SXT)、克林霉素(CC)、红霉素(E)、利福平(RA)、四环素(TE)耐药性进行了研究,结果发现均有不同程度的耐药性并出现多重耐药性,其中对青霉素(P)和安苄西林(AM)的耐药率最高,均为82.8%,其次为红霉素(E)44.8%。此次研究发现食源性分离株对多种抗生素存在不同程度的耐药性和多重耐药现象,建议在药物使用源头上加强宣传和控制,降低因细菌耐药而引起的食品安全风险。金黄色葡萄球菌的肠毒素产毒机理以及耐药机制有待进一步研究。
