高锰胁迫对香根草矿质元素吸收及光合系统的影响
2019-10-23申须仁董名扬王朝勇
申须仁,董名扬,王朝勇,王 杰,周 强,3*
(1.吉首大学植物资源保护与利用湖南省高校重点实验室,湖南 吉首 416000;2.锰锌钒产业技术协同创新中心,湖南 吉首416000;3.锰锌矿业重金属污染综合防治技术湖南省工程实验室,湖南 吉首 416000)
锰(Mn)是植物代谢过程中必需的微量元素,当Mn含量超标时,植物会发生Mn毒反应,对植物的产量、生长发育、光合作用、矿质营养吸收等生理代谢活动均产生负面的影响[1-2]。Mn毒害也被认为是限制植物在酸性及渍水土壤生长的重要因素[3]。在我国南方地区的酸性土壤中、pH较低的水稻土壤中以及Mn矿区及尾渣库区的土壤中,Mn离子大量积累,对农作物生长及农产品环境安全造成巨大的危害[4]。尤其是在矿区,Mn元素可以通过各种途径进入农田土壤中[5],灌溉农田土壤中Mn含量可达5700 mg·kg-1,其最大值可达10 000 mg·kg-1。矿渣堆周边的农田土壤Mn含量也接近1000 mg·kg-1,蔬菜中的Mn含量超过正常值5~80倍,亟待治理[6-7]。
近年来,重金属植物修复技术日益受到社会的重视和关注[8]。香根草[Vetiveria zizanioides(L.)Nash]是禾本科香根草属多年生C4类草本植物,根系发达、生物量大,每年干草产量可达100 t·hm-2。能够适应旱涝、酸碱等多种环境,并对多种重金属都有较强的耐受和积累能力,已广泛应用于环境修复领域[9-10]。其在农田生态系统中也有较广泛的应用。通过与作物间作,香根草可以防止农田水土流失、诱集作物害虫、修复多环芳烃污染土壤等[11-12]。所以,香根草在农业及废弃地的生态修复领域有着良好的应用前景。但目前对于采用植物修复技术治理高Mn污染的基础和应用研究较少,香根草对高Mn胁迫耐受和生理响应也未见报道。所以,本文采用实验室水培试验,研究高Mn胁迫对香根草矿质元素吸收和光合系统的影响,揭示香根草对高Mn胁迫的耐受范围、Mn积累特征及生理响应,以期为香根草用于高Mn污染地区环境修复提供科学依据。
1 材料与方法
1.1 供试材料
试验所用香根草由试验室长年种植在未受污染的苗圃中,在试验准备阶段,将分蘖繁殖得到的香根草幼苗单株培养,挑选长势健壮的香根草(苗龄5个月)置于1/2Hoagland营养液中培养,待其恢复生长后进行Mn胁迫处理。
1.2 试验设计
每3株香根草固定于1个500 mL塑料盆中,以1/2Hoagland营养液作为培养液,Mn以MnSO4·H2O的形式直接加入营养液中。以1/2Hoagland营养液作为对照处理,其他处理组的Mn浓度分别为:15、30、60、120 mmol·L-1,营养液pH调节至5.8,并隔日更换。于植物培养箱中生长60 d。培养条件为昼夜温度分别为(28±2)℃和(22±2)℃;白昼16 h·d-1;光照强度1000 μmol·m-2·s-1。每处理设置3个重复(即每处理3盆9株苗)。
1.3 含水率、株高、SPAD值、植株干物质质量的测定
将植物用去离子水多次冲洗,吸干表面水分称鲜质量。分离根、叶组织,在105℃下杀青20 min,70℃下烘48 h至恒质量,冷却至室温后称干质量(即整个植株干物质质量)。植物含水率=(鲜质量-干质量)/鲜质量×100%。植物株高用卷尺测量基部到叶片最高点的高度。采用SPAD-502叶绿素仪(Konica Minolta Sensing,日本)夹取植物倒3或倒4叶的1/4处和3/4处测量植物SPAD值。
1.4 Mn及矿质元素含量的测定
将香根草干样粉碎过60目筛。称取0.1 g并加入HNO3和HClO4(V∶V=4∶1)静置6~8 h,然后于石墨消解仪消煮至溶液澄清,冷却并定容于25 mL,再经滤纸过滤,于安捷伦240fs火焰原子吸收光谱仪(安捷伦,美国)测定矿质元素含量[13];以24种金属元素混合标准液(GSB04-1767-2004)配制5个梯度浓度的标准液,制作标准曲线。每测定5~10个样品,将仪器重新置零,并测量一个浓度的标准品,以监测仪器的稳定性。
1.5 Mn富集系数与转移系数的测定[14]
Mn的根系富集系数=Croot/Csolution
Mn的转移系数=Cleaf/Croot×100%
富集量=Wroot×Croot+Wleaf×Croot
式中:Csolution表示培养液中的Mn含量;Croot表示根中的Mn含量;Cleaf表示叶中的Mn含量;Wroot表示根的干物质量;Wleaf表示叶的干物质量。
1.6 光合作用参数的测定
采用Li-6400便携式光合仪(LICOR,美国)于9:30—11:00进行测定,植物先在阳光下进行充分光诱导,然后进行光合测量。叶室光强根据环境光强设置为 1300 μmol·m-2·s-1,净光合速率(Pn)、气孔导度(Cond)、胞间二氧化碳浓度(Ci)、蒸腾速率(Trmmol)均从仪器直接读取。
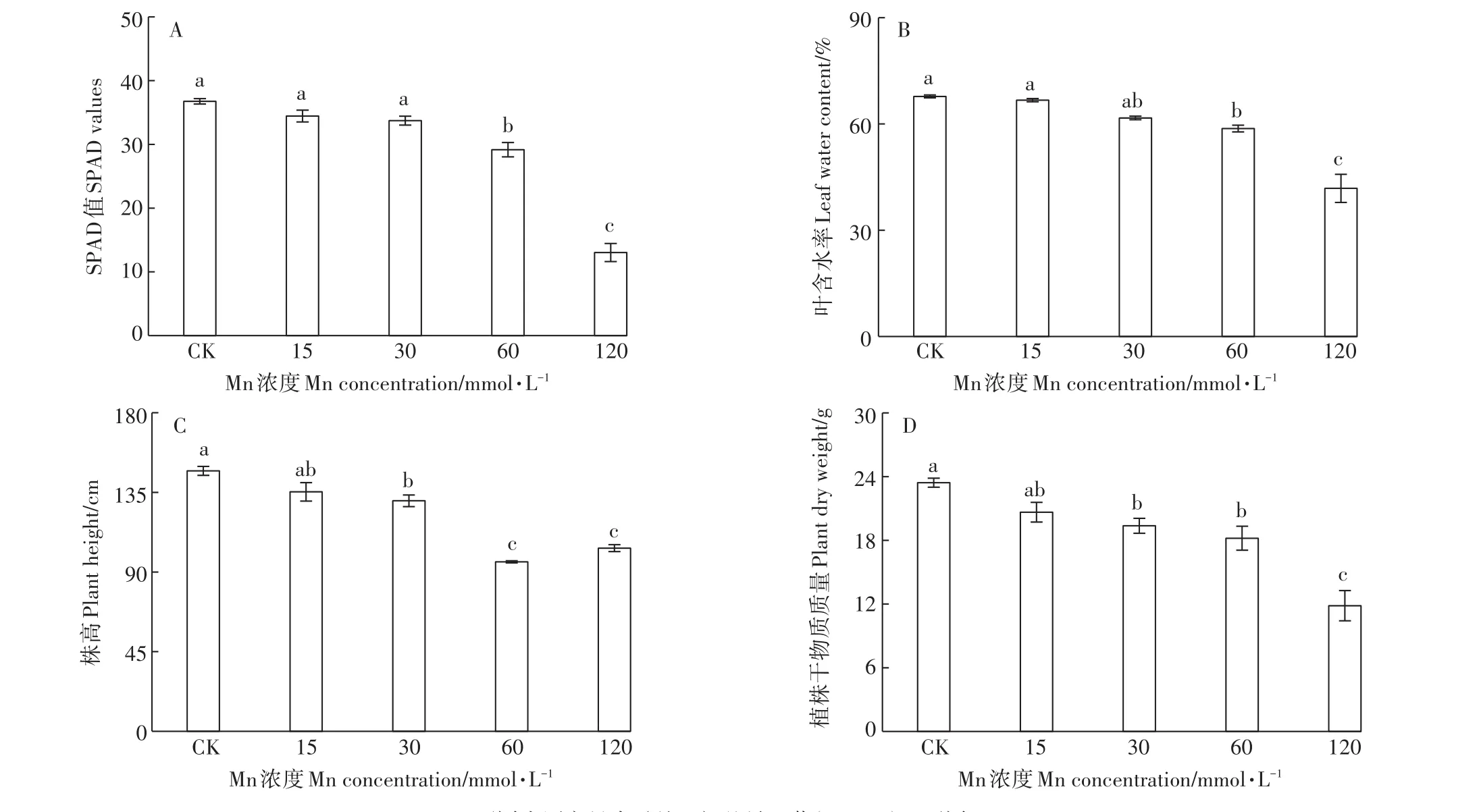
图1不同浓度Mn对香根草SPAD值(A)、叶片含水率(B)、株高(C)和植株干物质质量(D)的影响Figure 1 Effects of different concentrations of manganese on SPAD(A),leaf water content(B),plant height(C)and plant dry weight(D)of vetiver grass
1.7 叶绿素荧光参数的测定
采用PAM-2500(Walz,德国)于20:00以后进行测定,植物先放置在黑暗环境下进行30 min暗适应。梯度作用光强为 8、16、32、90、165、245、325、430、580、770、1100、1400、1700 μmol·m-2·s-1,测定间隔为30 s。PSⅡ最大光化学效率(Fv/Fm)、潜在最大电子传导率(ETRmax)直接从仪器上读取,PSⅡ实际光化学效率[Y(Ⅱ)]、调节性主动耗散[Y(NPQ)]、非调节性被动能量耗散[Y(NO)]均通过系统自动拟合得出。
1.8 数据分析
以上试验数据使用SPSS 20.0进行Tukey算法以及多重比较分析,显著性水平为P<0.05,数据均以平均值±标准误表示。并采用该软件中Pearson相关系数和双侧显著性检验进行相关性分析。
2 结果与分析
2.1 Mn对香根草SPAD、含水率、株高、植株干物质质量的影响
与对照相比,15、30 mmol·L-1Mn处理中,SPAD略微下降,但未达到显著差异水平;当Mn处理浓度在60 mmol·L-1和120 mmol·L-1时其出现显著性下降,且在120 mmol·L-1时,SPDA值最低,仅为对照的35.5%(图1A)。而香根草的含水率、株高、植株干物质质量在Mn处理浓度≥30 mmol·L-1时即出现明显的降低,株高、植株干物质质量下降已达到显著差异水平。随着Mn处理浓度的增加,3个参数下降的幅度更大。在120 mmol·L-1时,其分别为对照组的51.5%、70.3%和50.5%(图1B、图1C、图1D)。
2.2 Mn对香根草Mn含量、富集系数和转移系数的影响
Mn处理的根、叶中Mn含量均显著高于对照。在根部,30~120 mmol·L-1处理组间的Mn含量没有明显差异,且显著高于15 mmol·L-1Mn处理组(图2A)。而在叶中,15~60 mmol·L-1处理组间的Mn含量没有明显差异,但在120 mmol·L-1Mn处理时出现大幅度上升(图2B)。其转移系数的变化与叶片中的Mn含量变化一致。在15~60 mmol·L-1Mn处理下,转移系数为24.5%~28.1%,在120 mmol·L-1时,转移系数增加至66.5%(图2C)。香根草根系对Mn的富集系数随着Mn处理浓度的增加而显著降低,在120 mmol·L-1时降至2.9;Mn处理下根系的Mn富集系数始终大于1(图2D)。而富集量则在99.9~135.1 mg·株-1间波动。其中,120 mmol·L-1处理下的富集量要显著高于30、60 mmol·L-1处理(图2E)。
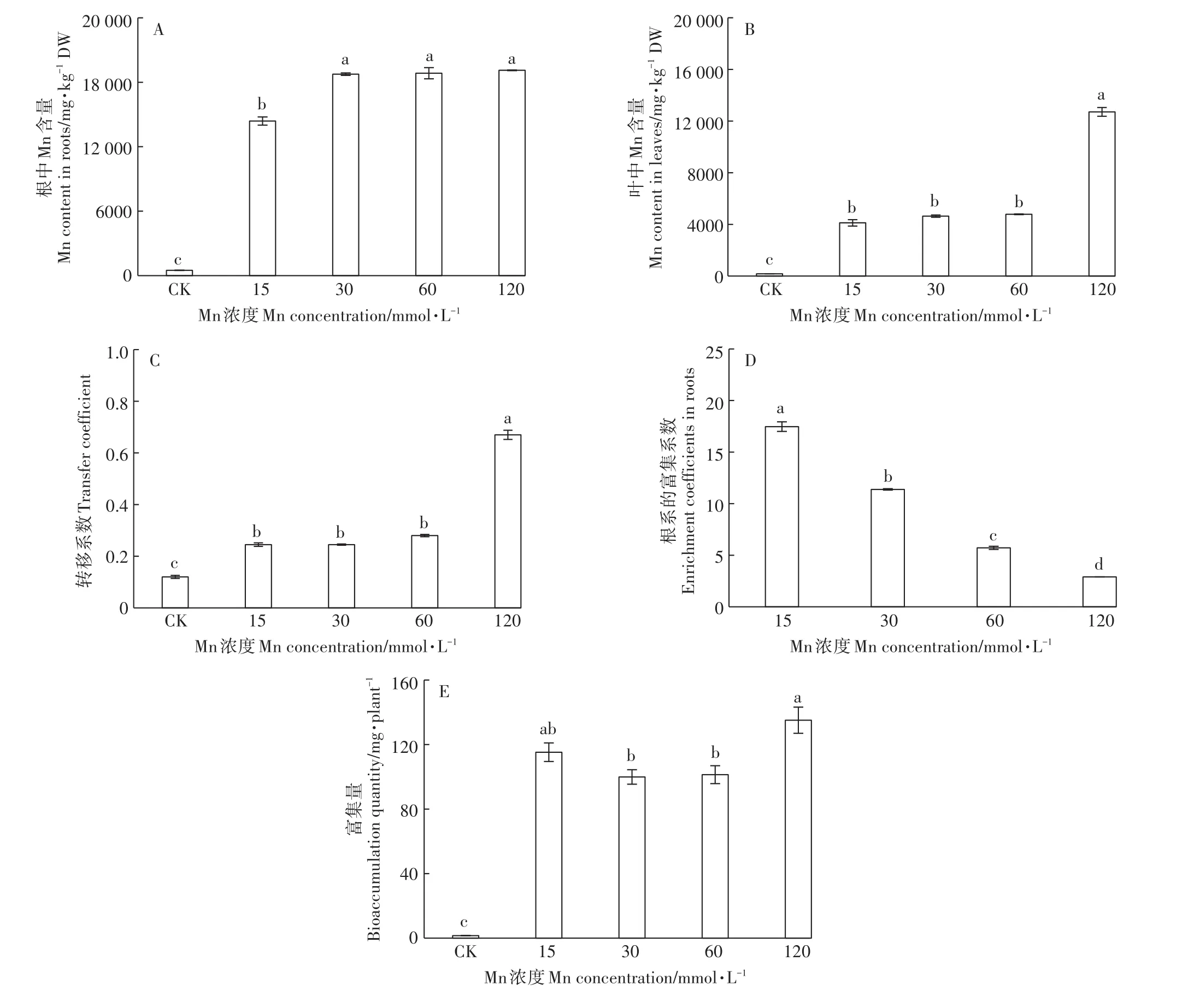
图2 不同浓度Mn对香根草根叶中锰含量、富集系数和转移系数的影响Figure 2 Effects of different concentrations of manganese on manganese content in roots and leaves,and transfer coefficients enrichment coefficients and bioaccumulation quantity
2.3 Mn对香根草K、Mg、Fe吸收的影响
Mn处理的根、叶中K含量呈现下降的趋势,当处理浓度≥30 mmol·L-1时,达到显著性差异,其中,根中K含量的下降幅度远大于叶中(图3A)。根中的Mg含量在Mn处理下显著下降,仅为对照的25.5%~39.4%,且Mn处理组之间的变化较小(图3B)。根的Fe含量则与Mg的变化相反,在Mn处理下呈现出不同程度的增幅,比对照组增加了1.9~3.9倍(图3C)。与对照相比,叶中Mg和Fe的含量在各处理组有上升和下降不同的变化,但变化幅度总体不大(图3B、图3C)。
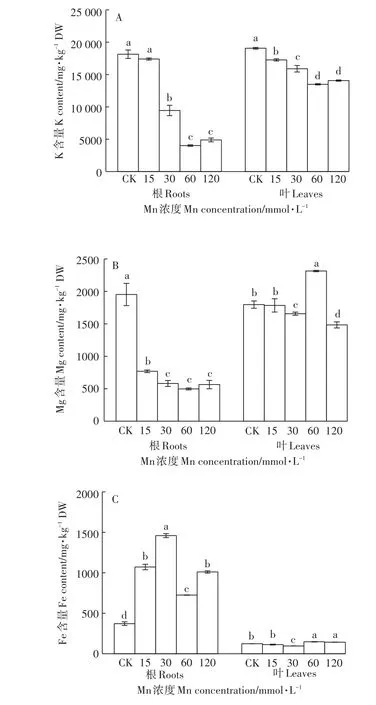
图3 不同浓度Mn对香根草K、Mg、Fe吸收的影响Figure 3 Effect of different concentrations of manganese on the absorption of K,Mg and Fe in vetiver grass
2.4 Mn对香根草光合作用的影响
与对照组相比,Mn处理下Pn显著降低了37.3%~81.0%,并随着Mn浓度的增加而总体呈下降趋势。尤其在120 mmol·L-1处理组,其Pn值仅为对照的19.0%(图4A)。与Pn变化趋势相反,Ci在Mn处理下显著高于对照,且Mn处理组间的Ci较为相似(图4C)。Trmmol和Cond的变化趋势一致,在15 mmol·L-1处理组中,其与对照组无明显变化,在30、60 mmol·L-1处理下则出现一定程度的增加,但在120 mmol·L-1处理下则出现大幅度的下降,并显著低于对照水平(图4B、图4D)。
2.5 Mn对香根草叶绿素荧光参数的影响
Mn处理下香根草的Fv/Fm和ETRmax均呈现下降的趋势。ETRmax在15 mmol·L-1处理下即出现显著的下降,在60~120 mmol·L-1下降的幅度更大(图5B)。而Fv/Fm在15~30 mmol·L-1处理下保持稳定,当Mn浓度上升至60、120 mmol·L-1时,其显著低于对照组(图5A)。随着光强的增加,Y(Ⅱ)呈现下降的趋势,而Y(NPQ)呈现上升的趋势,Y(NO)基本保持稳定。Mn处理组的Y(Ⅱ)均低于对照,而Y(NO)均高于对照(图5C、图5E);15、30 mmol·L-1Mn胁迫下,Y(NPQ)接近或低于对照;而30~120 mmol·L-1Mn胁迫下,Y(NPQ)总体高于对照(图5D)。
3 讨论
3.1 香根草对Mn胁迫的Mn耐受和积累能力及特点
过量的Mn会对植物产生一系列的生理毒害作用,多数植物对Mn的耐受浓度通常低于15 mmol·L-1。仅有水蓼[15]、木荷[16]等Mn超富集植物能够耐受高浓度的Mn胁迫。考虑到矿区土壤中可能存在高浓度的Mn离子,所以,本研究中设置的Mn处理浓度达到了120 mmol·L-1,与金政等[16]在木荷研究使用Mn浓度接近。PSⅡ的最大量子产量(Fv/Fm)是衡量原初光能捕获的最大能力的指标,植物处于逆境下,Fv/Fm下降,其直接反映植物受到外界胁迫程度[17]。植物叶绿素含量降低也是高Mn导致的胁迫伤害症状之一[18]。诸多研究表明在Mn胁迫下植物的Fv/Fm和叶绿素含量会明显下降[19-20]。本研究发现,香根草Fv/Fm(图5A)和SPAD(图1A)在15~60 mmol·L-1内接近正常水平,植株干物质量(图1D)也能维持在对照的77.6%~88.1%。说明香根草能够耐受60 mmol·L-1以下的Mn环境,具有良好的Mn耐受能力。在60 mmol·L-1以下的Mn处理中,根和叶中的Mn含量分别为14 393~18 845 mg·kg-1和4118~4782 mg·kg-1;并且,根中的Mn富集系数也大于1。总体而言,香根草有良好的Mn积累能力,远超于大多数植物(20~500 mg·kg-1)[19]。而且,在15~60 mmol·L-1的Mn环境下,根中的Mn含量已经达到Mn超积累植物的标准(Mn含量大于10 000 mg·kg-1)[19],叶中的Mn含量达到该标准的40%。此外,试验中香根草Mn的富集量在15~60 mmol·L-1的Mn环境中差异不显著,可达99.9~115.2 mg·株-1。由于试验用苗是苗期,其生物量并不大(对照组生物量仅23.4 g·株-1),导致富集量偏小,有研究报道在4株·m-2密度下,经过8个月的生长,香根草的每株生物量可达300 g[21],据此推测,香根草在高Mn环境中富集量相当可观,显示其具有用于高Mn污染环境修复的潜力。
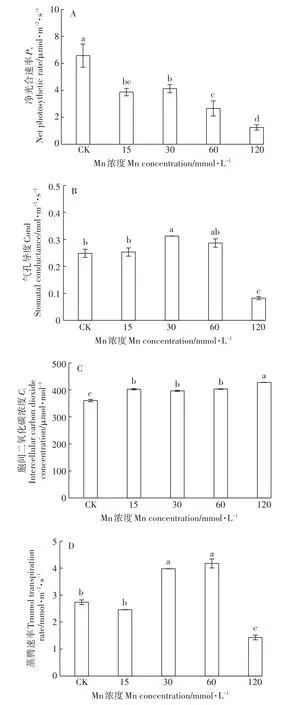
图4 不同浓度Mn对香根草净光合速率、气孔导度、胞间二氧化碳浓度、蒸腾速率的影响Figure 4 Effect of different concentrations of manganese on net photosynthetic rate(Pn),stomatal conductance(Cond),intercellular carbon dioxide concentration(Ci)and transpiration rate(Trmmol)of vetiver grass
在Mn处理下,香根草根部Mn的含量高于叶片,Mn转移系数为24.5%~28.1%(图2A、图2B、图2D),说明香根草的根部是富集Mn的主要器官,刘云国等[22]的研究也表明香根草根部是Cd离子的主要富集部位。随着Mn浓度的增加,根、叶中Mn含量表现出不一样的变化。在30~120 mmol·L-1Mn处理下根中的Mn含量保持稳定(图2A)。在15~60 mmol·L-1处理下叶中的Mn含量和转移系数无显著差异;但在120 mmol·L-1处理下,叶中Mn含量和转移系数均出现大幅度的增加(图2B、图2D)。结果表明在一定Mn浓度内,香根草根、叶中的Mn离子并没有随着Mn处理浓度的增加而递增。在木荷的根中也发现了类似的现象[16]。这可能是在高Mn环境中,香根草存在着限制Mn吸收和向叶片转运的机制。在超高Mn浓度下(120 mmol·L-1),可能由于该机制受到破坏,才导致Mn离子向地上部位运输增加,叶中Mn离子大量积累。
3.2 光合系统和矿质元素吸收对高Mn胁迫的响应
Mn过量会产生大量的活性氧,破坏叶绿素,影响PSⅠ与PSⅡ的活性,降低植物的光合速率[23]。水稻等农作物在Mn毒害下光合速率会显著降低,光合系统的有关基因表达会发生改变[24-25],本研究发现,香根草光合作用受抑制程度与Mn处理浓度、根、叶中Mn含量呈极显著负相关(表1)。Pn显著下降,Ci显著增高(图4A、图4C),同时,ETRmax、Y(Ⅱ)也显著下降(图5B、图5C),这说明造成香根草光合速率下降的主要因素并不是气孔受限,而是光合系统和光合代谢活动受到了损伤。在Mn胁迫下,随着光照强度的增加,Y(NO)保持稳定,而Y(NPQ)显著增加(图5D、图5E),表明PSⅡ以热耗散等保护性调节机制消耗的光能增加。Y(NPQ)的增加是植物的一种保护机制[26]。梁文斌等[19]也认为是Mn超积累植物垂序商陆的保护机制之一。
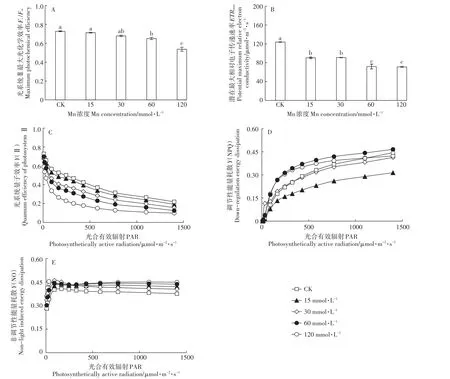
图5 不同浓度Mn对香根草光系统Ⅱ最大光化学效率(Fv/Fm)、潜在最大相对电子传递速率(ETRmax)、光系统量子效率[Y(Ⅱ)]、光系统Ⅱ调节性能量耗散[Y(NPQ)]、光系统Ⅱ非调节性能量耗散[Y(NO)]的影响Figure 5 Effects of different concentrations of manganese on maximum photochemical efficiency(Fv/Fm),potential maximum relative electron conductivity(ETRmax),quantum efficiency of photosystem Ⅱ [Y(Ⅱ)],down-regulation energy dissipation[Y(NPQ)],non-light induced energy dissipation[Y(NO)]of vetiver grass
植物体内矿质元素平衡是其正常生长发育的必要条件,重金属胁迫会改变植物体内矿质元素的吸收与分布[27]。本研究选取了大量元素K、中量元素Mg、微量元素Fe作为阳离子矿质元素的代表进行分析,结果显示,在高浓度Mn胁迫下,植物体内的3种元素在根、叶中表现出不同的变化趋势。在叶中,除K含量有一定程度的降低外(图3A),Mg和Fe的含量基本维持稳定(图3B、图3C)。但在根中,K和Mg的含量均出现大幅度下降(图3A、图3B),而Fe则显著增加(图3C)。相关性分析发现,根、叶中的K含量和根中的Mg含量与根、叶中Mn的含量呈极显著负相关(表1)。这可能是因为高Mn能抑制植物对K、Mg的吸收[28-29]。本试验发现根、叶中K含量与植株干物质质量和Fv/Fm呈极显著正相关(相关系数为0.675和0.674,0.772和0.750),暗示K营养在香根草耐受高Mn胁迫中具有重要的作用。此外,有研究发现Mn胁迫下Mn耐受型水稻根、叶中的Fe含量增加[28]。香根草根中Fe含量的增加可能是Mn耐受力强的表现。但有关机制还未见报道。

表1 处理溶液及根叶中Mn含量与香根草净光合速率、根叶中K、Mg含量的相关系数Table 1 Correlation coefficients between Mn contents in solutions,roots,leaves and net photosynthetic rate or K and Mg contents in roots,leaves of vetiver grass
4 结论
香根草能够长时间耐受60 mmol·L-1以下的Mn环境,并能够在根、叶中积累高含量的Mn,具有修复Mn污染环境的潜力。限制Mn离子的吸收和转运、增加PSⅡ调节性能量耗散消耗、维持叶中Mg、Fe的相对稳定是香根草对高Mn胁迫的适应性响应。
