三氧化二铝对环氧树脂固化动力学及热降解动力学的影响
2019-10-19张英明王兵毅郝志峰陈毅龙
张英明,王兵毅,余 坚,郝志峰,柯 勇,陈毅龙
(1. 广东工业大学 轻工化工学院,广东 广州 510000;2. 景旺电子科技(龙川)有限公司,广东 河源 517300)
环氧树脂是一种典型的热固性树脂,具有良好的力学性能、化学稳定性、电绝缘性能、耐腐蚀性等特点,被广泛用于粘结剂、涂料、电子电器封装等方面[1-2]. 随着环氧树脂基高导热复合材料在LED基板、新型电源模块、汽车电子、高集成度IC封装基板等产业中的应用,为了获得较高导热系数的产品,一般需要在环氧树脂中添加质量分数很大(质量分数超过60%)的无机填料[3-4]. 无机填料的添加会对环氧树脂体系的固化行为和热降解行为产生影响[5],从而影响到综合性能,因而从理论上深入细致地研究无机填料对环氧树脂综合性能的影响,对研发高性能环氧树脂基高导热复合材料至关重要.
国内外的一些研究小组开展了无机填料对环氧树脂固化动力学、固化行为以及固化体系性能的影响的研究[6-7]. 郑伟峰等[8]研究结果表明,Al2O3颗粒对E51/DDS(DDS为胺类固化剂二氨二苯砜)体系固化表观活化能有较大的影响,Al2O3添加量为40%时,其固化活化能降低了19.3%. 但是目前的文献报道对固化活化能降低的原因和机理没有进行深入的理论分析. 另外对于环氧树脂基高导热复合材料,热性能和热降解都会对实际应用产生显著的影响,因此本文深入细致研究了高含量Al2O3/环氧树脂体系固化过程和热降解过程. 采用非等温DSC法对高含量氧化铝/环氧树脂体系的固化过程进行了分析,用Kissinger方程和Crane法对实验体系研究得到了n级反应模型的动力学参数;通过热重分析(TGA)研究了环氧树脂复合材料的热稳定性,同时采用Flynn-Wall-Ozawa法建立了固化产物热降解动力学模型,确定了热降解活化能. 热重−红外联用对环氧树脂固化产物热降解过程中产生气体进行了表征,进一步对环氧树脂基固化物的热降解机理进行分析.
1 实验部分
1.1 实验原料
E-51型双酚A型环氧树脂(环氧值0.51):工业级,蓝星新材料无锡树脂厂产品;4,4-二氨基二苯甲烷(DDM):分析纯,阿拉丁试剂厂;Al2O3粉体:佛山三水金戈新型材料(中位径3 μm).
1.2 样品制备
称取20 g E51放入烧杯中,预热至60 ℃. 在N2气氛下将5 g DDM加热到130 ℃,恒温至DDM熔融,随后体系降温降至60 ℃,边搅拌边加入E51,60 ℃恒温搅拌10~15 min至混合均匀,然后加入16 g Al2O3粉体(用量为E51质量的80%). 采用高速搅拌器搅拌15 min,过三辊三遍使Al2O3粉体、DDM和E51三者混合均匀. 将样品倒入到预热的模具中,在真空干燥箱中60 ℃脱气30 min,直至未见气泡冒出,然后转移到电热鼓风干燥箱中,按照100,120和150 ℃各2 h的顺序进行热固化制备得到固化物试样(长10 mm,宽10 mm,厚1 mm). 所制备的样品记作:80%Al2O3/E51/DDM. 为了进行对比,采用类似的方法制备了未添加Al2O3粉体的E51和DDM的混合物,样品编号记作:E51/DDM.
1.3 性能测试
1.3.1 差式扫描热分析(DSC)
采用梅特勒公司生产D S C-3 对环氧树脂(E51)/二氨基二苯甲烷(DDM)体系进行固化动力学参数测试,升温速率分别为2,5,10,15和20 ℃/min,温度范围为25~250 ℃,样品质量为5~8 mg;对固化后的样品进行玻璃化转变温度测试,升温速率10 ℃/min,温度范围为60~170 ℃.
1.3.2 热重分析(TG)
使用耐驰公司的STA409PC型高温同步热分析仪对固化样品进行热失重测试,升温速率分别为5,10,15和20 ℃/min,温度范围为30~800 ℃,样品质量为5~8 mg.
1.3.3 热重−红外联用(TG-FTIR)
采用梅特勒公司生产的TGA/DSC3+型热重−红外联用仪进行热降解测试,在20 mL/min N2气氛下进行,升温速率5 ℃/min,温度从30 ℃升到600 ℃,样品质量为10 mg.
1.3.4 动态力学分析测试(DMA)
采用梅特勒公司生产的DMA861进行动态力学实验,测试频率为1 Hz,升温速率为5 ℃/min,温度范围为25~180 ℃.
2 结果与讨论
2.1 非等温固化动力学分析
不同升温速率2、5、10、15和20 ℃/min时,E51/DDM和80%Al2O3/E51/DDM两个体系的热流−温度谱图如图1所示.
从DSC曲线可以看出,纯的环氧树脂和Al2O3粉体复合环氧树脂体系均只有一个固化峰,说明Al2O3粉体与环氧树脂体系形成了均一体系,反应过程放热均匀. 并且随着升温速率的增加峰值温度逐渐增大,峰值随着升温速率增大而增大是因为升温速率越快,单位时间给体系提供的热量越多,促进了体系的流动,使得体系局部分子浓度增大,从而加快了反应. 图1中的相应的DSC数据经过系统软件处理后得到的放热峰顶温度Tp和固化反应热∆H(用直线基线对峰进行积分得到的固化反应热)列于表1中.

图 1 不同升温速率下对应的热流温度谱图Fig.1 Non-isothermal DSC thermograms of the curing reaction at indicated heating rates

表 1 各升温速率下E51/DDM体系和80%Al2O3/E51/DDM体系的峰值温度Tp和反应焓∆HTab.1 Peak temperature Tp of DSC thermogram at different heating rate and enthalpy for curing reaction
应用模型拟合法对环氧树脂固化过程分析时基于以下两个假设:
1) 转化率与热流速率成正比,即
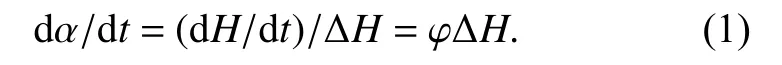
其中,α为转化率,t为时间,dα/dt为固化速率,φ为热流速率,∆H为总的固化反应焓,可从DSC的热流−时间曲线积分面积得到.
2) 固化动力学的基本速率方程为

其中,T为绝对温度,K(T)为反应速率常数,f(α)为固化反应的动力学模型数学表达式,速率常数K(T)为温度的函数,并且遵循Arrhenius方程.
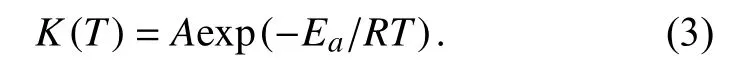
其中,A为指前因子,Ea为表观活化能,R为气体常数.综合式(1)~(3),环氧树脂体系的固化过程可以描述为

应用目前n级模型:

其中,n为反应级数.
非等温过程的表观活化能Ea,常用Kissinger方法[9-10]进行计算(式6),其基本方法是:以升温速率β进行非等温固化实验,由DSC曲线获得放热峰顶温度Tp与β的关系,然后用式(6)求解出表观活化能Ea.

式(6)中,ln(AR/Ea)为常数.
根据表1中列出的Tp-β值用Kissinger方程式(6)分析,以ln(β/Tp2)对1/Tp作图,计算结果如图2所示.
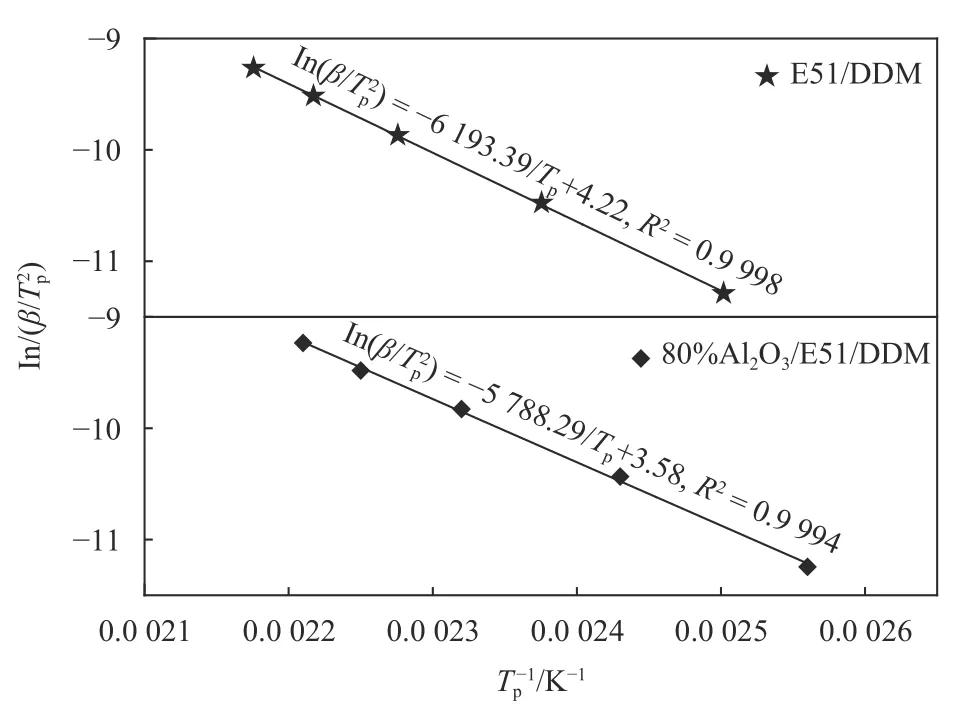
图 2 E51/DDM和80%Al2O3/E51/DDM体系的ln(β/Tp2)对1/Tp的线性回归图Fig.2 Kissinger plots of ln(β/Tp2) vs. 1/Tp for E51/DDM and 80%Al2O3/E51/DDM system
拟合曲线相关系数R>0.9 997,说明各数据点之间线性关系良好. 采用式(6)计算Ea和lnA结果列于表2中. 分析结果表明,Al2O3粉体的加入,E51/DDM固化反应活化能由51.49 kJ/mol降低到48.12 kJ/mol,说明在E51/DDM/Al2O3体系中,Al2O3在一定程度上能促进E51和DDM之间的反应. 这可能是由于Al2O3表面含有大量的羟基,Al2O3粉体的加入使80%Al2O3/E51/DDM体系中既存在图3(a)的E51与DDM的固化交联过程,同时又有图3(b)中结构的生成,B结构的生成促进了A类反应的发生. 同时,胺类固化剂上的氨基基团和环氧树脂链端的环氧基基团可以与Al2O3表面的羟基形成氢键,氢键物理交联结构的存在,更有利于提高体系的稳定性.

表 2 E51/DDM和80%Al2O3/E51/DDM体系动力学参数Ea,n,lnA和α(t)Tab.2 Ea, n, lnA and α(t) of Cure Reaction of E51/DDM and 80%Al2O3/E51/DDM system

图 3 (a)E51/DDM和(b)80%Al2O3/E51/DDM体系交联固化示意图Fig.3 A the chemical reaction involved in crosslinking processes of epoxy resin and B the interaction between Al2O3 powder particles and E51 matrix
环氧树脂的固化是极其复杂的化学反应过程,涉及到官能团之间的反应、各支链之间的交联聚合等. 求取活化能之后,采用Crane方程[11](式7)可计算出环氧树脂体系的固化反应级数n. 式中Ea/nR≫2Tp,2Tp可忽略不计.
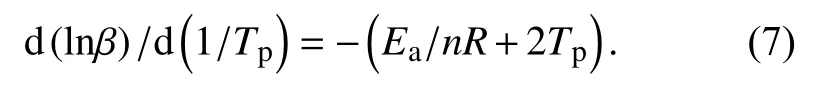
同样根据表1中数据以lnβ对1/Tp作图,如图4所示.
相关系数R>0.9998,说明各数据点之间线性良好,计算结果列于表2中. 实验数据表明,Al2O3的加入对反应级数n无显著影响.
为了确定环氧树脂体系固化转化率与反应时间、温度的关系,合并式(3)和式(4)得到式(8),对式(8)进行积分后得到式(9):


将环氧树脂体系的反应动力学参数Ea、A和n代入式(9),得到如表2中所示的固化动力学方程. 由方程可知反应时间越长、反应温度越高,转化率也越大.
2.2 热降解动力学分析
不同升温速率5,10,15和20 ℃/min时E51/DDM和80%Al2O3/E51/DDM体系对应的热重曲线如图5所示. 从DTG曲线中可以看出不同升温速率下最快分解速率对应的温度(Tmax)向更高温度偏移.
实验分析中假设热降解过程仅取决于转化率f(α)和反应温度T. 热降解动力学方程可表达为
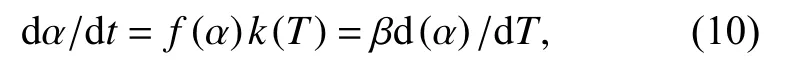
其中,t为时间,k(T)为速率常数的温度关系式,β为升温速率,α是质量损失百分数,计算如式(11)所示.
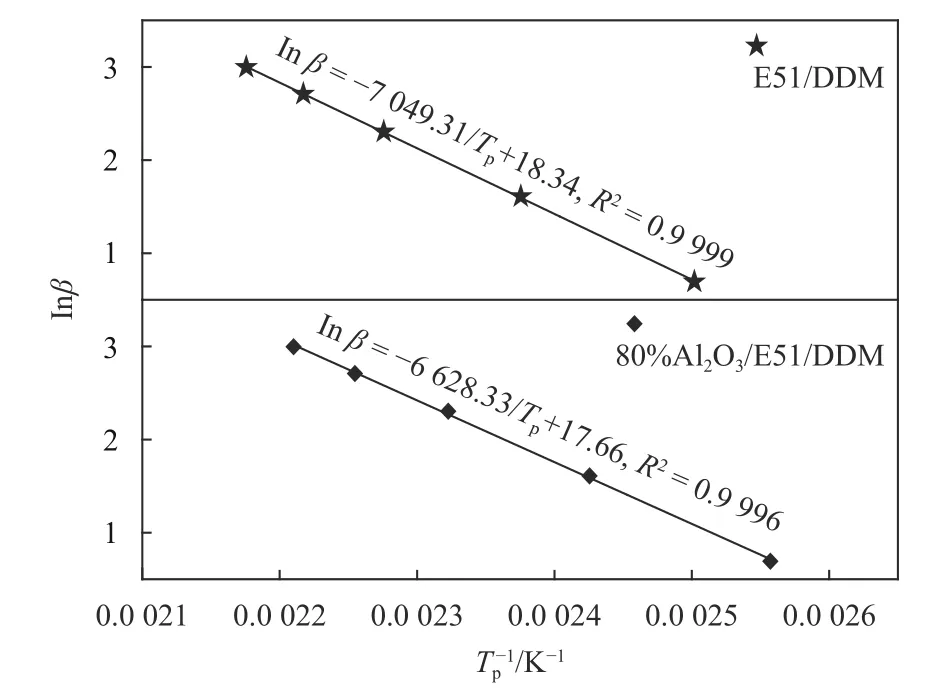
图 4 E51/DDM和80%Al2O3/E51/DDM体系的lnβ对Tp–1的线性回归图Fig.4 Crane plots of ln(β)vs. Tp-1for 80%Al2O3/E51/DDM system

图 5 不同升温速率下(a) E51/DDM和(b)80% Al2O3/E51/DDM体系的TG和DTG曲线Fig.5 TG and DTG curves of at different heating rates (a) E51/DDM and (b) Al2O3/E51/DDM system
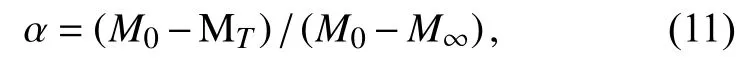
其中,M0是初始质量,MT是温度T时样品的质量,M∞是样品残余质量.
由Arrhenius方程,
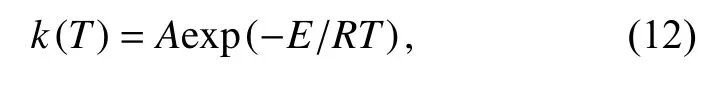
式中,A是指前因子,R是气体常数,E是反应活化能.将其带入式(1)中通过分离变量可以得到式(13),

有很多数学假设可以通过P(u)来确定反应活化能,其中Kissinger-Akahira-Sunoe[12]式(14)和Flynn-Wall-Ozawa(FWO)[13]式(15)方法是目前使用最多的两种方法.
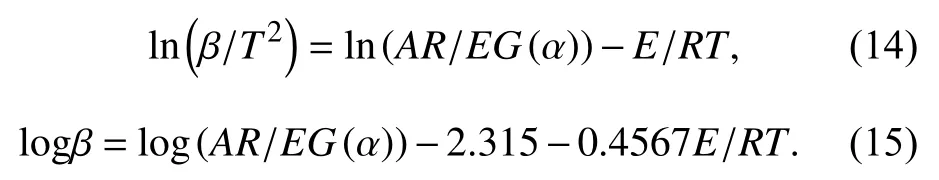
实验中采用FWO方法进行解析,在固定转化率的情况下通过拟合直线logβ−1/T的斜率可以求解出固化体系热降解过程的反应活化能,不同降解率下的活化能如图6所示.

图 6 不同降解程度下E51/DDM和80%/Al2O3/DDM体系的降解活化能变化Fig.6 Variation of degradation activation energy vs. degree of conversion for the E51/DDM and 80%Al2O3/E51/DDM system
从图6中可以看出,Al2O3的存在对环氧树脂分解过程的活化能有着显著的影响,特别是在分解的早期阶段和最后阶段. 早期分解阶段80%Al2O3E51/DDM体系活化能低于E51/DDM体系,当降解率达到30%左右时Al2O3粉体开始对E51/DDM体系热降解起抑制作用,且降解率越大抑制越明显,说明无机填料Al2O3的添加更加有利于E51/DDM固化后形成稳定的三维网络结构,提高体系的热降解稳定性.
2.3 热重红外分析
采用TG-FITR分析了E51/DDM固化物体系的热分解机理,并与加入80%Al2O3的E51/DDM固化物体系进行了比较. 图7分别给出了在相同时间T时E51/DDM和80% Al2O3/E51/DDM体系释放出小分子物质的3D红外结果和红外吸收光谱图.
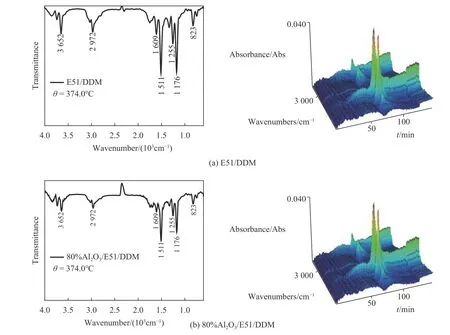
图 7 (a)E51/DDM 和(b)80%Al2O3/E51/DDM374 ℃下红外图谱和实时三维红外图谱Fig.7 FTIR diagrams at 374 ℃ and real time FTIR spectra of (a)E51/DDM and (b) 80% Al2O3/E51/DDM
由图7可以看出,环氧树脂复合材料在热降解过程中产生了大量的挥发性组分,有双酚A(850~800 cm–1),CO2(2 373~2 354 cm–1)、CO(2 251~2 149 cm–1)、H2O(3 907~3 896 cm–1)以及CN基团(1 120~1 095 cm–1). 其中CO和CO2主要是由醚基、甲氧基、甲基和亚甲基等官能团裂解生成,H2O的产生可能来自脂肪族和芳香族羟基的裂变[14]. 通过对比挥发性组分红外光谱图,加入Al2O3后与纯环氧树脂降解过程中产生气体组分基本相同,但是在相同分解温度下,纯环氧树脂体系各组分气体的吸收峰的强度明显大于加入Al2O3后的环氧树脂体系,说明Al2O3粉体加入可以增强E51和DDM固化剂之间的相互作用,同时抑制了环氧树脂体系的热降解,提高了环氧树脂的热稳定性,此结果与图3中提出的作用机理相一致.
2.4 玻璃化转变温度分析
玻璃化转变是表征热固性树脂的热效应的一项重要指标,实验中利用DSC测定了试验样品的玻璃化转变温度(Tg),实验结果如图8所示.
图 8 E51/DDM和80%Al2O3/E51/DDM体系玻璃化转变温度对比Fig.8 Effect of Al2O3 on Tg of E51/DDM system
由图8可以看出,加入Al2O3粉体后环氧树脂固化体系的玻璃化转变温度从114.16 ℃提高到121.51 ℃.Al2O3的加入促使E51/DDM体系玻璃化转变温度的提高主要有两方面原因. 一方面,大量Al2O3颗粒的加入增加了体系的黏度,降低了环氧树脂分子链运动的自由体积,阻碍了环氧树脂大分子链的运动;另一方面,Al2O3颗粒表面有大量的羟基促使体系交联网络中生成更多的醚类结构,使得三维网络结构更加致密[15],这也是其热降解活化能增大的主要原因.
2.5 动态热机械分析
DMA能够测试在一定的频率和温度范围内样品的阻尼行为和模量,力学模量依赖于分子状态,因此通过研究DMA的测试曲线能够得到有关填料与基体的相互作用信息. 图9为E51/DDM 和 Al2O3/E51/DDM固化物的储能模量随温度的变化曲线.

图 9 E51/DDM和80%Al2O3/E51/DDM体系储能模量对比Fig.9 DMA curves for E51/DDM and 80%Al2O3/E51/DDM system
从图9中可以看出,Al2O3的加入使得环氧树脂体系模量明显升高. Al2O3粉体增强E51/DDM环氧树脂体系的机理主要与颗粒机械约束方式限制基体树脂变形有关. 在外加负载作用下,Al2O3粉体和基体共同承担负载,Al2O3粉体会限制E51/DDM体系的运动和变形;另一方面,Al2O3粉体表面含有的大量−OH基团与双酚A型环氧树脂的环氧基官能团和DDM固化剂氨基基团之间存在较强的作用力,三者之间可以形成氢键物理交联结构,更有利于提高体系的稳定性,因此当Al2O3粉体均匀分散在E51/DDM体系中时,可以很好地起到强化作用,从而提高E51/DDM体系的强度和模量.
3 结论
1) 用非等温动力学方法研究了Al2O3填料对E51/DDM体系的固化动力学影响. 结果表明,Al2O3的加入降低了固化反应的活化能,而对反应级数和指前因子影响较小. 同时运用Kissinger和Crane方程得到E51/DDM和80%Al2O3/E51/DDM体系的动力学方程.
2) 用Flynn-Wall-Ozawa法对环氧树脂的热降解动力学进行了分析. Al2O3的加入对环氧树脂热降解前期无明显影响,当热降解率达到30%时,对环氧树脂体系降解起到明显抑制作用,且随着降解率的升高抑制效果增强.
3) Al2O3粉体能提高E51/DDM体系的热稳定性,80% Al2O3填料加入后环氧树脂体系的玻璃化转变温度从114.16 ℃提高到121.51 ℃,储能模量由2 386 MPa提高到2 589 MPa,进一步说明Al2O3粉体的加入可以促使环氧树脂在固化过程中形成更为致密的三维交联网状结构,使得E51/DDM体系更加稳定.
