羊肉发酵香肠的菌剂制备及产品风味品质探究
2019-10-16
贵州大学酿酒与食品工程学院 贵州贵阳 550025
随着肉类加工的不断发展寻找合适的发酵剂,缩短发酵时间、降低安全风险成为发酵肉制品的关键点[1]。发酵制品往往是潜在的发酵菌来源[2],从发酵肉制品中分离出的细菌主要有乳酸杆菌属和乳酸片球菌属,这两种细菌可代谢乳酸降低pH值来抑制病原菌的生长,提高其安全性。乳酸菌在发酵过程中可促进Maillard反应、脂质降解或氧化[3]、蛋白质水解[4]、碳水化合物发酵及氨基酸分解代谢等,同时产生与肉制品相关的风味[5]。
发酵肉的风味同样来自于霉菌及酵母等对肉中脂肪、蛋白质的分解[6]。霉菌常存在于干发酵香肠,使产品具有干香肠特殊的芳香气味和外观。霉菌所代谢的酶具有蛋白分解和脂肪分解能力,因此有利于产品风味的形成,且生长在产品表面,可以隔氧,防止酸败。大多数根霉脂肪酶具有Sn-1(3)位置特异性[7],将适量具有这一特性的脂肪酶加入香肠中可以显著增加香肠的香气,加速脂肪的氧化及水解[8],并促进挥发性风味物质的形成。本研究将乳酸片球菌与米根霉分别制备为菌剂,利用最佳发酵工艺制备羊肉发酵香肠,通过CO组与CO+PR组对比分析羊肉发酵香肠风味物质,探究复配菌剂对羊肉发酵香肠品质的影响。
1 材料与方法
1.1 材料与试剂
CICC10344乳酸片球菌,中国工业微生物菌种保藏管理中心;
ATCC96382米根霉,广东省微生物菌种保藏管理中心;
十一碳酸甘油三脂,Sigma公司;
正己烷、甲醇,色谱纯;
其他试剂均为国产分析纯。
1.2 仪器与设备
TGL20M台式高速冷冻离心机,长沙迈佳森仪器设备有限公司;
YXQ-LS-100SII立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;
FD-1A-50真空冷冻干燥机,江苏天翔仪器有限公司;
Agilent7820A气相色谱仪(美国安捷伦公司),自动进样塔;
ParkerH2PEM-165氢气发生器(美国派克公司)。
1.3 方法
1.3.1 菌液制备
乳酸片球菌按说明书活化2代,接种于乳酸片球菌种子培养基中,37℃培养24h,再从种子培养基中取2%菌液加入乳酸片球菌扩大培养基中,37℃培养24h,6 000r/min离心10min,去上清液,用生理盐水清洗3次,加入无菌水,调整活菌数至108cfu/mL。
米根霉按说明书活化2代,转接至斜面培养基中,30℃培养3~5d,取斜面培养基[9]加入5mL无菌水并轻轻刮下孢子,重复清洗3次,合并孢子液于有玻璃珠的三角瓶中,反复振荡后用带有灭菌脱脂棉的漏斗过滤,得到孢子液,调整孢子液浓度为107cfu/mL。
1.3.2 保护剂制备
将脱脂乳和海藻糖分别配制为30%、25%、20%、15%、10%(w/v)5个浓度;山梨糖醇和甘露醇分别配制为6%、9%、12%、15%、18%(w/v)5个浓度;甘油配制为2%、6%、10%、14%、18%。脱脂乳灭菌时间为115℃,10min,其余均为121℃,15min。
冻干试验中,脱脂乳和海藻糖的浓度分别为15%、12.5%、10%、7.5%、5%(w/v);山梨糖醇和甘露醇的浓度分别为3%、4.5%、6%、7.5%、9%(w/v);甘油浓度为1%、3%、5%、7%、9%。
1.3.3 菌剂制备实验
以冷冻干燥活菌数为指标,探究海藻糖、脱脂乳、山梨糖醇、甘露醇和甘油等保护剂对菌种存活率的影响。在此基础上设计L9(34)正交试验。
1.3.3.1 真空冷冻干燥
分别取5个梯度浓度保护剂液体1.0mL,再加入调整后的菌泥悬浮液1.0mL。室温下平衡30min放置于-78℃超低温冰箱中冷冻3h取出置于冷冻干燥机中干燥24h。
1.3.3.2 活菌计数
活菌计数参照Zayed G, Roos Y H.[10](2004)等方法进行。
1.3.4 羊肉发酵香肠制备方法
CO组:羊肉瘦肥以8∶2配比,加入1.5%盐,0.7%蔗糖,2%高度白酒,15%冰水,于4℃下冷藏24h。
CO+PR组:羊肉瘦肥以8∶2配比,加入1.5%盐,0.7%蔗糖,2%高度白酒,15%冰水,于4℃冷藏24h。取出后加入2%复配菌剂,菌剂复配比例(RO∶PA)为1∶1。
将空白组与菌剂组分别灌肠,于32℃下发酵16h,再于15℃下干燥1d,10℃下干燥2d,5℃下干燥2d即得羊肉发酵香肠成品。
1.3.5 羊肉香肠风味测定
通过顶空固相微萃取(HS-SPME)提取具有发酵香肠顶空瓶的顶部空间中的挥发性化合物。取2.0g样品,置于10mL固相微萃取仪采样瓶中,插入装有2cm-50/30μmDVB/CAR/PDMS StableFlex纤维头的手动进样器,在70℃条件下顶空萃取40min,移出萃取头并立即插入气相色谱仪进样口(温度250℃)中,热解析3min进样。
气相色谱条件:色谱柱为FB-5(30m×0.25mm×0.25μm)弹性石英毛细管柱,柱温40℃(保留2min),以4℃/min升温至240℃,运行时间52min;汽化室温度250℃;载气为高纯He(99.999%);柱前压6.84psi,载气流量1.0mL/min;不分流进样;溶剂延迟时间1min。
MS条件:离子源温度230℃;四极杆温度150℃;电子能量70eV;发射电流34.6μA;倍增器电压1 706V;接口温度280℃;质量范围29~450amu。
定性定量分析:对总离子流图中各峰经质谱计算机数据系统检索、人工解析图谱及与Nist2005和Wiley275质谱库匹配,并参考有关文献定性确定化合物,用峰面积归一化法确定各化学成分的相对百分含量
1.4 统计分析
通过单因素方差分析(ANOVA)细胞存活率,利用Origin8.5软件对数据进行处理。使用Fisher最小显著性差异检验(5%)比较平均值(HSD0.05)。
2 结果与讨论
2.1 菌剂制备试验
2.1.1 海藻糖(TER)与脱脂乳(SM)对乳酸片球菌存活率的影响
由图1可知,当脱脂乳保护剂添加量达到10%时,其最高存活率为30.37±1.28%,即活菌数为23.99×108cfu/g。未添加保护剂的乳酸片球菌存活率为0.84±0.33%,与添加保护剂后的冷冻干燥乳酸片球菌存活率相比增加了29.53±0.95%。但高浓度的脱脂乳中含有大量乳糖及蛋白,使细胞内部形成较强的玻璃化结构反而不利于细胞存活。经数据分析,脱脂乳各浓度间差异极显著(p<0.01),浓度为10%与其他添加浓度间呈极显著差异(p<0.01),其他浓度间差异不显著(p>0.05)。

图1 海藻糖与脱脂乳对乳酸片球菌存活率的影响Fig. 1 The protective effect of trehalose and skim milk on Pediococcus acidilactici
海藻糖作为保护剂时,其趋势与脱脂乳类似。当海藻糖添加量为10%时,有最高存活率为28.15±1.27%。统计分析,海藻糖各浓度间差异显著(p<0.05),浓度添加量为15%与添加量12.5%呈显著性差异(p<0.05);添加量为15%与添加量10%呈极显著差异(p<0.01);其他添加量之间差异不显著(p>0.05)。海藻糖属于二糖,C.Dini[11](2013)等研究发现海藻糖对于菌种具有较好的保护作用,主要是细胞表面存在磷脂、蛋白质等,糖类可通过与细胞表面的氢键相互作用以代替蛋白质表面的水分子,从而在干燥完成后稳定其极性基团。
2.1.2 山梨糖醇(SOL)与甘露醇(MAN)对乳酸片球菌存活率的影响
由图2可知,在添加4.5%山梨糖醇后其存活率最高为20.00±1.56%。山梨酸钾各浓度间差异极显著(p<0.01),添加量4.5%与添加量6%间呈差异显著(p<0.05),添加量4.5%与其他添加量之间呈差异极显著(p<0.01),其他各浓度间不存在显著性差异。

图2 山梨糖醇与甘露醇对乳酸片球菌存活率的影响Fig. 2 The protective effect of sorbitol and mannitol on Pediococcus acidilactici
添加浓度4.5%的甘露醇后存活率最高为22.74±1.17%,甘露醇各浓度间差异极显著(p<0.01),添加量4.5%与添加量6%间呈差异显著(p<0.05),添加量4.5%与其他添加量之间呈差异极显著(p<0.01),添加量6%与7.5%间差异不显著,添加量6%与其他添加量间差异显著(p<0.05),其他各浓度间差异不显著。甘露糖醇的保护作用主要是由于甘露糖醇的表面亲和力较高[12],可以将细胞进行包被,保护细胞在极端条件下存活。Anasal-Hussein[13](2012)等研究发现甘露醇可以在储存5个月后显著改善菌种生存能力。
2.1.3 甘油(GLY)对乳酸片球菌存活率的影响
由图3可知,添加甘油后其存活率最高为11.41±0.67%,甘油各浓度间差异不显著(p>0.05),说明甘油不适合保存乳酸片球菌。在本试验中可明显看出甘油保护乳酸片球菌的效果并不理想,这与朱东升[14](2010)等制备乳酸菌菌粉时使用甘油的研究结果相似。甘油对乳酸片球菌的保护能力较弱,可能与渗透型保护剂使用浓度渗入细胞的能力有关[15]。

图3 甘油对乳酸片球菌存活率的影响Fig. 3 The protective effect of glycerol on Pediococcus acidilactici
2.1.4 乳酸片球菌粉保护剂正交试验结果
由单因素试验结果选择海藻糖(TER)、脱脂乳(SM)、甘露糖醇(MAN)进行L9(34)正交试验。测定未冷冻干燥的乳酸片球菌活菌数为3.95×108cfu/g,表1为正交试验结果。
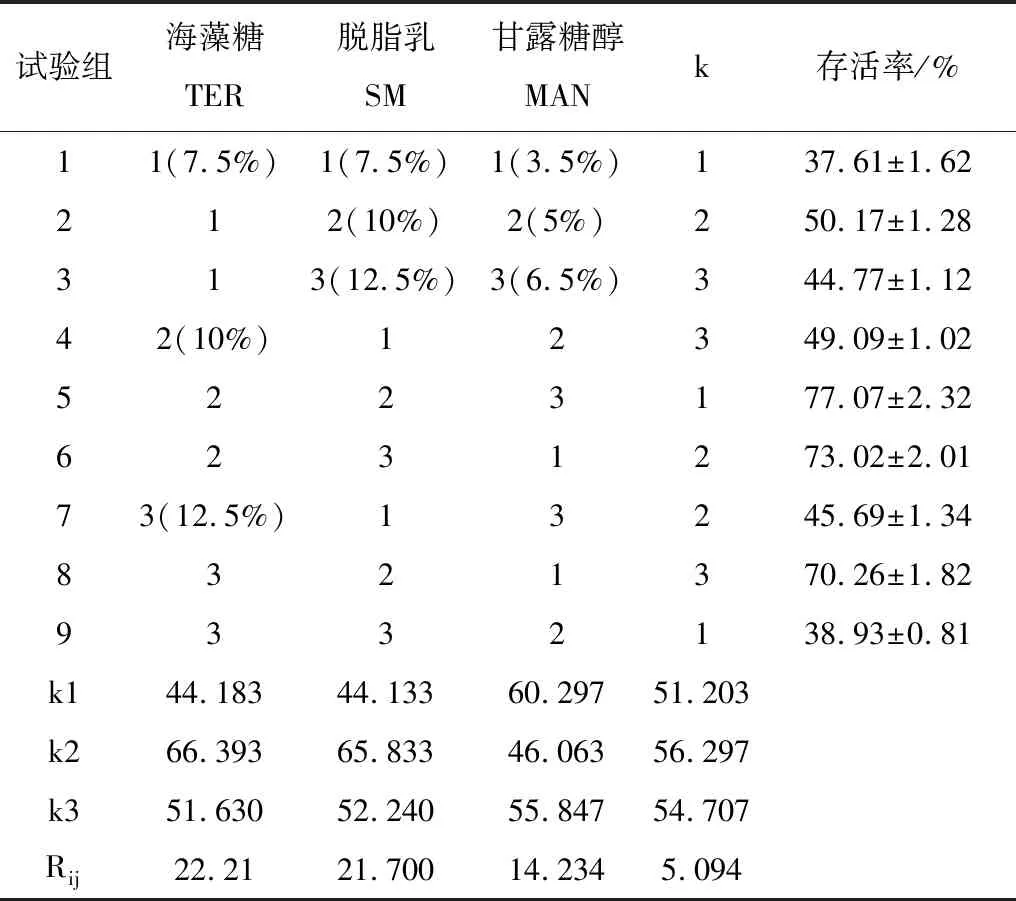
表1 乳酸片球菌保护剂正交试验及分析
注:k为空列。
由表1可知,影响乳酸片球菌存活率的主次因素为TER>SM>MAN,即海藻糖浓度>脱脂乳浓度>甘露醇浓度。海藻糖浓度对乳酸片球菌存活率具有及其显著的影响(p<0.01),脱脂乳与甘露醇对米根霉孢子存活率的影响较小。因此制备乳酸片球菌保护剂的最佳复配条件为海藻糖10%,脱脂乳10%,甘露醇3.5%,此条件下的存活率可达77.07±2.32%。
2.2 米根霉孢子粉制备
2.2.1 海藻糖(TER)与脱脂乳(SM)对米根霉孢子存活率的影响
由图4可知,海藻糖对米根霉孢子的保护作用呈先上升后下降的趋势,当海藻糖浓度为10%时米根霉孢子存活率达到27.47±1.92%。经数据分析,海藻糖各浓度间差异显著(p<0.05),海藻糖浓度为10%时与浓度5%、15%之间呈差异显著(p<0.05),其他浓度间差异不显著(p>0.05)。

图4 海藻糖与脱脂乳对米根霉孢子存活率的影响Fig. 4 The protective effect of trehalose and skim milk on spore power of Rhizopus oryzae
脱脂乳对米根霉孢子的保护趋势与海藻糖类似,当脱脂乳浓度为10%时米根霉存活率达到26.22±1.96%。脱脂乳各浓度间差异显著(p<0.05),当脱脂乳浓度为10%时与浓度5%间呈差异显著(p<0.05),其他浓度间差异不显著(p>0.05)。
2.2.2 山梨糖醇(SOL)与甘露糖醇(MAN)对米根霉孢子存活率的影响
由图5可知,山梨糖醇浓度为6%时,米根霉孢子存活率为12.48±1.49%。甘露糖醇浓度为6%时,米根霉孢子存活率为11.24±1.54%。山梨糖醇与甘露糖醇各浓度间均不显著(p>0.05)。山梨糖醇与甘露糖醇对米根霉孢子的保护作用较差,可能是由于多元醇的保护机理是结合细胞壁上的蛋白质形成糖蛋白对细胞进行保护,而真菌细胞壁的主要成分为多糖,蛋白质占比小,无法将孢子完全包被[10]。

图5 山梨糖醇与甘露糖醇对米根霉存活率的影响Fig. 5 The protective effect of sorbitol and mannitol on spore power of Rhizopus oryzae
2.2.3 甘油(GLY)对米根霉孢子存活率的影响
由图6可知,甘油浓度为5%时对米根霉孢子有最佳保护作用,此时存活率为19.98±1.14%。甘油各浓度间差异显著(p<0.05),当甘油浓度为5%时与浓度1%间呈差异显著关系(p<0.05);其他甘油浓度间差异不显著(p>0.05)。甘油能透过米根霉孢子的细胞壁,进入细胞内,使细胞内溶质浓度升高,细胞内压力接近于细胞外压力,降低细胞外干燥或冻结引起细胞脱水皱缩的程度和速度,从而减少冷冻干燥过程对细胞的损伤。

图6 甘油对米根霉孢子存活率的影响Fig. 6 The protective effect of glycerol on spore power of Rhizopus oryzae
2.2.4 米根霉孢子粉正交试验结果
根据单因素试验选择海藻糖(TER)、脱脂乳(SM)和甘油(GLY)进行L9(34)正交试验。测定未冷冻干燥的米根霉活菌数为2.86×107cfu/g,表3为正交试验结果。

表2 米根霉孢子保护剂正交试验及分析
注:k为空列。
由表2可知,影响米根霉存活率的主次因素为TER>SM>GLY,即海藻糖浓度>脱脂乳浓度>甘油浓度。海藻糖浓度对米根霉存活率具有及其显著的影响(p<0.01),脱脂乳与甘油对米根霉孢子存活率的影响较小。方差分析结果表明,制备米根霉孢子保护剂的最佳复配条件为海藻糖10%,脱脂乳12.5%,甘油3.5%,此条件下米根霉孢子存活率可达73.79±2.57%。
2.3 羊肉发酵香肠风味分析
采用HS-SGME-GC/MS的方法对两组羊肉发酵香肠进行分析,由表可知空白组(CO)共鉴定出60种挥发性风味物质,其中醇、酯类相对含量最高分别为22.33%、67.138%。CO+PR组中酮、醇、酯相对含量较高,分别为30.911%、21.708%、39.512%。菌剂组(CO+PR)共鉴定出57种挥发性风味物质,其中酮类、醇类、酯类相对含量较高,分别为30.911%、21.708%、39.512%。可见羊肉发酵香肠的主要风味成分来自于醇类、酯类、醇类化合物。
通过对比空白组(CO)、菌剂组(CO+PR)的风味成分可知两种羊肉香肠共同测出的挥发性风味物质有55种。两组香肠风味物质种类上无明显差异(p>0.01),但是添加保护剂后的羊肉香肠中酮类物质和酯类物质含量差异显著(p<0.01)。大多数酮起源于脂质氧化,而有一些酮类则是通过美拉德反应形成,如:3-羟基丁-2-酮、甲基酮可通过微生物酯化产生,也可通过亚油酸氧化分解得到[16]。由表4、表5可知,与CO组相比,CO+PR组酮的相对含量较高,因此酮对CO+PR组的风味影响较大。CO组与CO+PR组的酯类含量均较高。其中,己酸乙酯、辛酸乙酯、丁酸乙酯在检测中相对含量最高,这三种酯可能来自腌制时用的白酒,也有可能来自己酸、丁酸、辛酸与醇进行酯化反应得到,这些酸均能通过微生物发酵碳水化合物产生[17~19]。

表4 羊肉发酵香肠挥发性风味种类及相对含量

表5 羊肉发酵香肠中挥发性风味物质相对含量及香味描述
续表5

类别风味物质香味描述相对含量/%COCO+PR酸类2-甲基丙酸强烈刺激性气味0.014———己酸汗臭味2.4470.315乙酸醋酸味———1.204酯类乙酸乙酯强烈的果香、酒香香气、菠萝香和香蕉的香味0.4940.615乙酸丙酯特殊的水果香味0.081———异丁酸乙酯水果和奶油香气0.0530.09甲酸戊酯水果香味0.2620.26丁酸乙酯强烈的甜果香,有菠萝、香蕉、苹果气息1.8660.885乳酸乙酯朗姆酒、水果和奶油的香气0.7210.4142-甲基丁酸乙酯强烈苹果皮、菠萝皮和未成熟李子皮香气0.1620.4843-甲基丁酸乙酯类似苹果、香蕉的香气和酸甜气味0.2520.676乙酸异戊酯愉快的香蕉香味0.1890.014戊酸乙酯苹果香气0.5550.557γ-丁内酯核桃味或甘草味0.0150.031己酸甲酯菠萝似香气0.0160.015己酸乙酯水果香气味56.25531.391庚酸乙酯菠萝香气味1.3710.662-乙基-己酸乙酯0.0680.045辛酸乙酯白兰地的香气,并有甜味3.1962.227壬酸乙酯油脂、水果和白兰地酒似香气0.370.263癸酸乙酯椰子香味0.9510.729月桂酸乙酯花生香气0.0430.028十四酸乙酯椰子和鸢尾似香气和甜的蜂蜡似风味0.0790.05十六酸乙酯弱蜡香、果爵和奶油香气0.0680.056油酸乙酯鲜花香气0.0710.022萜烯类苯乙烯特殊香气0.1070.195α-蒎烯松木、针叶及树脂样的气息0.010.013脂肪烃十二烷刺激性气味0.1070.081十三烷刺激性气味0.0680.047十四烷刺激性气味0.080.066杂环类2-戊基呋喃豆香、果香、泥土、青香及类似蔬菜的香韵0.0470.061其他柠檬油精极强的桔子、柠檬香气0.0680.138
3 结论
在单因素实验基础上进行正交实验,对制备乳酸片球菌菌粉与米根霉孢子粉的保护剂进行复配优化,筛选出对乳酸片球菌菌粉与米根霉孢子粉存活率具有显著影响的菌种配比:乳酸片球菌(海藻糖10%,脱脂乳10%,甘露醇3.5%),米根霉(海藻糖10%,脱脂乳12.5%,甘露醇3.5%)。制备存活率较高的乳酸片球菌菌粉和米根霉孢子粉。利用最优工艺条件制备菌剂发酵羊肉香肠共检测出的挥发性风味物质有55种,经分析发现,在羊肉发酵香肠中添加菌剂后己醛、(E)-2-壬烯醛、己酸等亚油酸氧化产物减少,同时在加入菌剂后3-羟基-2-丁酮、2,3-丁二酮、乙酸等含量分别增加了27.02%,1.662%,1.204%,这些风味物质气味阈值低对羊肉整体风味贡献较大,能改善羊肉发酵香肠风味。
