靶向MUC1CAR-NK对小鼠胃癌模型的抗肿瘤作用实验研究
2019-10-14朱贝韩双印杨亚莉
朱贝 韩双印 杨亚莉

【摘 要】目的:观察由靶向黏蛋白1(Mucl protein 1,MUC1)嵌合抗原受体修饰的NK细胞(Chimeric antigen receptor-Natural killer cell,CAR-NK)对裸鼠胃癌模型肿瘤生长的影响。方法:首先,在48只裸鼠右肢腋下注入0.2ml浓度为105个/ml的人胃癌细胞(MGC-803)构建胃癌肿瘤模型。当小鼠肿瘤体积生长至约100mm3时,将小鼠随机分为对照组、实验1组、实验2组、实验3组、实验4组和实验5组。其中,对照组给予未修饰的浓度为1×105个/ml 的NK细胞;实验1-5组给予相同体积靶向MUC1的CAR-NK细胞,细胞浓度分别为1×105、1×106、1×107、1×108、1×109/ml。给药后,每隔3d统计肿瘤的长短径以及小鼠体重。自接种MGC-803 26d后,脱颈处死小鼠,称量小鼠肿瘤重量并计算其生长率。结果:与对照组比,各实验组瘤重明显减轻,瘤体积明显减少(P<0.05),但各实验组之间比较,无统计学差异(P>0.05)。与对照组比,各实验组小鼠的生长率明显增加(P<0.05),且实验1、2、3组显著高于实验4、5组(P<0.05)。此外,各组小鼠的肿瘤体积均随小鼠生长时间的延长呈逐渐增加趋势。且从第8d给予CAR-NK细胞治疗后,其余各实验组在相同给药时间点与对照组相比,均有统计学差异(P<0.05)。结论:裸鼠皮下移植肿瘤模型显示,靶向MUC1的 CAR-NK细胞对表达MUC1的MGC-803细胞生长具有较好的抑制作用,且所用浓度范围较广,安全系数较高。
【关键词】黏蛋白1;嵌合抗原受体NK细胞;胃癌;裸鼠模型
【中图分类号】R573 【文献标识码】A 【文章编号】1004-597X(2019)19-0031-02
胃癌是发病率较高的恶性肿瘤,由于前期症状不明显,易与其他慢性病混淆,多数患者至疾病晚期才得到诊断[1-2]。手术、放疗和化疗是目前胃癌治疗的主要方法,尽管能起到一定效果,但仍未明显改善患者预后[3]。基于嵌合抗原受体修饰T细胞或NK细胞是近年快速发展的免疫治疗新技术,在血液肿瘤中已取得良好的抗肿瘤作用。然而,在实体瘤中仍面临很大挑战。MUC1是在多种肿瘤表面表达的肿瘤相关抗原,靶向MUC1的各种免疫治疗策略已在实验室和临床试验中展开[4]。本研究制备靶向MUC1的CAR-NK细胞,观察其对MGC-803裸鼠模型的抑瘤作用,为胃癌的细胞免疫治疗探索新方法。
1.材料与方法
1.1 实验材料
1.1.1实验动物:6~8周龄,体重为20±2g的SPF级成年雄性BALB/c(nu)小鼠48只,均购自凯学生物科技(上海)有限公司。
1.1.2 主要实验细胞:人胃癌MGC-803和靶向MUCI的CAR-NK细胞均由本实验室提供。
1.2 实验方法
1.2.1 MGC-803培养:将人胃癌细胞株MGC-803常规培养、传代,取对数生长期细胞,PBS 洗涤3次,台盼蓝染色法检测其细胞活力,调细胞浓度为1×105/ml。
1.2.2 靶向MUC1的 CAR-NK细胞培养:取出冻存细胞,置于37℃恒温水浴中快速融化,于超净工作台内将细胞悬液吸出置于15ml离心管中,加入10ml RPMI l640培养基1000rpm/min离心5min洗涤,加入新鲜培养基重悬,置于含10%胎牛血清和100U/ml双抗的RPMI l640培养基中扩增培养。
1.3 胃癌小鼠模型的建立
1.3.1 将6周龄BALB/c裸鼠先置于SPF级环境中饲养3d后,称量小鼠初始体重。
1.3.2 小鼠状态适应后将对数生长期的MGC-803制备成浓度为1×105/ml单细胞悬液,吸取0.2ml 接种于BALB/c裸鼠右侧腋窝皮下[5]。
1.3.3 接种后每天观察小鼠状态以及成瘤状况,约第5d可摸到右肢下结节,当结节长径大于5mm时,表示模型构建成功。在肿瘤长到第8d时,用游标卡尺测量小鼠右肢下结节的长短径,并称量每只小鼠体重。
1.4实验治疗方法
当小鼠肿瘤体积生长至约100mm3(约接種MGC-803的第8d)时,对照组尾静脉给予0.2ml浓度为1×105/ml的正常NK细胞溶液;实验1-5组分别尾静脉给予0.2ml浓度为1×105、1×106、1×107、1× 108、1×109 CAR-NK/ml的靶向MUC1的CAR-NK细胞,且每隔3d尾静脉给药一次,共给药6次。同时每隔3d用游标卡尺测量肿瘤长径(A)和垂直横径(B),按公式V=A×B2/2计算肿瘤体积,绘制肿瘤体积增长曲线,同时称量小鼠体重并绘制体重生长曲线。免疫治疗结束后第3d,对小鼠的体重、瘤重以及剥瘤后体重进行称量。
1.5 统计学分析
采用SPSS19.0软件进行数据处理。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验和One-Way ANOVA方差分析。P<0.05为有统计学差异。
2.结果
2.1免疫治疗对小鼠行为学等特征的影响
模型建立前每只小鼠行为表现相似,正常饮水和进食。但自移植瘤模型成功建立后,对照组小鼠开始表现出活动量减少,精神状态差和食欲下降的症状,且在实验进行第16d时基本不进食;而接受CAR-NK细胞免疫注射治疗后的各实验组小鼠,精神状态都较对照组活泼,且食欲下降不太明显。
2.2 免疫治疗对各组小鼠瘤重和瘤体积的影响
与对照组相比,各实验组瘤重明显减轻,瘤体积显著减少,有统计学差异(P<0.05);但各实验组之间相比,无统计学差异(P>0.05),详见表1。

2.3 免疫治疗对各组小鼠生长率的影响
与对照组相比,各实验组小鼠生长率明显增高,有统计学差异(P<0.05);且实验1、2、3组小鼠的生长率显著高于实验4和5组,有统计学差异(P<0.05),详见表2。
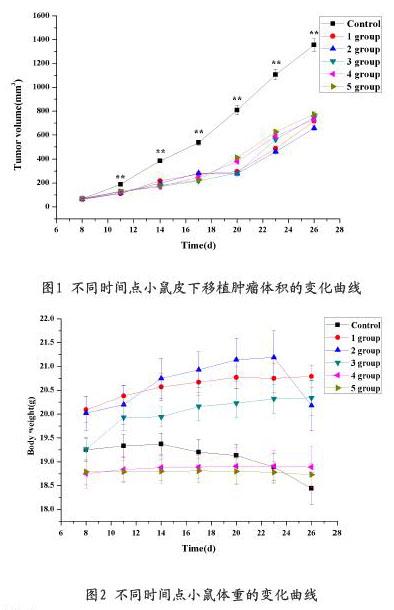
2.4 免疫治疗对小鼠肿瘤体积的影响
结果显示,各组小鼠的肿瘤体积均随小鼠生长时间的延长呈逐渐增加趋势(图1)。其中,对照组小鼠的肿瘤体积随生长时间持续增加,且增长速度较快;而各实验组则随小鼠的生长时间表现为较平缓增长。此外,从第8d给予CAR-NK细胞治疗后,其余各实验组在相同给药时间点与对照组相比,均有统计学差异(P<0.05),详见图1。

2.5 免疫治疗对各组小鼠体重的影响
在第8d给药后,实验1、2、3组小鼠体重出现短期快速增长,之后增长平缓;实验4、5组小鼠体重一直保持较慢增长,且在第23d后体重出现轻微的下降;而对照组小鼠体重表现出持续下降趋势,且随时间延长下降速度逐渐增快,详见图2。
3.讨论
MUC是一类高分子量糖蛋白,主要特征为含有一个高度糖基化的串联重复区,是目前研究较为深入的黏蛋白,属跨膜蛋白[6-7]。人MUC1基因定位于1q21.24 位点上,MUC1 蛋白由多肽骨架和O-糖苷键链接的糖基侧链组成,多肽骨架由胞内段、跨膜段、胞外段三个部分构成。其中胞内段可介导细胞信号转导,且胞内段和跨膜段在不同种属之间的结构高度保守;胞外段决定MUC1 空间结构特异性和免疫原性[8-9]。通常情况下,由上皮细胞产生的MUC1 可在黏膜表面形成胶样凝胶,发挥润滑、保护黏膜以及屏障作用。当细胞癌变时,MUC1结构与功能也随之变化,直接参与肠癌、膀胱癌等的发生发展[10-11]。MUC1在癌细胞中的表达量明显增加,呈非极性,同时MUC1糖链的糖基化异常,糖链变短且分支减少,可引起新糖链表位形成及肽链表位暴露,使MUC1成为能被免疫系统识别的肿瘤抗原。有学者认为MUC1作为一种肿瘤免疫抗原,在对其进行靶向效应时,或可对肿瘤的进展产生一定影响。
胃癌是我国最常见的恶性肿瘤之一,其发生发展是一个多因素、多步骤的复杂过程。随着人们对肿瘤研究的不断深入,MUC1在胃癌表达和转移中的作用也日益凸显[12]。有研究表明,MUC1粘蛋白的表达增加与胃癌的预后较差显著相关[13]。Grohmann等[14]对128例胃癌标本的研究显示,MUC1在管状腺癌中的表达比印戒细胞癌、硬癌或未分化癌中强;在肠型胃癌中的表达比在弥漫性胃癌中强,且在I期患者中的表达与预后呈负相关。因此,可通过检测MUCl的表达来确定胃癌的恶性程度及预后判定。综上所述,本文主要针对MUC1免疫抗原构建靶向MUC1的CAR-NK细胞对胃癌肿瘤模型进行免疫治疗。
本研究发现:与对照组相比,各实验组瘤重明显减轻,瘤体积明显减少说明靶向MUC1的 CAR-NK细胞有抑制肿瘤增长的作用;与对照组相比,实验组小鼠的生长率明显增加,且实验1、2、3组的生长率显著高于实验4、5组,提示1、2、3组靶向MUC1的CAR-NK细胞浓度抑制胃瘤小鼠效果较为理想。国内外已有研究报道,采用MUC1-2 VNTR基因治疗后可明显减小肿瘤体积及质量[15-16],与本研究结果相一致。此外,本研究显示,各实验组小鼠的瘤体积随小鼠生长时间延长而缓慢增加,而对照组小鼠的瘤体积随小鼠生长时间延长呈快速增长趋势。但在小鼠体重方面,第8d给药后,实验1、2、3组小鼠体重出现了短期快速增长,之后增长平缓;实验4、5组小鼠体重一直保持较慢增长直至23d后出现轻微的体重下滑;而对照组小鼠体重表现出持续下滑的趋势,提示1×105、1×106、1×107 CAR-NK/ml浓度的靶向 MUC1 的CAR-NK细胞对小鼠体重影响较大。从上可知,靶向MUC1的CAR-NK细胞对小鼠胃癌肿瘤模型具有较好的治疗作用。
综上所述,靶向MUCI的CAR-NK细胞对于表达MUC1的MGC-803所形成的实体瘤生长具有较好的抑制效果,且所用浓度范围较广,安全系数较高,可减轻疾病所带来的痛楚,为后续深入研究抑制胃癌肿瘤的作用机理奠定了坚实的基础。
参考文献
[1]TsaiMC,WangCC,LeeHL.Healthdisparitiesareassociatedwithgastriccancermortality-toincidenceratiosin57countries[J].WorldJournalofGastroenterology,2017,23(44):7881-7887.
[2]宋杰,陳凤格,赵伟等.胃癌的发病率现状与治疗研究进展[J].中国慢性病预防与控制,2016,24(9):704-707.
[3]ZhaoTT,XuH,XuHMetal.Theefficacyandsafetyoftargetedtherapywithorwithoutchemotherapyinadvancedgastriccancertreatment:anetworkmetaanalysisofwelldesignedrandomizedcontrolledtrials[J].GastricCancer,2018,21(6):1-11.
[4]邱凌翀,卢悟广,蔺智兵等.一种靶向MUC1及PD-1的双靶点蛋白疫苗设计及其体液免疫学分析[J].基因组学与应用生物学,2016,35(3):513-519.
[5]闫金银,张晓云,李宁等.S-烯丙基巯基半胱氨酸对乳腺癌细胞裸鼠移植瘤的抑瘤作用及其机制[J].山东医药,2017,57(39):36-38.
[6]NathS,MukherjeeP.MUC1:amultifacetedoncoproteinwithakeyroleincancerprogression[J].TrendsinMolecularMedicine,2014,20(6):332-342.
[7]刘妮龙,戴立言,边超,等.粘蛋白1串联重复区自身抗体检测ELISA方法的建立及其在癌症检测中的应用[J].现代肿瘤医学,2018,26(21):42-45.
[8]AnkeV,SandraT,TinaE,etal.InvitroassessmentoftheexpressionandTcellimmunogenicityofthetumorassociatedantigensBORIS,MUC1,hTERT,MAGEA3andSp17inuterinecancer[J].InternationalJournalofMolecularSciences,2016,17(9):1525.
[9]刘春辉,赵鹏,张国志.黏蛋白在肿瘤中的应用[J].中国煤炭工业医学杂志,2014,17(9):1537-1542.
[10]CascioS,SciurbaJ,FinnO.EpigeneticregulationofMUC1inNFkBtargetgeneexpressionofproinflammatorycytokinesincoloncancer[J].CancerResearch,2015,75(15):2886.
[11]Simms,Hughes,Bishop.MUC1mucinasatumourmarkerinbladdercancer[J].BjuInternational,2015,84(3):350-352.
[12]周红凤,付冬伟,胡晓薇等.胃癌组织中的MUC1和VEGF表达及其意义[J].现代生物医学进展,2014,14(25):4950-4953.
[13]ParkKU,JinYK,DoYRetal.IncreasedexpressionofMUC1andclaudin10isassociatedwithpoorprognosisofpatientswithgastriccancer[J].CancerResearch,2011,71(8):3161.
[14]GrohmannGPM,SchirmacherP,ManzkeO,etal.ModulationofMUC1andbloodgroupantigenexpressioningastricadenocarcinomacellsbycytokines[J].Cytokine,2003,23(3):93.
[15]刘月波,周澤平,王浩等.MUC1-2VNTR基因免疫治疗多发性骨髓瘤荷瘤小鼠的实验研究[J].中国实验血液学杂志,2015,23(5):1366-1369.
[16]WengY,ShaoL,OuyangH,etal.AuniqueMUC12VNTRDNAvaccinesuppressestumorgrowthandprolongssurvivalinamurinemultiplemyelomamodel[J].OncologyReports,2012,27(6):1815-1822.
作者简介:朱贝(1989—),女,汉,河南新乡人;单位:新乡医学院,硕士研究生,研究方向:肿瘤免疫治疗的临床和基础研究.
通讯作者:韩双印;单位:河南省人民医院;博士研究生导师,研究方向:肿瘤免疫治疗的临床和基础研究.
