PET/CT显像剂[18F]-AIF-NOTA-NSC-GLU在荷HepG2肝癌模型中的生物学评估
2019-10-12林丽萍唐刚华聂大红苏舒熊鹦刘少玉马慧元龚骏向贤宏
林丽萍 唐刚华 聂大红 苏舒 熊鹦 刘少玉 马慧元龚骏 向贤宏
中山大学附属第一医院1放射介入科,2核医学科,3放射治疗科(广州 510055);4中山大学孙逸仙纪念医院(广州 510080)
我国是肝癌的高发地区,研究表明早期肝癌的5年生存率(40%~70%)比晚期肝癌的5年生存率(<5%)高[1]。目前,肝癌的早期诊断有助于临床医师选择适合的治疗方案[2],但肝癌的早期诊断缺乏理想的影像学手段[3-4]。正电子发射计算机断层显像(PET/CT)是一种无创的影像学手段,已经广泛地应用于肿瘤学的临床研究中。其核心是各种正电子示踪剂包括糖代谢、脂肪酸代谢、氨基酸代谢、胆碱显像剂等。[18F]-氟代脱氧葡萄糖([18F]-FDG)是临床上最常见的糖代谢PET/CT显像剂,已经广泛地应用于多种恶性肿瘤的早期诊断、治疗方案制定以及疗效评价等方面[5],但遗憾的是其对肝癌的诊断是有限的,其敏感性约50%~55%[6-7],而且[18F]-FDG在炎症组织和某些良性组织(如肝硬化结节[8])中摄取较高,容易出现一定假阴性或假阳性结果。恶性肿瘤的生长不仅需要葡萄糖而且摄取和消耗大量的氨基酸[9],因此可以推测肿瘤的恶性程度可能与氨基酸代谢异常有一定的关系,同时,有研究[10]指出谷氨酰胺酵解是恶性肿瘤细胞中除糖代谢途径外的另一条重要的能量代谢途径。谷氨酸酵解途径可能是[18F]-FDG阴性的肿瘤主要能量代谢途径。谷氨酰胺的重要分子探针如[18F]标记的谷氨酸以及谷氨酰胺类似物,可以在一定程度上弥补[18F]-FDG在临床应用中的不足。目前也有多种[18F]标记的谷氨酸类似物显像剂成功合成甚至也有一些已经进入临床研究之中,例如靶向于Xc-系统的[18F]标记谷氨酸类显像剂(4S)-(3-[18F]-氟丙基)-L-谷氨酸(BAY94-9392)可应用于人体肝癌临床显像研究之中,在肝癌显像方面优于[18F]-FDG[11]。在过去的研究中,本课题组也成功合成了靶向XAG-系统的N-(2-[18F]-氟丙酰基)-L-谷氨酸([18F]-FPGLU)[12],但遗憾的是上述氨基酸合成过程复杂,耗时长。因此研究合成方法简单的氨基酸显像剂对肝癌的诊断具有重要的意义。利用[18F]-氟化铝(fluoidealuminum,AIF)连接多肽上的NOTA配体发生络合反应可以简化标记过程。[18F]-AIF络合标记法可以大大缩短显像剂的合成时间,是一种简单、高效的[18F]标记多肽的方法,已经应用在许多显像剂的合成[13-14]。因此,在本研究中,使用[18F]-AIF络合前体1,4,7-三氮杂环烷-1,4,7-三乙酸-S-2(4-异硫基)-L-谷氨酸(NOTA-NSCGLU),从而合成[18F]-AIF-NOTA-NSC-GLU并初步探讨其在肝癌应用中的显像效果。
1 材料与方法
1.1材料
1.1.1细胞HepG2人肝癌细胞购自中国科学院干细胞库。
1.1.2实验动物BALB/C裸鼠(SPF级),4~5周龄,体质量18~22 g,购自北京维通利华实验动物技术有限公司(SCXK(京)2016-0006)
1.1.3试剂与设备[18F]-FDG由中山大学附属第一医院核医学科提供,2%戊巴比妥钠、注射器、酒精由武汉谷歌生物科技有限公司提供;Sep-Paklight QMA柱和Sep-Pakplus C-18柱购自美国Waters公司;谷氨酸前体(NOTA-NSC-GLU)由上海楚肽生物科技有限公司提供。
1.2方法
1.2.1合成[18F]-AIF-NOTA-NSC-GLU使用回旋加速器通过18O(p,n)[18F]核反应获得[18F-]同时使用QMA柱纯化。取50 μg前体用50 μL去离子水溶解于2 mL反应管中,依次加入6 μL,2 mmol/L AlCl3,5 μL冰醋酸以及 325 μL乙腈,混合并移至灭菌瓶中。100℃加热10 min。冷却后加入10 mL灭菌注射用水过C-18柱后,再用1.5 mL无水乙醇淋洗得到初产品(图1)。蒸干乙醇后用生理盐水溶解,0.22 μm滤膜过滤后用于显像实验。目测注射液的颜色和澄清度,用pH试纸测定注射液的pH值。
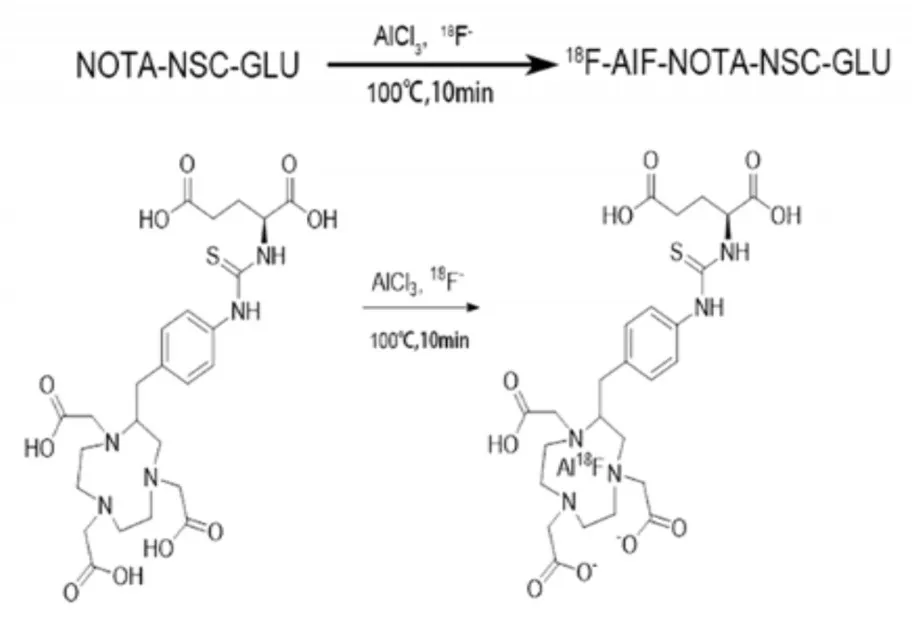
图1 [18F]-AIF-NOTA-NSC-GLU的合成NOTA-NSC-GLU:1,4,7-三氮杂环烷-1,4,7-三乙酸-S-2(4-异硫基)-L-谷氨酸AIF:氟化铝Fig.1 The synthetic scheme of[18F]-AIF-NOTA-NSC-GLU NOTA-NSC-GLU:1,4,7-triazacyclononane-1,4,7-triaceticacid-2-S-(4-Isothiocyanatobenzyl)AIF:aluminum-fluoride
1.2.2细胞培养及荷瘤裸鼠模型的制备选取HepG2人肝癌细胞株,用含有10%胎牛血清及1%双抗(青霉素100 U/mL,硫酸链霉素100 U/mL)的DMEM作为培养基,置于37℃和5%CO2培养箱中培养。收集对数生长期的HepG2细胞,制备单细胞悬液,调整细胞浓度至(1~2)×107/mL后,注入裸鼠左前腋下(0.1~0.2 mL),并在SPF级动物房饲养1~2周,其饲养于25℃室内温度和可自由获得标准饲料和水。动物研究实验方案符合中山大学动物伦理委员会的相关伦理规定并且通过委员会批准(批准编号:20180303)。待肿瘤生长至直径1~2 cm时用于PET/CT显像。
1.2.3HepG2细胞对[18F]-AIF-NOTA-NSC-GLU的摄取实验实验前将处于对数生长期的HepG2细胞接种于24孔板,待细胞生长至每孔的80%~90%开始实验。弃去培养基,用温的PBS漂洗细胞3次,加入[18F]-AIF-NOTA-NSC-GLU(74~111 KBq/孔,约 2 mL)在培养箱里分别孵育 15、30、60、90、120 min,弃去含放射性的液体,用冷PBS漂洗2遍后,加入NaOH溶解细胞,裂解20 min并收集裂解液,测每孔细胞的放射性。取25 μL样品用BCA蛋白测定试剂盒测定细胞蛋白浓度并计算每100 μg蛋白对[18F]-AIF-NOTA-NSC-GLU的摄取。实验计算为100 μg蛋白HepG2细胞对[18F]-AIF-NOTANSC-GLU摄取值,实验结果取均值,在不同日期重复3次。
1.2.4氨基酸转运竞争抑制实验将处于对数生长期的HepG2细胞接种于24孔板,待细胞生长至每孔的80%~90%开始实验。氨基酸转运竞争抑制实验参考文献[12,15]。实验中所用的氨基酸转运系统抑制剂包括:BCH(氨基酸转运L系统抑制剂),MeAIB(氨基酸转运A系统抑制剂),丝氨酸和谷氨酰胺(ASC系统抑制剂),天冬氨酸(XAG-系统抑制剂),谷氨酸(XAG-和XC-系统抑制剂)。根据抑制剂的分子量,称取所需的抑制剂,分别用含有137 mmol/L NaCl及137 mmol/L氯化胆碱的PBS溶解后配成15 mmol/L浓度备用。
[18F]-AIF-NOTA-NSC-GLU氨基酸转运抑制实验分为NaCl组和氯化胆碱组,每组有1个对照组和6个抑制剂组,每小组包含4孔。弃去培养基,分别用温的NaCl或含有氯化胆碱的PBS漂洗细胞3次。再加入200 μL抑制剂,对照组加入200 μL PBS。每孔细胞再加入200 μL用含137 mmol/L NaCl或137 mmol/L氯化胆碱的PBS配制[18F]-AIFNOTA-NSC-GLU溶液。细胞在培养箱中继续培养30 min,弃去放射性溶液。每次用1 mL冰冷的PBS缓冲液漂洗3次,然后用在0.5 mL 1 mol/L的NaOH溶液裂解细胞。测量每孔细胞放射性活度。实验组与对照组的数据进行对比,观察在不同的抑制剂中细胞对[18F]-AIF-NOTA-NSC-GLU的摄取抑制作用。上述实验重复3次后结果取均值。
1.2.5蛋白参与实验将处于对数生长期的HepG2细胞接种于6孔板,待细胞生长至每孔的80%~90%开始实验。弃去培养液,加入放射性显像剂(1.85 MBq/mL)温育30 min后;用0.5 mL 1%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)分离细胞并移入试管中,加入0.5 mL 20%三氯乙酸(Trichloroacetic Acid,TCA),冰浴 5~10 min,6 000 r/min离心4 min,去除上清液,沉淀物用4℃的PBS漂洗3次;最后用γ计数仪测量TCA沉淀物和上清液放射性,上述实验结果取平均值,在不同日期重复3次[16]。
1.2.6小动物PET/CT显像将荷HepG2裸鼠模型禁食4~6 h。将制备好的[18F]-AIF-NOTANSC-GLU注射液配置成适当的浓度,每0.2 mL含有[18F]-AIF-NOTA-NSC-GLU(3.7~7.4 MBq,100~120 μci),通过尾静脉注射至模型体内,显像10 min前经腹腔注射2%戊巴比妥钠(0.225 mL/kg)麻醉裸鼠,放在固定定板上用胶带固定和用加热垫保持体温。行CT扫描,注射30 min后采集PET数据。并于[18F]-AIF-NOTA-NSC-GLU显像完成后放置24 h,再次尾静脉注射[18F]-FDG 3.7~7.4 MBq 60 min后行PET/CT显像,显像结果与[18F]AIFNOTA-NSC-GLU对照。重建图像,由2名核医学科医师勾画出肿瘤、肝、肌肉等组织的感兴趣区域(ROIs),用每克组织百分注射剂量率(%ID/g)来表示,并计算肿瘤/肝脏比值以及肿瘤/肌肉的比值。
1.2.7肿瘤组织H&E染色PET显像后,处死裸鼠并分离肿瘤和正常肝组织,用冷PBS溶液冲洗后再用4%甲醛溶液浸泡,然后经石蜡包埋、切片,脱蜡,水化,苏木精染色5 min后伊红染色2 min,在光学显微镜下观察肿瘤细胞形态,并拍照。
1.3统计学方法实验中所有数据均采用Graph-Pad Prism 6软件进行统计分析,计量资料均采用(s)表示。两个独立样本比较采用Studentt检验。以P<0.05为差异性有统计学意义。
2 结果
2.1[18F]-AIF-NOTA-NSC-GLU的合成[18F]-AIF-NOTA-NSC-GLU合成总时间约20 min,未经时间校正的放射性化学产率(29.3±4.6)%(n=10),比活度(25 ± 5)%GBq/μmol。[18F]-AIF-NOTA-NSCGLU为无色透明液体,pH约为7.0,放射化学纯度>95%。
2.2[18F]-AIF-NOTA-NSC-GLU细胞摄取实验结果[18F]-AIF-NOTA-NSC-GLU细胞摄取实验结果见图2,结果显示人肝癌HepG2对[18F]-AIF-NOTA-NSC-GLU的摄取在短时间内迅速积累(7.2±0.37)%,但随着时间增加缓慢下降。
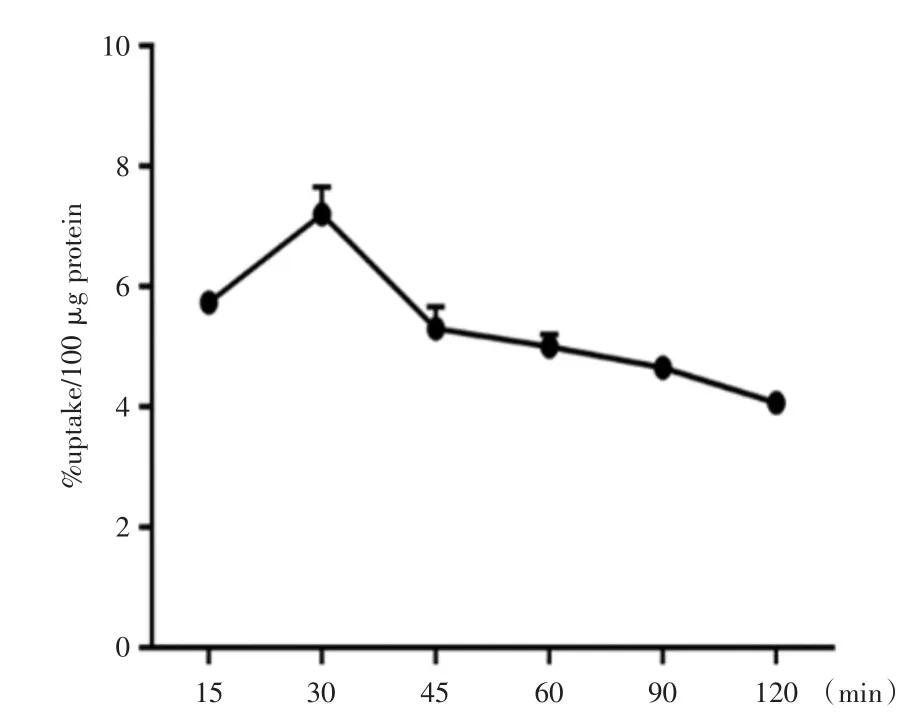
图2 不同时间点HepG2细胞对[18F]-AIF-NOTA-NSC-GLU的摄取Fig.2 The uptake of[18F]-AIF-NOTA-NSC-GLU on HepG2 cells in different time
2.3[18F]-AIF-NOTA-NSC-GLU细胞转运竞争抑制实验结果含Na+或不含Na+的情况下,[18F]-AIF-NOTA-NSC-GLU在HepG2细胞中的竞争抑制实验结果。在Na+存在的条件下,以天冬氨酸和谷氨酸(XAG-系统)为抑制剂,细胞对[18F]-AIF-NOTA-NSC-GLU的摄取分别抑制了33.3%和37.6%(P<0.05),表明[18F]-AIF-NOTA-NSC-GLU转运主要通过Na+依赖的XAG-转运系统。在ASC系统抑制剂丝氨酸和谷氨酰胺存在时,细胞对[18F]-AIF-NOTA-NSC-GLU的摄取分别减少了32.3%和27.3%(P<0.05),说明Na+依赖的ASC部分参与[18F]-AIF-NOTA-NSC-GLU转运。在抑制剂BCH的存在下,[18F]-AIF-NOTA-NSC-GLU 摄取减少 25.6%(P<0.05),表明Na+依赖的B0+系统也部分参了[18F]-AIF-NOTA-NSC-GLU的转运。以MeAIB为抑制剂,细胞对[18F]-AIF-NOTA-NSC-GLU的摄取没有明显减少,说明[18F]-AIF-NOTA-NSC-GLU基本不经过氨基酸A转运系统转运。
用氯化胆碱取代NaCl后,细胞对[18F]-AIFNOTA-NSC-GLU的摄取减少了31.4%(P<0.05),加入天冬氨酸和谷氨酰胺抑制剂,细胞对[18F]-AIF-NOTA-NSC-GLU的摄取分别减少44%和44.9%(P<0.05),而加入(BCH、MeAIB、丝氨酸、谷氨酸细胞抑制剂,细胞对[18F]-AIF-NOTA-NSC-GLU的摄取没有进一步显著减少(图3)。
2.4蛋白参与实验结果在HepG2细胞中加入显像剂,继续培养30 min后,放射性主要集中上清液中(98.25%),沉淀物中的放射性极少(1.75%)。说明[18F]-AIF-NOTA-NSC-GLU几乎没有参与细胞蛋白质的合成。
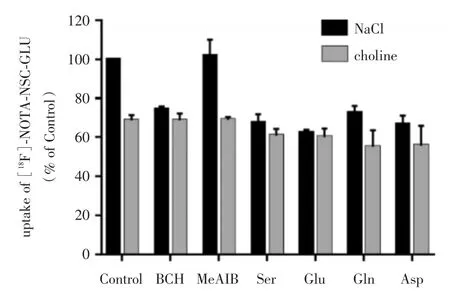
图3 [18F]-AIF-NOTA-NSC-GLU在HepG2细胞中竞争抑制实验结果Fig.3 The result of competitive inhibition studies of[18F]-AIF-NOTA-NSC-GLU on HepG2 cells
2.5[18F]-AIF-NOTA-NSC-GLU荷肝细胞癌裸鼠模型的PET/CT显像荷肝细胞癌裸鼠模型结果见图4,图中红色箭头指示肿瘤。注射[18F]-AIFNOTA-NSC-GLU 30 min后,肿瘤清晰可见,肿瘤组织对[18F]-AIF-NOTA-NSC-GLU的摄取高于周围正常组织(图4A),肿瘤/肝脏(T/L)以及肿瘤/肌肉(T/M)摄取比值分别为(1.50±0.10)和(3.75±0.25)(n=10)。同一组裸鼠注射[18F]-FDG 60 min后肿瘤显影清晰,其肿瘤/肝脏(T/L)以及肿瘤/肌肉(T/M)摄取比值分别(1.12±0.15)和(3.32±0.61)。[18F]-AIF-NOTA-NSC-GLU肿瘤/肝脏以及肿瘤/肌肉(T/M)摄取比值稍高于[18F]-FDG,差异具有统计学意义(n=10,P<0.05,图4B)。
2.6病理结果肿瘤模型显像后解剖肿瘤组织以及正常的肝脏组织进行切片检查(图5),经H&E染色后镜下观察,肿瘤组织出可见大量异型细胞,证实肿瘤模型制作成功。
3 讨论
肝癌病死率在所有恶性肿瘤中位居世界第3位,但往往发现时已经是中晚期[17]。[18F]-FDG在肝癌的鉴别、手术和姑息治疗中可提供有效的预后信息,但在诊断方面仍不足[7],恶性肿瘤的代谢除了已知的糖酵解途径之外,还存在氨基酸代谢紊乱的情况。氨基酸PET/CT显像剂可应用于脑胶质瘤、神经内分泌肿瘤以及其他疾病PET显像[18-20],且与[18F]-FDG相比具有一定的优势。在本研究中,本实验成功合成了简单的氨基酸显像剂[18F]-AIF-NOTA-NSC-GLU,产物放化纯度高,产率稳定,经估算比活度(25±5)%GBq/μmol。相对于其他[18F]标记谷氨酸类显像剂(如BAY94-9392、[18F]-FPGLU)来说[11,21],本研究中的显像剂具有合成简单,时间短,良好的体外稳定性等优点,为后续实验和临床应用打下基础。
恶性肿瘤对氨基酸的需求增加,主要是通过上调氨基酸转运体的表达,增加氨基酸转运体的活性从而满足恶性肿瘤的生长的需求,而在正常的组织或者炎症的组织中氨基酸转运体一般是低表达或者不表达[9]。恶性肿瘤组织中存在LAT1、ASCT2、ASC、XAG-、B0+以及XC-等转运体的高表达,因此可通过靶向各种各样氨基酸转运体表达实现肿瘤氨基酸代谢显像。例如:BAY94-9392是一种靶向于XAG-系统的显像剂,在肝细胞癌以及非小细胞癌的显像方面优于[18F]-FDG[11];[18F]-FAMT是一种靶向于L系统的显像剂,可应用于非小细胞肺癌以及脑肿瘤。蛋白参与结果表明人肝癌HepG2细胞对[18F]-AIF-NOTA-NSC-GLU摄取几乎不参与蛋白合成。本研究中,添加各种氨基酸抑制剂能不同程度的抑制[18F]-AIF-NOTA-NSC-GLU在人肝癌HepG2细胞中的摄取,表明[18F]-AIFNOTA-NSC-GLU的摄取是通过氨基酸转运系统转运,主要是Na+依赖的XAG-转运系统和Na+依赖的ASC系统,同时B0+系统也部分参与[18F]-AIFNOTA-NSC-GLU的转运。这种转运机制与许多氨基酸显像剂(如[18F]-FPGLU)相似[21]。EAAC1是XAG-系统中最重要的谷氨酸转运体,在PC-3前列腺癌细胞以及胶质瘤中均稳定表达[12]。因此,可以推测[18F]-AIF-NOTA-NSC-GLU在HepG2中的摄取可能和某些EAAC1转运体表达上调有关,但还需要进一步实验来验证。
在[18F]-AIF-NOTA-NSC-GLU体外细胞摄取研究中,在30 min迅速积累,随着时间的增加,摄取率逐渐下降,可能是30 min左右[18F]-AIF-NOTANSC-GLU人肝癌HepG2细胞进出速率更高。注射[18F]-AIF-NOTA-NSC-GLU 30 min后PET/CT肿瘤显像效果较好,形态清晰。同时大量放射性聚集于膀胱,因此可以推断该显像剂主要是经过泌尿系统排泄。定量结果显示荷HepG2肝细胞癌裸鼠肿瘤模型注射[18F]-NOTA-NSC-GLU30 min后的肿瘤/肝脏(T/L)摄取比值稍高于注射[18F]-FDG 60 min肿瘤/肝脏(T/L)摄取比值,这表明[18F]-AIF-NOTA-NSC-GLU在肝细胞癌显像中可能有潜在的应用价值。但本实验只是初步的探讨,在未来的研究中应该选用更多的肝癌细胞株进行验证,同时也可应用于更多的恶性肿瘤模型(如肺癌、脑肿瘤以及前列腺癌等)。
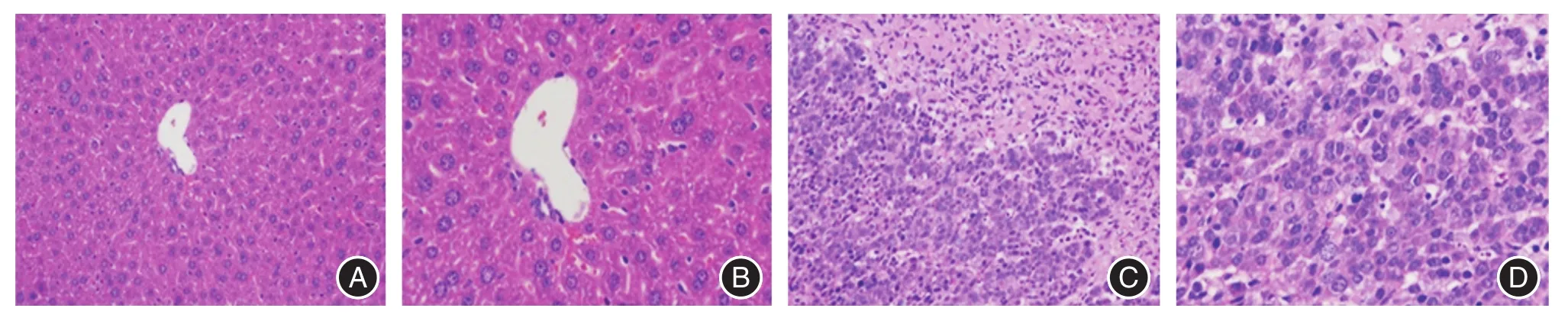
图5 HepG2肿瘤模型正常肝组织(A 200×,B 400×)以及肿瘤组织(C 200×,D 400×)H&E染色Fig.5 HE staining of healthy liver(A 200 ×,B 400 ×)or tumor(C 200 ×,D 400 ×)in tumor-bearing(HCC HepG2 cell lines)nude mice
综上所述,初步结果显示与其他传统的显像剂相比,利用氟化铝络合标记合成[18F]-AIF-NOTA-NSC-GLU,方法简单,时间短而且产率较高,能较好地显示肝癌,是一种具有潜力的肝癌显像剂。
