鱼源荧光假单胞菌生物被膜形成和致腐表型的研究
2019-10-12严羽萍朱军莉陆海霞励建荣
严羽萍 刘 丽 朱军莉* 陆海霞 励建荣
(1浙江工商大学食品与生物工程学院 浙江省食品安全重点实验室 杭州 310018
2渤海大学辽宁省食品安全重点实验室 辽宁锦州121013)
养殖鱼类低温贮藏品质下降的主要原因是嗜冷腐败微生物的生长繁殖。在有氧冷藏条件下,假单胞菌多为淡水鱼的特定腐败菌。胥亚夫等[1]发现水产品中主要腐败菌为假单胞菌属细菌,包括荧光假单胞菌、腐臭假单胞菌和边缘假单胞菌。Parlapani等[2]报道海鲷中的腐败微生物为假单胞菌属,特别是荧光假单胞菌。杨宪时等[3]研究罗非鱼冷藏过程菌相的变化,发现在0~10℃冷藏过程中假单胞菌为优势腐败菌,荧光假单胞菌为最优势种群。郭全友等[4]对养殖大黄鱼的菌相研究中,鉴定出腐败希瓦氏菌和假单胞菌是低温贮藏大黄鱼的优势腐败菌。
荧光假单胞菌是革兰氏阴性、有鞭毛,产生物被膜,是广泛存在于土壤和水生环境中的微生物,也是食品微生物腐败的重要嗜冷腐败菌[5]。研究表明,荧光假单胞菌分泌的蛋白酶和酯酶等代谢产物难以用瞬时高温灭活,导致冷藏食品的风味等物化性质变化。假单胞菌属还常在生产设备表面形成生物膜,对食品生产可能带来持续污染。在食品环境中,生物被膜成为假单胞菌的寄所,可以提高其对在食品加工过程中遇到的各种环境压力(低温、酸、盐、消毒剂)的抵抗力[6-7]。Anna Koza等[8]研究表明,假单胞菌属可以形成多种生物被膜,能在静止液体的气-液界面上定殖并成膜。
目前荧光假单胞菌的致腐能力主要集中在牛奶分离株,而水产品来源的荧光假单胞菌仅报道其分离与鉴定,对腐败表型和生物被膜形成的报道较少。鉴于此,本研究分析5株荧光假单胞菌的生物被膜形成及致腐能力,为探究鱼源荧光假单胞菌致腐机理及生物被膜的控制提供理论基础,为水产品保鲜提供借鉴。
1 材料与方法
1.1 材料与试剂
PF01、PF06和PF07为冷藏大黄鱼中的优势腐败菌,PF10为大菱鲆的特定腐败菌,NCBI登录号分别为 KU173826、KU173831、KU173832、KR706375,PFuk4为标准菌株,购买于微生物菌种保藏中心。LB肉汤、胰酶大豆肉汤(TSB)、营养琼脂(NA),泳动性培养基(胰蛋白胨1%,NaCl 0.5%,琼脂0.3%),均购买于青岛海博生物有限公司;SYTO9,Thermofisher,Waltham,MA,USA;96 孔 细胞培养板,无锡 NEST生物技术有限公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台,苏净集团苏州安泰空气技术有限公司;立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;酶标仪VICTOR X,美国Perkin Elmer公司;移液器,德国Eppendorf公司;荧光显微镜LEICA DM4000,德国莱卡公司。
1.3 方法
1.3.1 活化培养 将-80℃贮藏的5株荧光假单胞菌甘油菌接种于LB培养基中28℃,200 r/min过夜活化后,于LB培养基中二次活化。离心收集菌体,用无菌生理盐水将菌浓度调整到108CFU/mL待用。
1.3.2 生长曲线测定 将5株荧光假单胞菌分离株过夜活化菌液稀释10倍后按1%接种于含有200 μL TSB培养基的96孔板中,置于28℃下培养,每隔3 h用酶标仪测定600 nm处吸光度。
1.3.3 结晶紫法定量检测生物被膜 将过夜活化的细菌菌液稀释 10倍后按1%接种量接种于TSB培养基,并以200 μL分装到96孔板中,28℃静置培养 3,6,9,12,18,24 h 后,采用结晶紫法测定生物被膜形成量。根据 Djordjevic[9]方法略做修改,去除孔板中菌液,每孔用250 μL PBS缓冲液轻轻漂洗3次,干燥后,加入200 μL 0.2%的结晶紫溶液,染色15 min后清洗,干燥,最后加入200 μL 33%冰乙酸,用酶标仪测量其590 nm处吸光值。
1.3.4 胞外多糖(EPS)含量测定 参考Harimawan等[10]的方法略作修改提取胞外多糖。具体为培养 12,18,24 h后的 10 mL 菌液,4℃离心(5 000×G,20 min),去上清,然后用磷酸缓冲液(Phosphate Buffered Saline,PBS)重悬菌体,在80℃水浴 30 min,4 ℃离心(15 000×G,30 min),用0.22 μm滤膜过滤,得到上清液用苯酚硫酸法测定胞外多糖含量。
1.3.5 珠涡流法在1.3.1节所述的细菌菌悬液中加入不锈钢片(10 mm ×10 mm)和盖玻片(22 mm×22 mm)。在28℃静置培养1 h。参考Nguyen等[11]珠涡流法对粘附在不锈钢片表面的细菌进行计数。具体方法如下,用PBS缓冲液轻轻洗去不锈钢片表面的浮游菌,然后放于装有10 mL无菌生理盐水的离心管中,加入适量玻璃珠,剧烈涡旋3 min后,梯度稀释计数。
1.3.6 荧光显微镜观察 荧光显微镜观察参照Bagge等[12]的方法。具体如下:用灭菌PBS洗去盖玻片上浮游菌,放入2.5%的戊二醛中固定1.5 h,用PBS洗去戊二醛,烘箱干燥后,滴加70 μL 0.1 μL/mL SYTO9于盖玻片上,均匀覆盖于表面,避光孵育20 min,吸去多余的染料后,放置荧光显微镜下(40×)观察。
1.3.7 泳动性测定 参考 Sperandio等[13]的方法,泳动琼脂培养基凝固后,将5 μL过夜培养的菌液滴在平板中心,吸干后,移至28℃培养箱中静置培养24 h。
1.3.8 蛋白酶活性测定 参照SB/T 10317-1999标准[14]中福林酚法测定蛋白酶活力方法,在40℃下每分钟水解酪蛋白产生1 μg定义为1个蛋白酶活力单位。
1.3.9 嗜铁素检测 参考文献[15],制作CASAD嗜铁素检测平板,利用CASAD嗜铁素平板法可检测总的嗜铁素,将过夜培养的菌液离心取上清5 μL加入平板中,置于28℃培养24 h后观察。
1.3.10 生物报告菌检测信号分子 参考Ravn等[16]方法并略作修改。报告菌紫杆菌CV026活化后,取5 mL加入到50 mL LB琼脂中,混合均匀后倒平板,待冷却后,平板中心打孔,加入菌液,28℃培养,观察颜色变化。
1.3.11 统计学处理 每组样品设3个重复,结果取其平均值。采用Microsoft Excel和Origin 8.5进行 数 据 处 理和作图,并利用SPSS21.0的ANOVA进行方差分析P<0.05表示有统计学意义。
2 结果与分析
2.1 荧光假单胞菌分离株的生长曲线
研究测定了5株荧光假单胞菌分离株在28℃下静置培养的生长曲线。如图1所示,荧光假单胞菌在3 h到12 h期间生长迅速,尤其是PF07在对数生长期生长最快,PF01、PF06和PF10次之,且这3株菌的生长基本保持一致,PFuk4生长最慢。在18 h后PF07和PFuk4生长缓慢,在培养24 h进入稳定期,而其余3株菌依然在逐渐增长,在27 h 进入稳定期。PF01、PF06、PF07、PF10和PFuk45株菌在稳定期的细菌量分别达到1.7,1.7,1.5,1.7和1.4(OD600),其中 PF01、PF06和PF10 的细菌量最高,PFuk4的菌量最少。
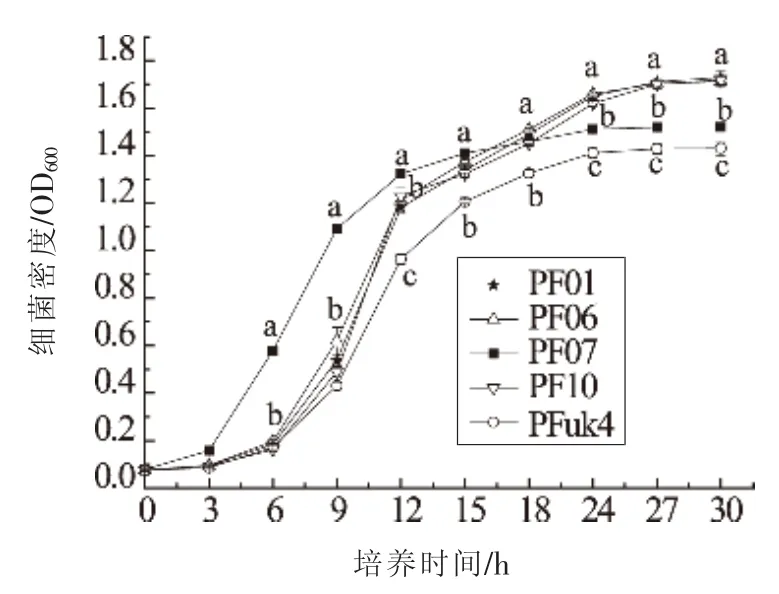
图1 5种荧光假单胞菌分离株在28℃下的生长曲线Fig.1 Growth curves of five isolates of P.fluorescens at 28℃
2.2 荧光假单胞菌分离株的生物被膜形成
2.2.1 结晶紫法测定生物被膜含量 生物被膜通常被定义为微生物群体粘附于表面或界面产生一种可供微生物定殖的由多糖、蛋白质、核酸和脂肪所组成的胞外基质[17]。比较5株荧光假单胞菌被膜形成能力,如图2所示。结果发现,5株菌都能在试管壁的气-液界面较快的形成菌膜,随着培养时间延长膜量逐渐增多,24 h出现明显的膜,48 h逐步增厚,72 h后膜开始破裂。Liang等[18]也发现奥奈达希瓦氏菌在气-液交界处形成菌膜。
荧光假单胞菌在96孔塑料孔板上也能形成被膜,其中培养3 h时5株菌的生物被膜量基本保持一致(P>0.05)。随着细菌生长,荧光假单胞菌的生物被膜量也开始显著增加,培养至12 h,PF01、PF06、PF07和PF10的生物被膜量达到最高,分别为 1.71,1.72,2.24和1.61(OD600),而 PFuk4在18 h达到最高,为2.50,随即又开始下降。在荧光假单胞菌分离株中PF07和PFuk4的生物被膜形成能力较强,且PF07被膜形成周期较短。研究表明,荧光假单胞菌具有较强的生物被膜能力,而且不同来源的荧光假单胞菌生物被膜形成能力差别较大。Simões等[19]报道荧光假单胞菌模式菌株形成生物被膜的能力高于从乳制品加工环境中分离得到的分离株。课题组[20]也发现不同来源的铜绿假单胞菌形成生物被膜的能力也有所不同。在食品接触表面的腐败致病菌的粘附及生物被膜形成,增加产品加工过程的交叉污染,缩短货架期,给食品产业带来严峻挑战[7]。

图2 5种荧光假单胞菌分离株在28℃下的生物被膜形成Fig.2 Biofilm formation of five isolates of P.fluorescens at 28℃
2.2.2 EPS含量 胞外多聚物(EPS)由胞外多糖、蛋白质和胞外DNA等多种成分组成,是形成生物被膜的重要基质。研究测定5株菌在28℃下培养不同时间的EPS含量,如图3所示。结果显示,5株荧光假单胞菌随着培养时间延长,EPS含量逐步增加,其中PF07形成EPS较快,在18 h达到最高,为 0.61(OD490),而 PF01、PF06、PF10和PFuk44株在24 h达到最高,分别为0.46,0.56,0.52和0.48(OD490)。铜绿假单胞菌EPS分泌使细菌间彼此粘结,并促进菌体粘附于物体表面[21]。Taguett[22]曾报道分析荧光假单胞菌TF7的多糖组成为果糖、葡萄糖和甘露糖,比例为4∶1∶0.6。结合结晶紫染色和EPS含量分析发现,分离株PF07生物被膜形成能力很强,形成周期较短,胞外多糖含量较高。
2.3 荧光假单胞菌分离株的粘附能力
生物被膜的形成主要分为初期粘附、不可逆粘附、微菌落形成、成熟和播撒5个阶段[23]。研究假单胞菌在不锈钢片上的初期粘附能力,如图4所示。结果显示假单胞菌能粘附于不锈钢片上,且PF07的初期粘附能力最强,粘附量可达到6.87 lg CFU/cm2;PF01、PF06和PF10 的粘附量无显著差异,分别为 6.46,6.42和6.53 lg CFU/cm2;PFuk4的粘附量最低,为 6.08 lg CFU/cm2。细菌在表面的初期粘附是一个复杂的过程,受各种物理化学特性的影响,包括细胞和介质表面。细胞表面疏水性被认为是最重要的物理化学参数,控制着细菌在表面的粘附和分离[24]。荧光假单胞菌PF07高粘附性与其较强的被膜形成和EPS分泌能力一致。
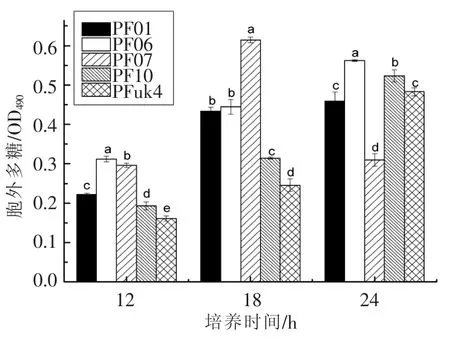
图3 5种荧光假单胞菌分离株在28℃下的EPS含量变化Fig.3 The EPS production of five isolates of P.fluorescens at 28℃

图4在28℃下5种荧光假单胞菌分离株的粘附能力Fig.4 The adherence ability of five isolates of P.fluorescens at 28℃
由于荧光染料SYT09可与细菌的DNA特异结合并发出绿色荧光,进一步通过荧光显微镜观察荧光假单胞菌在玻璃片上的粘附能力,如图5所示。结果观察,假单胞菌都能较快地粘附到玻璃片表面,较分散地分布于表面,其中PF07细菌聚集形成团块,且粘附菌量较多。显微镜观察与细菌计数结果较一致,表明荧光假单胞菌PF07在不锈钢片和玻璃片表面具有较强的粘附能力。Midelet等[25]也曾发现荧光假单胞菌具有很强的粘附能力,能快速粘附到接触面上。Liu等[26]曾报道隆德假单胞菌在培养4~6 h后开始粘附于接触表面并形成生物被膜。
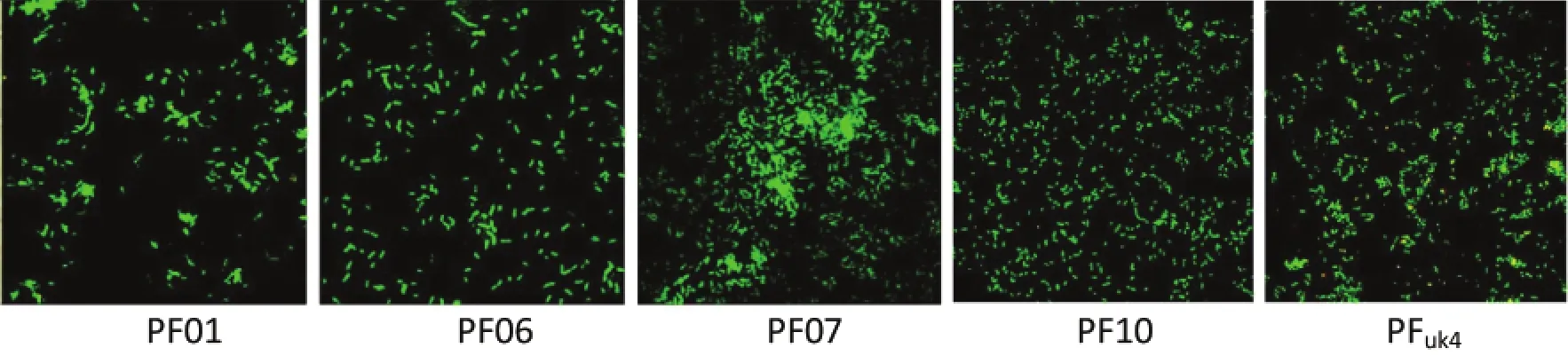
图5在28℃下5种荧光假单胞菌分离株在玻璃片上粘附的荧光显微镜图Fig.5 Fluorescence microscope images of five isolates of P.fluorescens at 28℃
2.4 荧光假单胞菌分离株的泳动性
细菌的泳动性与生物被膜形成能力密切相关,其有助于细菌在介质表面的运动。如图6所示,荧光假单胞菌均具有一定的泳动能力,PF07的泳动能力最强,其扩散直径可以达到39.5 mm,而其它4株菌的泳动扩散直径分别为25.3,28.5,32.2和29.5 mm。Liu等[26]也发现隆德假单胞菌在半固体培养基平板上有很强的泳动性和群集性。Ping等[27]曾报道荧光假单胞菌SBW25拥有右旋鞭毛,比靠左旋鞭毛驱动的大肠杆菌有更强的泳动性。
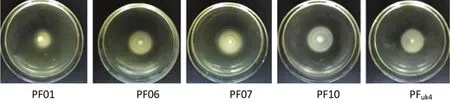
图6在28℃下5种荧光假单胞菌分离株的泳动性Fig.6 Swimming motility of five isolates of P.fluorescens at 28℃
2.5 荧光假单胞菌分离株的蛋白酶和嗜铁素活性
假单胞菌属的某些成员是富含蛋白类生鲜食品,特别是冷藏牛肉[28]和海鲜[29]的主要腐败菌,与其高蛋白酶活性有关[30]。如图7a所示,5株荧光假单胞菌在28℃下具有较高的蛋白酶活性,其中PF01、PF06和PF07在12 h活性达到最大,分别为24.0,24.2和24.5酶活力单位,随后开始下降。PF10在24 h达到最大为 24.5酶活力单位,而PFuk4仍在持续增长,在36 h达到25.9酶活力单位。结果表明,大黄鱼源的3株假单胞菌产生蛋白酶的速率较快,而标准菌株由于生长较慢,蛋白酶生成较慢,然而其活性也较高。
CASAD嗜铁素平板法检测荧光假单胞菌嗜铁素,嗜铁素会夺取青色平板中的铁离子,形成黄色晕圈,检测结果直观。如图7b所示,5株假单胞菌都能形成黄色晕圈,表明假单胞菌分离株都含有嗜铁素。
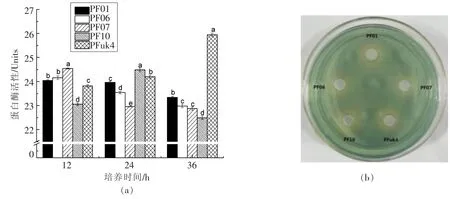
图7在28℃下5种荧光假单胞菌分离株的蛋白酶(a)和嗜铁素(b)活性Fig.7 Protease activity and siderophore of five isolates of P.fluorescens at 28℃
2.6 生物报告菌法检测AHLs信号分子
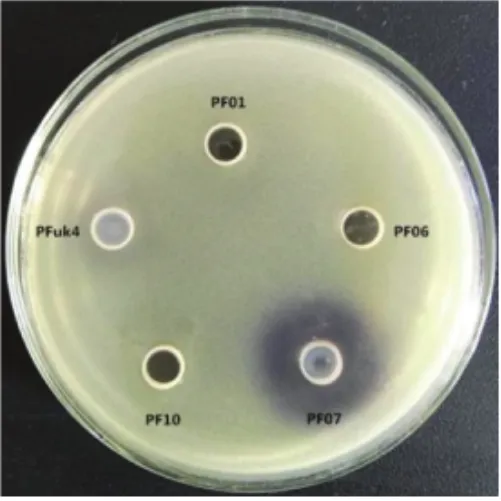
图8 紫色杆菌CV026报告菌法检测5种荧光假单胞菌中AHLsFig.8 The ability of producing AHLs of five isolates of P.fluorescens at 28℃
生物报告菌法是一种经典的检测 AHLs信号分子的方法,具有简单、方便、灵敏度好等优点。生物报告菌紫色杆菌CV026检测荧光假单胞菌AHLs活性,如图8所示。结果发现PF07能引起报告菌产生紫色色素,且PFuk4周围的紫色极浅,而PF01、PF06和PF10周围不变色,表明PF07产生含量较高或活性较强的短链AHLs,而PFuk4也具有较弱的AHLs活性,而其余3株菌不产生短链AHLs。Kjelleberg等[31]发现AHLs可以调控铜绿假单胞菌的粘附、游动和细菌生物被膜的形成。
3 结论
研究表明,5株荧光假单胞菌都能在试管和塑料孔板中形成大量生物被膜,且能较快地粘附于不锈钢片与玻璃片表面。荧光假单胞菌具有较强的泳动性、蛋白酶活性及产嗜铁素,其中PF07较强的生物被膜形成能力和致腐表型,可能与高活性的AHLs存在内在关联。
