熬胶工艺对鲟鱼鱼皮胶冻品质的影响
2019-10-12王雅菲祁立波王可心夏永涛董秀萍
王雅菲 祁立波 白 帆 王可心 李 晗 徐 璐 夏永涛 董秀萍 *
(1大连工业大学食品学院 辽宁大连 116034
2国家海洋食品工程技术研究中心 辽宁大连 116034
3大连工业大学食品工程技术转移中心有限公司 辽宁大连 116034
4衢州鲟龙水产食品科技开发有限公司 浙江衢州 324000)
明胶是胶原部分变性的产物,在食品行业应用广泛。当加热温度高于胶原的变性温度时,胶原转化变为一种混合物——明胶[1]。传统胶原主要来源于猪、牛等陆地哺乳动物。近年来,口蹄疫、疯牛病等传染病的大规模爆发,消费者对传统胶原来源信任度下降,加之宗教信仰的约束,以猪、牛等为原料的胶原产品受到制约[2]。人们开始将目光转向鱼类胶原,与陆地哺乳动物的来源相比,由鱼类胶原得到的明胶产品不仅安全可靠,而且具有易溶解、低致敏性的优点,其中以鱼皮明胶较为常见。
一般而言,鱼皮明胶的胶凝及熔化温度普遍低于陆地哺乳动物,且一般情况下接近人体体温,鱼皮明胶聚合成的胶冻具有入口即化的特性,其熔化时又具有高聚物的特殊口感,和传统畜禽来源明胶相比具有更好的制作胶冻类食品的优势[3]。以不同种类鱼皮为原料开发鱼冻类食品已引起相关学者的关注。贾冬英等[4]以淡水鱼加工副产物为原料,提取后与魔芋精粉、卡拉胶复配,调味后制得鱼冻;高瑗等[5]以罗非鱼鱼皮为原料,经酸、碱浸泡后得到羟脯氨酸含量较高的鱼冻;安然[6]以鲶鱼鱼皮为原料,经脱脂、酶解、调味等工序制得营养与美味兼得的鱼冻食品。
近年来,我国鲟鱼养殖量逐渐增加,2018年达96 914 t,较2017年增长116.68%[7]。鲟鱼属软骨硬鳞鱼[8],其鱼皮约占鲜鱼体质量的5%~7%[9],韧性和耐磨性较强,传统用途主要为制革。鲟鱼皮中含有丰富的矿物质和胶原蛋白,鉴于其丰富的营养,有学者将鲟鱼皮用于食品领域的研究。吴小干等[10]通过脱腥、调味、灭菌工艺得出生产鲟鱼皮软包装冷冻调理食品的配方及条件;杨玲等[11]从鲟鱼皮中分别提纯酸溶性胶原蛋白和酶溶性胶原蛋白;Nikoo等[12]用酸提取法提取施氏鲟鱼皮中的明胶,提取率在9.42%~12.4%(湿基)之间。鲟鱼皮中胶原蛋白约占总蛋白的70%[13],可作为开发鱼皮胶冻食品的良好原料,目前未见研究报道。开发鱼冻食品,除找到最佳加工工艺外,研究不同的加工条件对胶冻品质及微观结构的影响可更好地了解胶冻形成过程并指导加工。本文从实际生产出发,通过考察不同理化指标,结合微观结构观察和感官评定,确定鲟鱼鱼皮胶冻加工的最佳工艺,建立表象差异与内部变化之间的联系,拓宽鲟鱼皮加工思路,并为指导生产提供试验参考。
1 材料与方法
1.1 材料与试剂
冷冻雄性俄罗斯鲟鱼(Acipenser gueldenstaedti Brandt)鱼皮,由衢州鲟龙水产食品科技开发有限公司提供。
氢氧化钠(AR),天津市科密欧化学试剂有限公司;硫酸钾(AR),天津市光复科技发展有限公司;无水乙醚(AR),天津市科密欧化学试剂有限公司;对二甲胺基苯甲醛(AR),天津傲然精细化工研究所;柠檬酸(AR),天津市科密欧化学试剂有限公司;氯胺T(AR),天津市大茂化学试剂厂。
1.2 主要仪器与设备
电热鼓风干燥箱,上海一恒科技有限公司;HH-1数显恒温水浴锅,常州智博瑞仪器制造有限公司;HYP-1020消化炉,上海纤检仪器有限公司;UDK 129全自动凯式定氮仪,意大利VELP公司;SX2-4-10马弗炉,龙口市先科仪器有限公司;SZF-06A粗脂肪测定仪,上海新嘉电子有限公司;TA.X T.plus质地分析仪,英国SMS公司;Ultra Scan PRO 测色仪,Hunter Lab;CM1950冷冻切片机,德国Leica公司;BX51型倒置显微镜,日本Olympus公司。
1.3 方法
1.3.1 样品预处理 冷冻鲟鱼鱼皮,保存于-20℃。使用前流水解冻30 min,去除附着在表面的脂肪,将鱼皮冲洗沥干,剪成大小约为5 mm×5 mm小块,备用。
1.3.2 工艺流程 将原料鲟鱼皮进行预处理后,通过控制温度、料液比和时间在密闭条件下进行熬胶;获得的胶液过60目筛,然后置于4℃环境下冷却凝冻。
1.3.3 基本成分测定 参照GB 5009.3-2016《食品安全国家标准 食品中水分的测定》中直接干燥法测定样品水分;参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中凯式定氮法(换算系数6.25)测定粗蛋白的含量;参照GB/T 5009.6-2016《食品安全国家标准 食品中脂肪的测定》中索式抽提法测定干基中脂肪的含量;参照GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》测定干基中灰分的含量;参考GB/T 9695.23-2008《肉与肉制品 羟脯氨酸含量测定》中的方法,将原料鱼皮干样用氯胺T比色法测定羟脯氨酸的含量,按公式(1)计算羟脯氨酸含量,再换算为胶原蛋白含量,换算系数11.1[14]。

式中,X——样品中羟脯氨酸含量(g/100 g);C——由标准曲线得到的样品中羟脯氨酸含量(μg/mL);F——稀释倍数;m——样品质量(g)。
1.3.4 工艺条件筛选在熬胶时间为2 h,料液比为1∶3的条件下,设定6个不同的温度条件,分别为 50,60,70,80,90,100 ℃,测定鱼皮胶冻凝胶强度、色泽并结合感官评价筛选出最佳熬胶温度。
在熬胶温度为80℃,熬胶时间为2 h的条件下,设定8个不同的料液比条件,分别为1∶1,1∶2,1∶3,1∶4,1∶5,1∶6,1∶7,1∶8,测定鱼皮胶冻凝胶强度、胶液中胶原蛋白回收率并结合感官评价,筛选出最佳熬胶料液比。
在熬胶温度为80℃,料液比为1∶3的条件下,设定 5 个不同的时间条件,分别为 1,2,3,4,5 h,测定胶液中胶原蛋白回收率、固形物含量以及鱼皮胶冻凝胶强度、色泽、观察微观结构并结合感官评价,筛选出最佳熬胶时间。
1.3.5 凝胶强度的测定 取25 mL胶液放置于25 mL小烧杯中,凝冻后用质地分析仪进行测定。测试探头P/0.5,力量感元5 kg,测试高度15 mm,测试速度与测后速度均1 mm/s。单位g。每个条件设定4个平行样品。
1.3.6 色泽的测定 将测完凝胶强度胶冻的破损部分切除后,于同一完整位置取1 cm厚度,使用测色仪,反射模式,中号孔径,测得L*,a*和b*值,然后按公式(2)计算白度值W。其中,L*为明度(黑暗色(0)到明亮色(100)),即越接近 100 就越接近白色;a*为红色(60)到绿色(-60),正值即为多红而少绿,负值即为多绿而少红;b*为黄色(60)到蓝色(-60),正值即为多黄而少蓝,负值即为多蓝而少黄。每个条件设定4个平行样品。
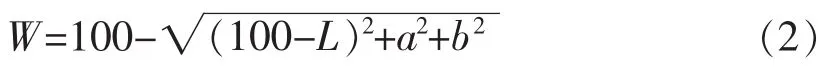
1.3.7 胶原蛋白回收率和残存率 按1.3.3节中的方法测定熬后鱼皮胶液中的羟脯氨酸含量,按公式(3)计算后代入公式(4)得出胶原蛋白回收率。每个条件设定4个平行样品。

式中,ω1——胶液羟脯氨酸含量(μg/mL);c——试样中羟脯氨酸质量浓度(μg/mL);A——稀释倍数;V1——熬胶所得胶液体积(mL);V2——水解样品体积(mL)。

式中,V——所出胶液体积(mL);F——换算系数(本试验用11.1);ω2——鱼皮中羟脯氨酸含量(g/100 g);m——熬胶所用鱼皮质量(g)。
按1.3.3节中的方法测定熬后鱼皮干样中羟脯氨酸含量,按公式(5)计算鱼皮胶原蛋白残存率。每个条件设定4个平行样品。
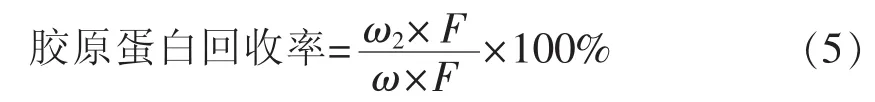
式中,ω2——熬后鱼皮干样中羟脯氨酸含量(μg/mL);ω——原料鱼皮干样中羟脯氨酸含量(μg/mL);F——换算系数(本试验用11.1)。
1.3.8 固形物含量 使用手持折光仪,待胶液冷却至室温后测定可溶性固形物含量,每个条件设定4个平行样品。
1.3.9 微观结构观察 将胶冻切成约为3 mm×3 mm×7 mm的长方体贴于冷台,速冻60 min后连续切片。修片厚度为8 μm,切片厚度为5 μm,冷台和冷刀温度均为-30℃。将切下的薄片迅速贴于载玻片上,200倍(20×)光学显微镜下观察切片结构并拍照。
1.3.10 感官评定 选取10名具有丰富感官评定经验的研究人员。在独立无其它影响因素的环境中对不同条件下鱼皮胶冻进行评分。评定员按表1进行打分。将单项分数和总分计算平均分。作为感官评定结果进行讨论。
1.3.11 数据处理 使用Microsoft Excel 2007软件进行数据处理后,用Origin8.5作图,用IBM SPSS Statistics 20软件对试验数据进行分析,比较和验证样品间是否具有显著差异。

表1 感官评定评分标准Table 1 The standard of sensory evaluation
2 结果与分析
2.1 鲟鱼鱼皮基本成分测定
由表2可知,鲟鱼皮中最主要成分为蛋白质,其中胶原蛋白占到了粗蛋白的83.15%,高于斑点叉尾鮰(73.92%)[15]、军草鱼(70.42%)、金枪鱼(69.33%)、罗非鱼(62.30%)[16],是提取胶原非常好的原料,可用来开发胶原蛋白类食品,是良好的新型胶原蛋白替代源。除丰富的蛋白质外,鲟鱼皮中还含有矿物质,户业丽等[17]曾报道施氏鲟鱼皮中常量、微量元素都很丰富。

表2 鲟鱼鱼皮基本成分Table 2 The basic composition of sturgeon’s skin table
2.2 鲟鱼鱼皮胶冻加工工艺条件
在鱼皮胶冻加工过程中,熬胶的温度、料液比、时间都会影响胶冻的最终品质。在诸多指标中,凝胶强度是鱼皮胶冻食品的特征性指标,但与明胶的凝胶强度要求有所不同,胶冻既要有一定的弹性,又要有一定的适口性[18]。此外,原料中的色素等物质会影响胶冻的色泽[19],色泽能够直观反映产品的颜色与透明度,影响消费者的食欲,进而影响对风味的感觉。从成分上来讲,胶原蛋白是熬胶过程中的主要变化物质,也能最大限度地反映出产品的营养价值。内部微观结构的变化能解释上述表征特性变化的原因。而作为食品,消费者对产品的喜好程度和可接受程度与表征联系密切。综上,需要综合考虑指标,筛选出最佳加工工艺条件。
2.2.1 熬胶温度对鱼皮胶冻的影响
2.2.1.1 熬胶温度对胶冻凝胶强度的影响 由图1可知,随着温度的升高,鱼皮胶冻的凝胶强度呈先上升后下降,在80℃时,鱼皮胶冻的破裂凝胶强度达到最大值。50℃和100℃的凝胶强度数值均低于100 g,不适用于食品的生产。
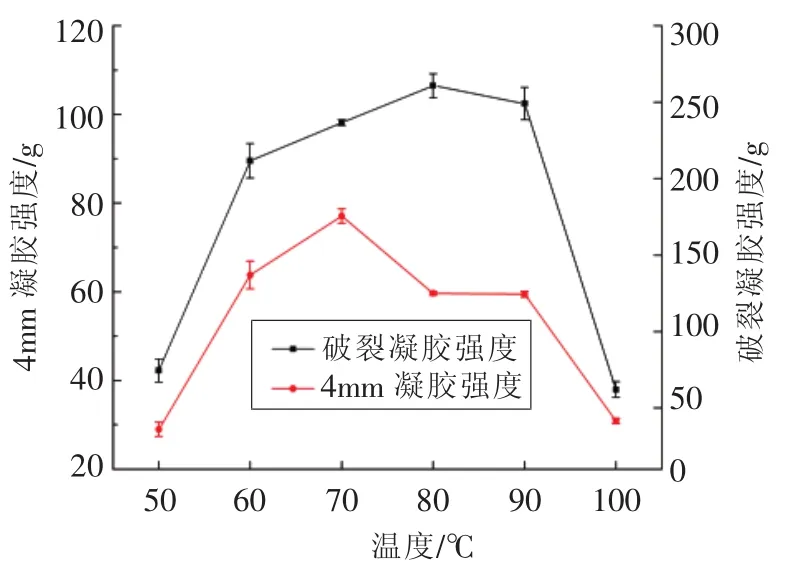
图1 熬胶温度对鱼皮胶冻凝胶强度的影响Fig.1 Effect of temperature on gel strength
发生变化的原因是由于温度从50℃升高至80℃时,胶原蛋白受热变性,螺旋结构逐渐打开成链,蛋白质分子之间的交联度增加,形成网络结构,因此凝胶强度出现了明显的上升。80℃之后,随着温度继续升高,蛋白质分子开始出现降解,导致在后续的冷却过程中α-链之间的交联度降低,凝胶强度也随之下降[20]。黄雯等[21]用热水法提取斑点叉尾鮰鱼皮胶原蛋白发现,随着温度升高,胶原蛋白凝冻的凝胶强度会出现先上升后下降的趋势,在90℃处出现凝胶强度最大值,与本试验结果类似。
2.2.1.2 熬胶温度对胶冻色泽的影响 由表3可见,随着温度的升高,胶冻的亮度值L*、白度值W先上升后下降,在80℃出现最大值,说明在80℃条件下鱼皮胶冻的亮度最大,光泽度最好。所有胶冻的a*值为正值、b*值为负值说明胶冻表现出的颜色为多黄绿而少红蓝,有一定的光泽,这与感官结果保持一致。在80℃时a*、b*值最接近0,白度值达最大,说明在80℃的条件下,鱼皮胶冻的杂色最少,呈现浅黄色。

表3 熬胶温度对鱼皮胶冻L*,a*,b*值的影响Table 3 Effect of temperature on L*,a*,b*values
随着温度的升高,胶冻的颜色先变浅后变深,而且光泽降低,透明度下降。这是由于熬胶温度的提高,色素会发生协同提取,色素溶解后颜色扩散至水中,鱼皮胶液的颜色由此变深。此外,温度的升高会加大明胶的水解,产生更多的游离氨基,与鱼皮中的羰基化合物发生褐变反应使颜色加深[12]。结合感官评定,作为食用产品,胶冻呈现浅黄色并且透明性越好的越易被接受。
2.2.1.3 熬胶温度对胶冻感官评定的影响 由图2可知感官评定结果,70℃下分数最高,50℃和80℃次之。但是50℃条件下凝胶强度低于100 g,且感官评定中组织结构的结果也同时反应了此条件的胶冻硬度和弹性很差,不满足实际生产需求,因此70℃和80℃较符合条件。80℃条件下的胶冻气味、组织结构方面在感官上优于70℃条件下的胶冻。此外,80℃条件下的胶冻凝胶强度数值为267.849 g,符合生产需求。随着熬胶温度的升高,胶冻的气味得分逐渐增加,说明胶冻的腥味减轻,整体气味更易接受。这可能是因为温度的升高促进了鱼皮中的氨基化合物和羰基化合物之间发生美拉德反应,改善了胶冻的整体风味[4]。结合色泽数据可知,该条件下的胶冻亮度最大,最接近无色。因此,基于感官评定结果,并综合考虑凝胶强度和色泽,选取80℃为鲟鱼鱼皮胶冻的最佳熬胶温度。
2.2.2 熬胶料液比对鱼皮胶冻的影响
2.2.2.1 熬胶料液比对胶冻凝胶强度的影响 图3所示结果表明,胶冻的凝胶强度随着料液比增加而下降。这是因为改变料液比就等同于直接改变溶液中胶原的浓度。需要说明的是,在料液比为1∶1和1∶2时,所加水并不能没过鱼皮,对实际生产没有意义,因此没有考虑这两个比例。当加水量达到3倍之后,凝胶强度的变化趋势相对较为平缓,但当料液比高于1∶5之后,胶冻的凝胶强度数值低于100 g,凝胶特性较差,也不适宜实际生产。
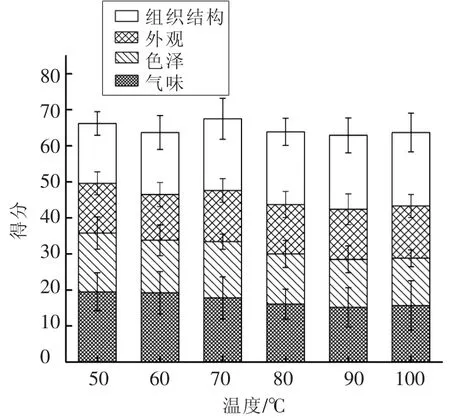
图2 熬胶温度对鱼皮胶冻感官评定的影响Fig.2 Effect of temperature on sensory evaluation
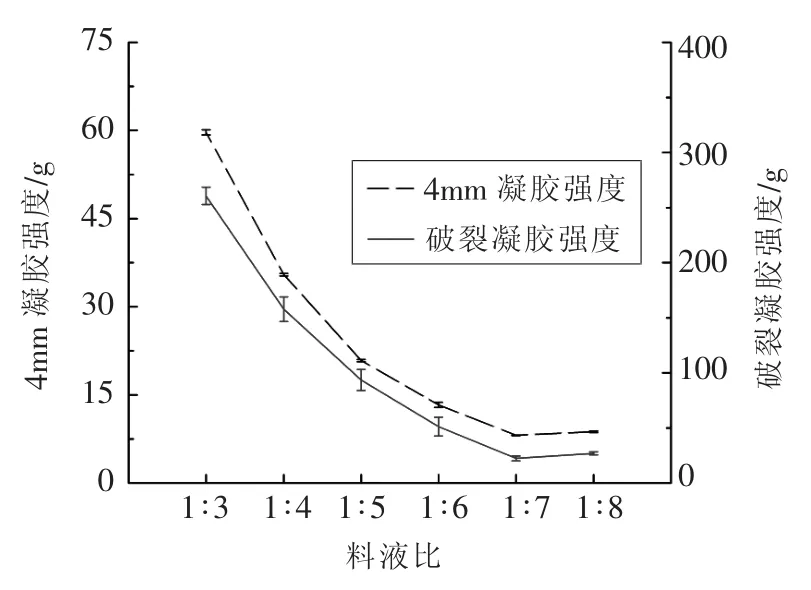
图3 熬胶料液比对鱼皮胶冻凝胶强度的影响Fig.3 Effect of material/water ratio on gel strength
有学者认为,胶冻在凝胶过程中,胶原蛋白的浓度对明胶形成稳定、有序的网状结构有十分重要的促进作用[22],浓度越大,形成的网状结构越致密稳定,表现出来的凝胶强度越大。而氨基酸中自由羟基的含量与水分子形成的氢键也会影响凝胶强度,胶原大分子附近的水分子会使胶原结构更稳定[23],增加的水分子形成更多的氢键会促进凝胶强度的增大,但不及浓度降低带来的影响。因此,对于胶冻来说,加水量影响着体系的胶原浓度和所形成网状结构的持水性,料液比增大后凝胶强度降低。
2.2.2.2 熬胶料液比对胶原蛋白的影响 由图4、图5可知,随着加水量的增大,胶原蛋白越来越多溶于水中,但变化幅度不大。以羟脯氨酸标准曲线y=0.0769x+0.0298计算,在料液比为1∶4时,鱼皮中胶原蛋白残存率达最低56.11%,胶液中胶原蛋白回收率达44.07%。
随着料液比的增大,胶原蛋白回收率在1∶3~1∶4处稍有增加后趋于稳定,这说明在料液比为1∶4之后的提取条件下胶原蛋白的溶出量达到接近饱和的状态,但增加的水量使胶液中胶原蛋白的浓度却在降低。胶液中胶原蛋白的浓度在很大程度上影响着胶冻的凝胶强度,这是因为羟脯氨酸结合羟基构建三维结构对明胶的形成及稳定性有至关重要的作用[24]。因此,增大加水量既能促进鱼皮中胶原蛋白的溶出,又会因影响了胶原蛋白的浓度而导致胶冻凝胶性能的下降。

图4 熬胶料液比对胶液中胶原蛋白回收率的影响Fig.4 Effect of material/water ratio on recovery collagen in liquid

图5 熬胶料液比对鱼皮胶原蛋白残存率的影响Fig.5 Effect of material/water ratio on remaining rate of rate of collagen in skin
2.2.2.3 熬胶料液比对胶冻感官评定的影响 由图6可知,1∶5条件下的胶冻总评分最高,其次为1∶6,1∶7和1∶4。在料液比为 1∶7和1∶8 条件下虽然胶冻的色泽外观良好,但是凝胶强度过小,凝冻效果较差。胶冻组织结构的感官评定结果在1∶3~1∶5之间上升,随后下降,1∶4和1∶5条件下的组织结构更优,这说明作为食品,胶冻的凝胶强度并非越大越好。在实际生产中加水量过多会增加能耗,造成不必要的浪费。因此结合凝胶强度和胶原蛋白的结果,选取1∶4为鲟鱼鱼皮胶冻熬胶最佳料液比。
2.2.3 熬胶时间对鱼皮胶冻的影响
2.2.3.1 熬胶时间对胶冻凝胶强度的影响 由图7可见,随着熬胶时间的延长,胶冻凝胶强度的变化趋势为先上升后下降。在3 h时胶冻的破裂凝胶强度达最大值,为168.16 g;在4 h时4 mm凝胶强度达最大值,然后随着时间延长而下降。1 h和5 h处胶冻的破裂凝胶强度均低于100 g,感官评价结果也反映出1 h和5 h条件下组织形态不佳,硬度和弹性不够,不适合用于生产。
有研究报道,鱼皮明胶的凝胶强度与鱼的生存环境有关。用热水法提取时,冷水鱼鱼皮明胶的凝胶强度会相对温水鱼较弱[25],这是因为冷水鱼的胶原蛋白对温度更为敏感,在温度高时更容易发生降解。因此在高温提取的条件下,增加提取时间更加增大了提取强度,使蛋白质的降解程度增大。有学者认为,较长时间的热提取会激活某些内源性蛋白酶导致胶冻的凝胶性能被破坏,凝胶强度减小,因此在3 h后胶冻的凝胶强度下降。而在3 h之前,蛋白质逐渐被水解但还未被降解成为小的肽链,明胶中α和β链的含量会影响明胶的凝胶强度,多肽含量少且更多的高聚体会使其凝胶强度更大[26],因此胶冻的凝胶强度随熬胶时间延长而上升。熬胶时间为2 h时鱼皮胶冻的凝胶强度已符合本试验的理想指标。
2.2.3.2 熬胶时间对胶冻色泽的影响 从表4数据中可以看出,熬胶时间对胶冻色泽,尤其是a*、b*值的影响不大,这与感官结果较为一致。在1 h至5 h之间,胶冻的L*值整体呈下降趋势,a*值变化无显著差异,b*值除3 h外差异不大。随着熬胶时间的延长,鱼皮中的色素逐渐溶出,这与白度值持续下降的结果相吻合,但在脂肪的存在下,色素溶解速率会存在轻微的波动,亮度也受到色素的影响而出现变化。Kaewruang P等[27]研究表明,明胶的颜色不会影响其凝胶特性。
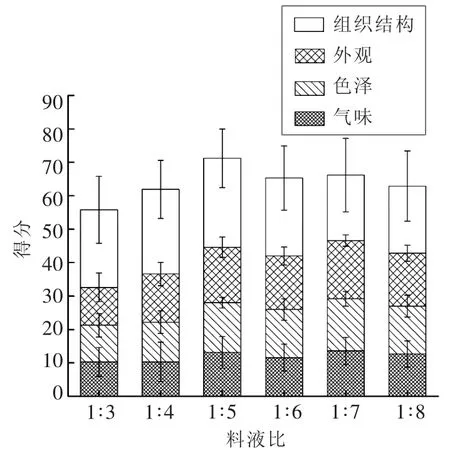
图6 熬胶料液比对鲟鱼鱼皮胶冻感官评定的影响Fig.6 Effect of ratios of material to water on sensory evaluation of sturgeon skin edible gelatin
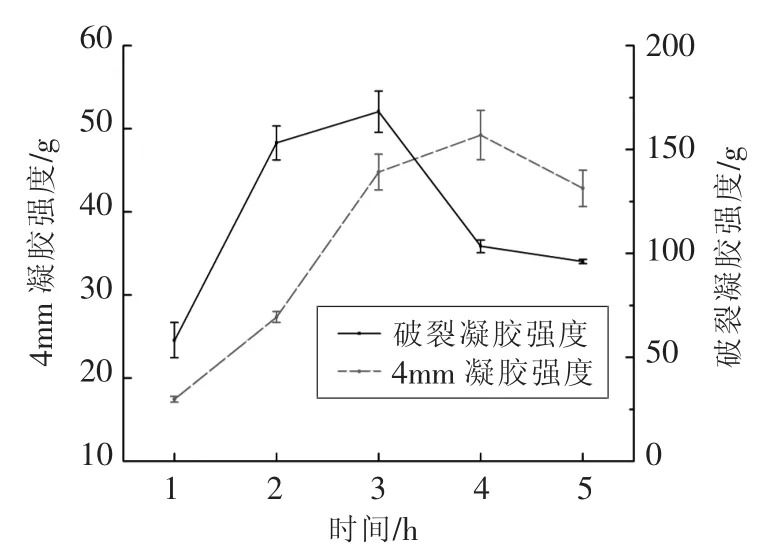
图7 熬胶时间对鲟鱼鱼皮胶冻凝胶强度的影响Fig.7 Effect of time on gel strength

表4 熬胶时间对鱼皮胶冻L*,a*,b*值的影响Table 4 Effect of time on L*,a*,b*values
2.2.3.3 熬胶时间对胶液的影响 可溶性固形物是指液体中所有溶解于水的化合物的总称。包括糖、酸、维生素、矿物质等,与提取时的条件有关[28]。由表5中数据可知,在熬胶过程中,随着时间延长,鱼皮胶液中固形物含量逐渐增加,且在3 h之前显著增加。在3 h之后,固形物的溶出量几乎不发生变化,趋于平稳。
这说明3 h时固形物已经基本溶出完全,延长熬胶时间也无法使其继续溶出。

表5 熬胶时间对胶液固形物含量的影响Table 5 Effect of time on total solids content of liquid
图8展示了熬胶时间对胶原蛋白的影响,随着熬胶时间的增加,胶液中胶原蛋白含量呈先上升后下降的趋势,最高点出现在4 h处,胶液中胶原蛋白含量达56.54 mg/mL,但固形物含量在3 h处达最大值,说明可能是除胶原蛋白外的其它可溶性物质在3 h后遭到了破坏或降解。在4 h以前,熬胶时间越长,溶于水中的胶原片段越多,所以测得的胶原蛋白含量会随熬胶时间的延长而增加。此外,胶液中胶原蛋白含量是通过测定羟脯氨酸的含量换算得出的,即使蛋白被降解仍可以测出。当熬胶时间达5 h时,氨基酸可能受到了破坏,造成数据下降。

图8 熬胶时间对胶液中胶原蛋白含量的影响Fig.8 Effect of time on collagen contents of liquid
2.2.3.4 熬胶时间对胶冻微观结构的影响 组织切片技术可以直接反映出在食品加工过程中的微观结构的变化。切片显示熬胶时间对胶冻的微观结构产生了明显的影响,选取结构变化显著的时间点进行分析。结果如图9所示。
图9清晰地展示了不同熬胶时间下,胶冻网络结构的变化情况,这也可以看作是熬胶过程中微观结构的变化。凝胶基团中蛋白的构象和链的长度将直接影响明胶的凝胶强度,一般来说,凝胶的结构应该呈海绵状或珊瑚状[29]。当熬胶时间从60 min延长至180 min的过程中,可以清楚地观察到胶冻网络结构逐渐形成,孔隙由不均匀变得均匀。在180 min时网络结构最清晰,比较致密均匀,这应该是明胶分子不断聚集与水分子发生交联的结果,也与凝胶强度在这段时间内由58.22 g增长至最大值168.16 g的变化一致,说明微观网络结构的形成与表象凝胶强度之间有密切联系。随着加热时间的延长,网络结构的完整性逐渐被破坏,由密集状态转变为不规则状态,形成大的孔隙,这与胶冻凝胶强度的变化仍保持一致。加热至240 min之前,胶液中的胶原蛋白含量持续增加,羟脯氨酸会通过氢键结合羟基,聚集的明胶分子团吸水膨胀,但240 min时网络结构较180 min断裂处增加,300 min时网络结构几乎完全被破坏。结合微观结构图和凝胶强度的结果分析,推测网络结构的吸水膨胀程度与胶冻的4 mm凝胶强度有较大关系,而网络结构的完整性与破裂凝胶强度的关系较大。

图9 不同熬胶时间下鱼皮胶冻的微观结构Fig.9 Microstructure of sturgeon edible gelatin at different time
2.2.3.5 熬胶时间对胶冻感官评定的影响 随着熬胶时间的延长,鱼皮胶冻的气味越来越不愉悦,色泽接受度下降,透明度下降,但组织结构的得分出现了先上升后下降的趋势,总分最高分出现在2 h处,与凝胶强度、微观结构展现出的结果相一致。M.V.Chandra等[30]的研究曾表明,3种鲤鱼鱼皮明胶的凝胶强度和硬度有极高的相关性,这与本试验结果类似。从感官上看,熬胶时间在2 h条件下制得的胶冻成冻完整,硬度和弹性适中,且腥味和颜色在可接受范围内。因此综合考虑其它指标和实际生产的能耗与效率,最终选择2 h为鲟鱼鱼皮胶冻最佳熬胶时间。
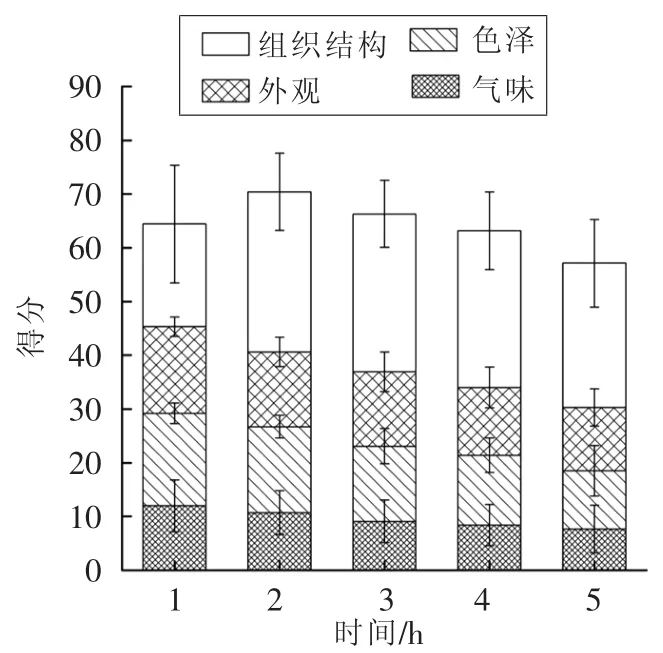
图10 熬胶时间对鲟鱼鱼皮胶冻感官评定的影响Fig.10 Effect of time on sensory evaluation of sturgeon skin edible gelatin
3 结论
鲟鱼皮富含蛋白质,其中胶原蛋白占到粗蛋白的83.15%,丰富的胶原蛋白有利于开发鱼皮胶冻类产品,拓宽了鲟鱼皮的加工途径。
鲟鱼鱼皮胶冻最佳熬胶工艺条件为温度80℃,料液比1∶4,时间2 h,在此条件下得到的胶冻凝胶强度可达168.16 g;微观网络结构清晰;感官评分最高,易于接受。试验结果表明熬胶的条件对胶冻的理化特性有很大的影响,胶冻的凝胶特性、感官的变化与胶原蛋白、微观结构之间有紧密联系,温度适宜,熬胶至3 h内,胶原蛋白浓度越高,胶冻微观网状结构的完整性越好,断裂、不规则的地方较少,表现出来的胶冻品质为凝胶强度大,感官评定的得分较高;反之则会难以形成完整的网状结构或被破坏,导致胶冻的凝胶强度低,成冻状态差,感官不佳,这为指导生产提供了数据与理论支撑。在试验过程中发现,鲟鱼皮的脂肪含量较高,对胶冻的品质会造成一定的不良影响,后续可考虑脱脂处理优化产品品质。
