高速逆流色谱结合制备液相色谱法分离制备葡萄籽中的多酚
2019-10-11贺天雨席兴军赵新颖
王 尉, 贺天雨, 兰 韬, 席兴军, 赵新颖*
(1. 北京市理化分析测试中心, 有机材料检测技术与质量评价北京市重点实验室, 北京 100094; 2. 中国标准化研究院, 北京 100191)
多酚类物质是含有苯环和多羟基结构的一类天然化合物的总称,其中以儿茶素(catechin, C)和儿茶素相关的酯类多酚、原花青素类多酚最为常见(见图1)。目前,多酚类物质是世界范围内公认的清除自由基的最有效的天然抗氧化剂[1],具有抗衰老[2]、抗炎[3,4]、抗癌[5,6]、降血糖[7,8]等多种功效。它可以从绿茶、水果的加工副产物中获得,其中葡萄加工副产物是重要的途径之一。我国葡萄年产量可达到200多万吨[9], 80%左右用于酿造葡萄酒和生产葡萄饮品[10],而葡萄皮、葡萄渣和葡萄籽等副产物则是提取多酚的重要原料[11,12],尤其是葡萄籽中原花青素和儿茶素等多酚类物质的量可达到70%[13]。因此,研究葡萄籽中高纯度多酚类物质的分离制备方法具有十分重要的意义。

图 1 3种多酚类的基本化学结构Fig. 1 Basic chemical structures of three polyphenols
制备液相色谱(preparative high performance liquid chromatography, Pre-HPLC)具有分离效率高、收集准确的优势,适合工业化的制备,在高纯度天然产物分离制备中的应用较为广泛[14,15]。但是,该方法对分离填料依赖较强,灵活优化组合实验条件受到限制,实验成本高,在实验室级别的制备方面略显不足。高速逆流色谱(high-speed counter-current chromatography, HSCCC)是一种连续高效的液-液分配色谱分离技术,结合了液-液萃取和分配色谱的特点,无需任何固态载体或支撑,流动相和固定相选择更加多样,组合更加灵活。同时具有单次进样量大,样品不需精制的优势。该技术在实验室级别高纯度天然产物制备方面得到了很多应用[16-18],尤其是在多酚类物质的分离制备方面具有很好的应用。Cao等[19]利用HSCCC法从绿茶提取物中得到了表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)、没食子儿茶素没食子酸酯(gallocatechin gallate, GCG)和表儿茶素没食子酸酯(epicatechin gallate, ECG)。Tuba等[20]采用HSCCC多种溶剂体系对黑野樱莓为原料的合成产物进行分离,制备得到了原花青素B1、原花青素B2、原花青素B5和原花青素B7。Yoichi等[21]利用HSCCC成功分离得到苹果中的儿茶素单体、原花青素二聚体和三聚体。但是,与Pre-HPLC相比,HSCCC的分离效率较低,对于结构类似物的分离具有一定困难。因此,HSCCC技术和其他分离技术联用,就成为实验室同时分离制备多种高纯度单体的最为有效的方法。
本研究利用HSCCC结合Pre-HPLC对葡萄籽中的多酚类物质进行分离纯化。通过优化溶剂分离条件,对目标物分组收集,最后进行纯度分析和结构确证,建立了一套葡萄籽中多酚类物质的提取纯化方法。该方法操作简单,提取率高,能够在实验室实现毫克级高纯度多酚单体的制备。
1 实验部分
1.1 仪器、试剂与材料
半制备型高速逆流色谱仪(TBE-300B,上海同田生物技术有限公司);半制备高效液相色谱仪(1 525,美国Waters公司);高效液相色谱仪(LC-20A,日本Shimadzu公司);高分辨质谱仪(Q Exactive Orbitrap,美国Thermo公司);冷冻干燥机(ALPHA 1-2 plus,德国Christ公司);旋转蒸发仪(Eyela N1100,日本东京理化器械株式会社); XPE105电子天平(分度值d=0. 01 mg,瑞士Mettler Toledo公司); Atlantis T3色谱柱(250 mm×4.6 mm, 5 μm)、Atlantis T3 Prep OBD色谱柱(250 mm×19 mm, 10 μm)(美国Waters公司); Research plus可调量程移液器(1 000 μL,德国Eppendorf公司)。
乙腈(色谱纯,美国Fisher Scientific公司);原花青素B1、原花青素B2对照品(纯度均>95%,大连美仑生物技术有限公司);没食子酸(gallic acid, GA)、C、表儿茶素(epicatechin, EC)、EGCG、GCG、ECG对照品(纯度>98%,上海融禾医药科技有限公司);乙酸乙酯、正丁醇、甲基叔丁基醚、乙醇、乙腈、甲醇和磷酸(均为分析纯,国药集团化学试剂有限公司)。葡萄籽取自赤霞珠(河北沙城)。
1.2 实验方法
1.2.1样品提取物的制备
将葡萄籽于60 ℃烘箱中恒重后,粉碎,过0.3 mm筛。称取100 g葡萄籽粉末,按料液比1∶10(g/mL)加入1 L 50%(体积分数,下同)乙醇,于60 ℃超声辅助提取2次,每次0.5 h,过滤,合并滤液,减压蒸馏得到提取物浸膏,于4 ℃保存,备用。
1.2.2对照品溶液配制
分别称取GA、C、EC、EGCG、GCG、ECG、原花青素B1和原花青素B2对照品各10 mg,置于10 mL容量瓶中,用甲醇稀释至刻度,制备成1 g/L的单标准溶液,于4 ℃保存。分别移取1 mL溶液置于10 mL容量瓶中,用甲醇稀释至刻度,制备成0.1 g/L的混合标准溶液,每次使用前配制。
1.2.3HPLC和HPLC-MS条件
色谱条件:色谱柱为Atlantis T3(250 mm×4.6 mm, 5 μm);流动相A为0.1%甲酸溶液,流动相B为乙腈。线性梯度洗脱程序为:0~45 min, 10%B~20%B; 45~60 min, 20%B~50%B。流速:0.7 mL/min;检测波长:278 nm;柱温:30 ℃,进样量:10 μL。
质谱条件:电离源为电喷雾负离子模式(ESI-);监测模式:全扫模式(full MS);鞘气压强:2.07×105Pa;辅助气压强:1.03×105Pa;喷雾电压:3.5 kV;毛细管温度:320 ℃;辅助气温度:350 ℃;扫描范围:m/z150~1 500。
1.2.4分配系数的测定
取10 mg葡萄籽提取物加入静置分层的两相溶剂系统中,涡旋振荡至无明显不溶物,静置分层。分取上相、下相溶液按照1.2.3节方法进行HPLC分析,上相和下相峰面积的比值即为分配系数。
1.2.5HSCCC分离条件
将选定的溶剂系统充分混合后,静置分层,上相为固定相,下相为流动相。先以10 mL/min的流速泵入固定相,待固定相充满柱体后,打开主机,调整为正向洗脱方式,主机正转,转速为900 r/min,当达到设定转速时,以2 mL/min的流速泵入流动相。主机温度控制在25 ℃,检测波长设定为280 nm,流动相从主机出口流出时进样。HSCCC第一次制备的溶剂体系为正丁醇-乙酸乙酯-水(1∶14∶15, v/v/v); HSCCC第二次制备的溶剂体系为正己烷-乙酸乙酯-水(1∶10∶10, v/v/v)。
1.2.6Pre-HPLC色谱条件
色谱柱:Atlantis T3 Prep OBD(250 mm×19 mm, 10 μm)。流动相A为0.1%甲酸溶液,流动相B为乙腈。线性梯度洗脱程序为:0~60 min, 8%B~20%B; 60~80 min, 20%B~50%B。流速:10 mL/min;检测波长:278 nm;柱温:30 ℃;进样量:200 μL。
2 结果与讨论
2.1 提取条件的选择
因为多酚类物质含有多羟基结构,所以一般具有较大的极性。目前报道[12,22,23]的提取溶剂一般为甲醇或乙醇的水溶液,考虑到安全性,本试验选用50%乙醇作为提取溶剂。由于多羟基结构的存在,多酚类成分较容易被氧化,提取温度不宜过高,选择60 ℃超声波辅助提取,以达到增加提取效率、缩短提取时间、降低提取温度的目的[12,24-26]。按照1.2.1节操作制备得到的葡萄籽提取物,稀释到合适的浓度,按照1.2.3节条件进行质谱分析(见图2),结合质谱数据可知,有9种物质可能是多酚类物质(见表1)。其中,推测化合物1可能是GA;化合物2、3、5可能是原花青素类化合物;化合物4、6可能是儿茶素类化合物;化合物7、8可能是没食子儿茶素没食子酸酯类化合物;化合物9可能是儿茶素没食子酸酯类化合物。上述结果表明,该提取条件基本能将葡萄籽中的多酚类物质提取出来,提取率平均为4.5%,满足HSCCC的要求,可以进行单体制备。
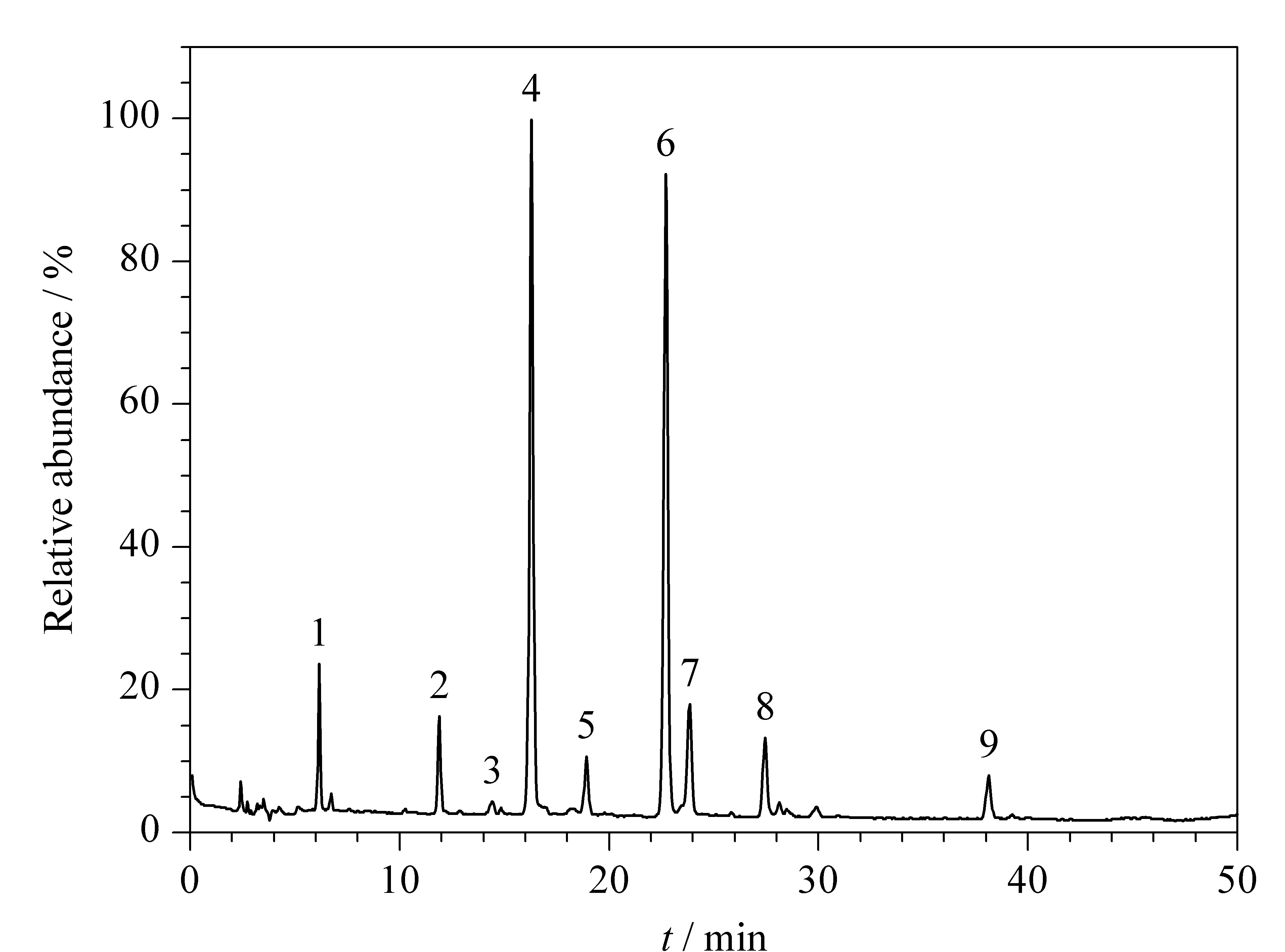
图 2 葡萄籽提取物的总离子流谱图Fig. 2 Total ion current chromatogram of the grape seed extract
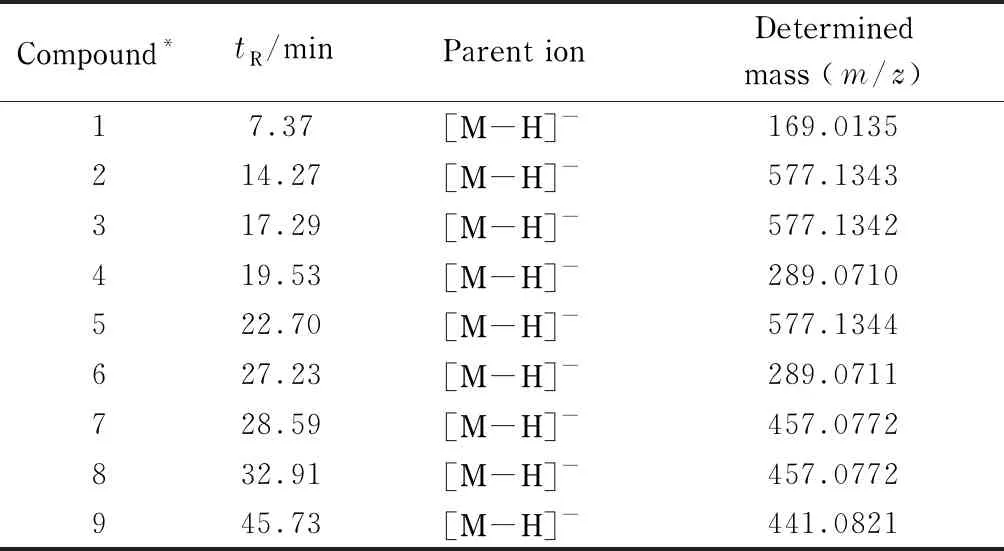
表 1 葡萄籽提取物的HPLC-MS结果Table 1 Results of HPLC-MS of the grape seed extract
*: Nos. are the same as those in Fig. 1.tR: retention time.

表 2 葡萄籽提取物中目标化合物在不同溶剂体系中的分配系数Table 2 Partition coefficients of the target compounds from the grape seed extract in different solvent systems
K: distribution coefficient; MTBE: methyltert-butyl ether.
2.2 高纯度单体的分离制备
2.2.1HSCCC溶剂系统的选择
在HSCCC分离过程中,合适的溶剂系统是成功分离目标物的关键。溶剂系统分层时间应小于30 s,同时目标物在溶剂系统中的分配系数(K)应在0.5~2.0之间,以获得正向洗脱模式的最佳分离效果。如果分配系数大于3,会造成出峰时间过长,目标物较难洗脱的情况,应该交换上下相,采用反向洗脱模式进行分离。根据HSCCC分离多酚类化合物的相关报道[19-21],结合葡萄籽中的多酚成分均为中等或偏强极性化合物的特征,选择甲基叔丁基醚/乙酸乙酯-水的中等极性基础溶剂系统,通过添加正丁醇、异丙醇和乙腈等桥溶剂调节上相溶剂极性的方式,获得合理的分配系数。葡萄籽提取物中疑似多酚的9种化合物分配系数的测定试验结果(见表2)表明,在正丁醇-甲基叔丁基醚-乙腈-水(2∶4∶3∶8, v/v/v/v)溶剂系统中,化合物1的分配系数为2.78,大于2.0会造成分离时间过长;化合物2和化合物5的分配系数分别为1.48和1.59,分配系数接近,不利于目标物的分离。在正丁醇-乙酸乙酯-水(1∶14∶15, v/v/v)和乙酸乙酯-异丙醇-水(20∶1∶20, v/v/v)溶剂系统中,化合物1、2和5的分配系数在0.79~2.04之间,可以进行HSCCC分离。在上述所有溶剂体系中,化合物4、6、7、8、9的分配系数均大于3,可以采用反向洗脱进行HSCCC分离。因此,综合考虑分离时间和效率,选择分配系数相对较小的正丁醇-乙酸乙酯-水(1∶14∶15, v/v/v)作为HSCCC分离的溶剂系统。
2.2.2HSCCC第一次制备
样品上样量为200 mg,分别对HSCCC正向洗脱0~300 min之间的色谱峰Ⅰ~Ⅲ和反向洗脱300~400 min之间的色谱峰Ⅳ~Ⅵ进行收集(见图3)。采用1.2.3节的HPLC法对以上6个组分进行纯度分析(见图4)。根据保留时间初步定性,采用峰面积归一化法计算纯度,可得色谱峰Ⅰ为化合物2(9.5 mg,纯度71.2%),色谱峰Ⅱ为化合物5(6.7 mg,纯度65.5%),色谱峰Ⅲ为化合物1(12.5 mg,纯度98.3%),色谱峰Ⅳ为化合物9(17.8 mg,纯度80.9%),色谱峰V为化合物4(15.2 mg,纯度96.7%),色谱峰Ⅵ为化合物6、7和8的混合物,收集量为20.8 mg。根据纯度数据可以判定,利用HSCCC可以得到纯度高于95%的化合物1和4的单体,可以进行质谱定性实验;得到化合物2、5和9的主要单体,但纯度不高,需要进一步提纯;尚不能实现化合物6、7和8的分离,需要进一步优化分离制备条件。

图 3 葡萄籽提取物HSCCC色谱图Fig. 3 HSCCC chromatogram of the grape seed extract

图 4 HSCCC级分的HPLC色谱图Fig. 4 HPLC chromatograms of HSCCC fractions
2.2.3HSCCC第二次制备
2.2.2节中即使采取HSCCC反向洗脱模式,也不能实现化合物6、7和8的完全分离。根据本课题组[27]前期研究经验,必须降低它们在上相中的分配系数,才可以达到分离的目的。故通过采用极性更低的正己烷代替正丁醇-乙酸乙酯-水溶剂系统中的正丁醇,可以有效降低目标物在上相的分配,从而增加分离度并缩短分离时间。重复进行2.2.2节中的色谱峰Ⅵ的收集3次,合并后作为此次HSCCC分离的样品(65.2 mg)。采用正己烷-乙酸乙酯-水(1∶10∶10, v/v/v)溶剂系统在0~390 min进行正向洗脱,得到色谱峰Ⅶ和峰Ⅷ;在390~480 min进行反向洗脱,得到色谱峰Ⅸ(见图5)。根据保留时间初步定性,根据峰面积归一化法计算纯度(见图6),可得:色谱峰Ⅶ为化合物6(33.5 mg,纯度99.2%),峰Ⅷ为化合物7(7.3 mg,纯度99.3%),色谱峰Ⅸ为化合物8(11.2 mg,纯度99.2%)。化合物6、7和8的纯度均高于99%,可以进行质谱定性实验。
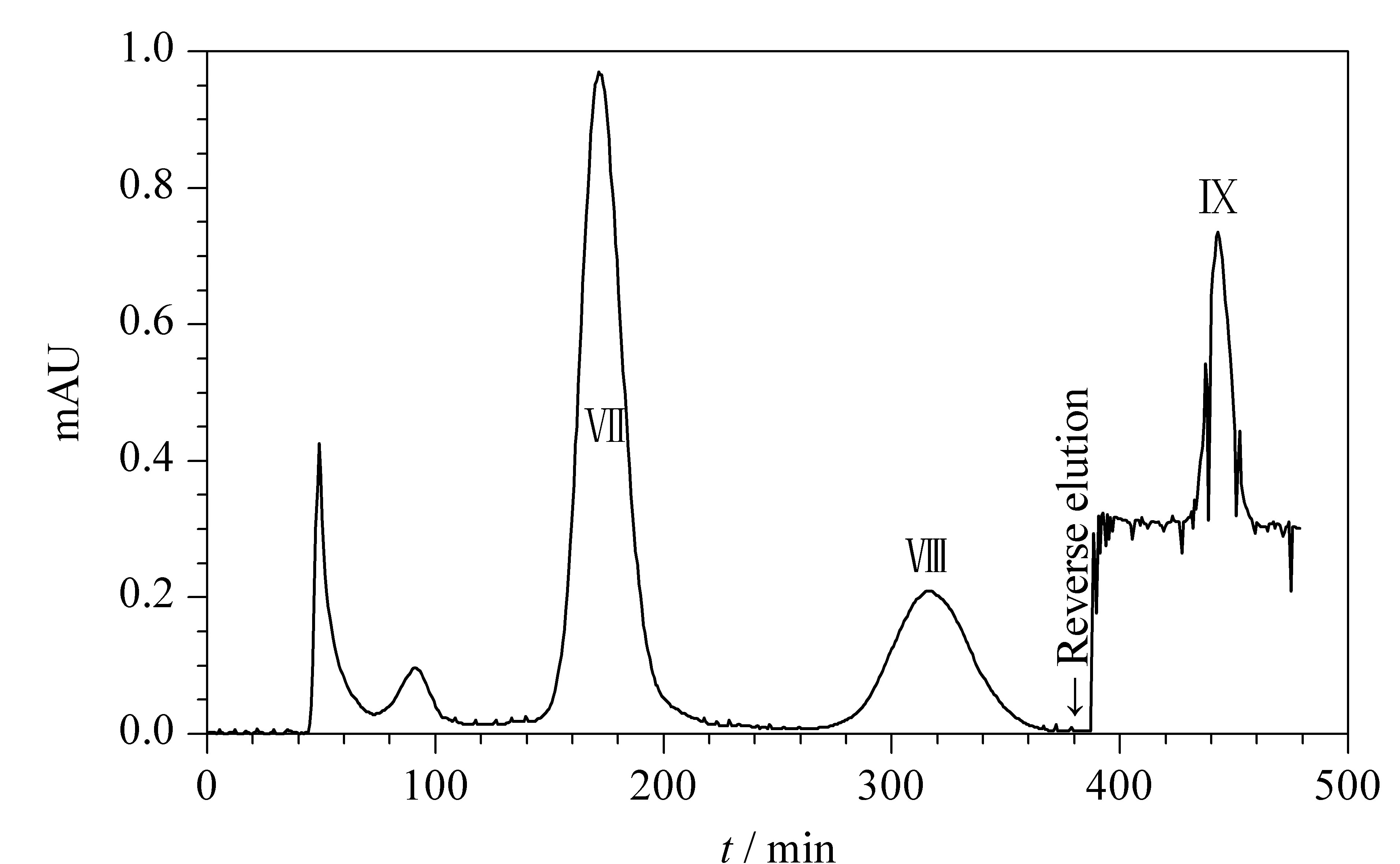
图 5 级分Ⅵ的HSCCC色谱图Fig. 5 HSCCC chromatogram of fraction Ⅵ

图 6 级分Ⅵ经HSCCC分离后的HPLC色谱图Fig. 6 HPLC chromatograms of the fraction Ⅵ separated by HSCCC
2.2.4Pre-HPLC进一步纯化
经2.2.2节分离制备可分别得到化合物2、5和9的主要单体,纯度均高于65%,由于样品量少,更适宜采用Pre-HPLC进行进一步分离。选用与HPLC分析相同型号的Atlantis T3色谱柱,采用1.2.5节方法可以分别制备得到3种化合物的单体。根据保留时间初步定性,峰面积归一化法计算纯度(见图7),可得化合物2(4.3 mg,纯度98.5%)、化合物5(1.8 mg,纯度97.2%)和化合物9(8.9 mg,纯度98.9%)。3种单体的纯度均高于97%,可以进行质谱定性实验。

图 7 制备HPLC纯化后化合物2、5和9的HPLC色谱图Fig. 7 HPLC chromatograms of compound 2, 5, and 9 separated by preparation HPLC (Pre-HPLC)
2.3 质谱定性实验
采用1.2.3节对分离制备得到的8个单体化合物进行定性实验,其中化合物2和化合物5、化合物4和化合物6、化合物7和化合物8互为同分异构体。通过与混合对照品保留时间比较,并结合精确分子量测定值与理论值比对(见表3),确定其结构分别为GA、原花青素B1、C、原花青素B2、EC、EGCG、GCG、ECG。此外,由于化合物3含量较低,未能完成有效的分离制备工作。

表 3 8种化合物的结构鉴定分析结果Table 3 Structural identification results of eight compounds
GA: gallic acid; C: catechin; EC: epicatechin; EGCG: epigallocatechin gallate; GCG: gallocatechin gallate; ECG: epicatechin gallate.
3 结论
利用HSCCC结合Pre-HPLC技术,采用正反向洗脱结合的方式从葡萄籽中分离得到了8种多酚,包括GA,原花青素类化合物2种(原花青素B1和原花青素B2)和儿茶素类化合物5种(C、EC、EGCG、GCG和ECG)。通过高效液相色谱-质谱法和保留时间定性,8种多酚分别为原花青素B1、原花青素B2、GA、C、EC、EGCG、GCG和ECG。采用峰面积归一化计算纯度分别为98.5%、97.2%、98.3%、96.7%、99.2%、99.3%、99.2%和98.9%。本方法简便可行,为葡萄籽的合理开发利用提供了技术支撑,有助于提高葡萄籽的附加值,变废为宝,具有很好的应用价值。
