小麦对镉胁迫的生理响应及体内镉的积累分布
2019-10-10于永昂王润豪胡海燕李成伟
于永昂, 王润豪, 胡海燕, 李成伟
(河南科技学院 生命科技学院, 河南省粮食作物基因组编辑工程技术研究中心, 河南 新乡 453003)
近年来,由于工业“三废”的不合理排放以及农药化肥不合理的使用,导致土壤中的重金属镉含量急剧增加[1-3]。其中,土壤镉污染超标率居首位,超标率达7.0%[4]。镉(Cadmium,Cd)是植物生长发育的非必需元素,其毒性强、污染范围广、迁移性强,极易被植物吸收积累,不仅严重影响作物生长发育,降低其产量和品质,而且能通过食物链富集,危害人体健康,会产生致畸、致癌及致突变等效应[5-7]。随着工业进程的快速发展,镉超标农产品报道日益增多,镉进入生态系统危害人类健康的现象日益增多,严重影响农产品的食用安全和人类健康[8]。镉对土壤的污染已成为人们所面临且亟待解决的环境污染问题之一。
植物种子在萌发期对外界环境较为敏感,镉对植物生长发育具有明显的毒害作用,对种子的萌发产生不同程度的刺激和抑制作用,影响植株的生长发育进程,导致植株生长迟缓、植株矮小、叶片泛黄等症状[9]。 镉在植物中累积到一定程度后会阻碍光合作用和呼吸作用[10-11],降低蒸腾速率,引起细胞结构的多种损伤,改变细胞膜的透性,破坏细胞内酶及代谢作用[12],导致养分亏缺,生理生化过程紊乱,最终使植物的生长发育受到不同程度的抑制,严重时可导致死亡[13]。因此,植物通过抗氧化防御机制抵抗镉的毒性[14],抗氧化酶系统可有效地预防或降低植物过氧化作用带来的损伤并抑制 MDA的积累[15]。重金属被植物吸收以后,通过调节生理和生物化学新陈代谢过程缓解或者去除镉的毒害,主要通过对重金属的吸收运输、各部位的分配方式以及与植物体内物质的结合形态等因素克服重金属胁迫危害[16]。如通过植物细胞壁固定或区隔在液泡内,根际 pH的改变,或通过氨基酸、蛋白质及多肽与 镉结合,积累、储存并固定等方式。研究表明, 镉的亚细胞分布与植物的金属耐性及解毒机制有关,亚细胞镉主要分布在根系细胞壁内[17]。因此,镉在植物中的器官积累及亚细胞分布规律是影响植物体内镉迁移、积累特性和植物毒性的重要因素。
小麦是世界上最重要的粮食作物之一,同样也是中国第二大粮食作物,其在全世界的粮食安全中占据重要地位[18]。小麦作为镉积累型作物,对镉具有较强的耐性,具有潜在的镉污染风险。目前,镉的植物毒性机制研究主要集中在光合特性、根系特性、种子萌发、植株酶活性及植物生理生化影响等方面[19-20],关于小麦器官及亚细胞不同组分镉积累分配差异,小麦解毒及耐性机制尚缺乏较为深入的研究。因此,研究小麦在镉胁迫下的植物毒性机制及应答机制,对于提高小麦对镉的抗/耐性,改良粮食作物品质,降低镉从植物进入食物链的危险性具有十分重要的理论和实践指导意义。为此,采用水培法研究不同浓度镉胁迫下,小麦种子的发芽率变化,在小麦幼苗器官中镉的分布规律及其对镉的吸收和积累差异,以期为镉在小麦体内的迁移机理以及小麦耐镉机制的研究提供理论依据。
1材料与方法
1.1供试材料
小麦:品种为百农207,由河南科技学院小麦遗传改良中心提供。
1.2试验方法
1.2.1材料处理试验设4个镉浓度处理,分别为0 mmol/L(蒸馏水,对照)、0.5 mmol/L、1.0 mmol/L和2.0 mmol/L。选取饱满均匀一致的小麦种子,用1%的 NaClO消毒15 min后,用去离子水冲洗干净,播于铺有双层直径 15 cm无菌滤纸的培养皿中,每皿摆放种子50粒。每日加 10 mL不同浓度镉溶液,于25℃培养箱内发芽,培养箱光周期为光照16 h/黑暗8 h,相对湿度(75±5)%,每个处理3次重复,7 d后开始测定发芽率、幼苗生长状况和生理生化指标。
发芽势= 4 d内供试种子发芽数/供试种子数×100%
发芽率= 7 d内供试种子发芽数/供试种子数×100%
1.2.2样品的处理与测定
1) 小麦测定样品的处理。选取5株长势一致的小麦,用去离子水冲洗干净,再用20 mmol/LNa2-EDTA浸泡30 min,去除根系吸附的镉,自来水冲洗 3~4次,最后用去离子水润洗,吸干表面水分,分成根系和地上部2个部分。根系和地上部再分成2部分,一部分在105℃杀青20 min,于 80℃烘干至恒重,称量地上部和根干重,粉碎,用于镉含量测定;另一部分保存于-20℃冰箱内备用,分别用于生理生化指标和植株亚细胞组分镉含量的测定。
2) 小麦幼苗生理生化指标的测定。各处理结束后,用丙酮提取法测定小麦叶片的叶绿素(CHL)含量;用硫代巴比妥酸法测定丙二醛(MDA)含量;超氧化物歧化酶活性(SOD)采用NBT光还原法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定。
3) 小麦幼苗亚细胞内镉含量的测定。采用WANG等[21]的方法分离根系和地上部亚细胞组分。取出预处理好的冰冻植物样,称取2 g剪碎,用植物样品与提取液[0.25 mol/L蔗糖+1 mmol/L二硫赤藓糖醇+50 mmol/L Tris-HCl缓冲液(pH 7.5)]按1∶10的比例混合后迅速将样品研磨成匀浆。研磨时先放入少量提取液,将大块的植物样品尽量磨细后,再加入大量的提取液磨成匀浆,然后转移到 50 mL离心管中,3 000 r/min离心30 s,下部沉淀和底层碎片为细胞壁组分(F1),得到的上清液在 10 000 r/min离心分离 30 min,下部沉淀为细胞器组分(F2),上清液为可溶组分(F3),全部操作在4℃下进行。
4) 样品中镉含量测定。称取烘干并粉碎后的样品0.2 g和亚细胞分离出的组分用1∶4(V/V)的HNO3-HClO4混合消煮,定容、过滤,最后采用ICP-OES测定其镉含量。亚细胞分离出的各组分无需消化,直接用原子吸收光谱仪测定镉含量。
1.3数据分析
所有数据采用Excel和SAS 8.0进行统计分析。
2结果与分析
2.1镉胁迫对小麦种子萌发的影响
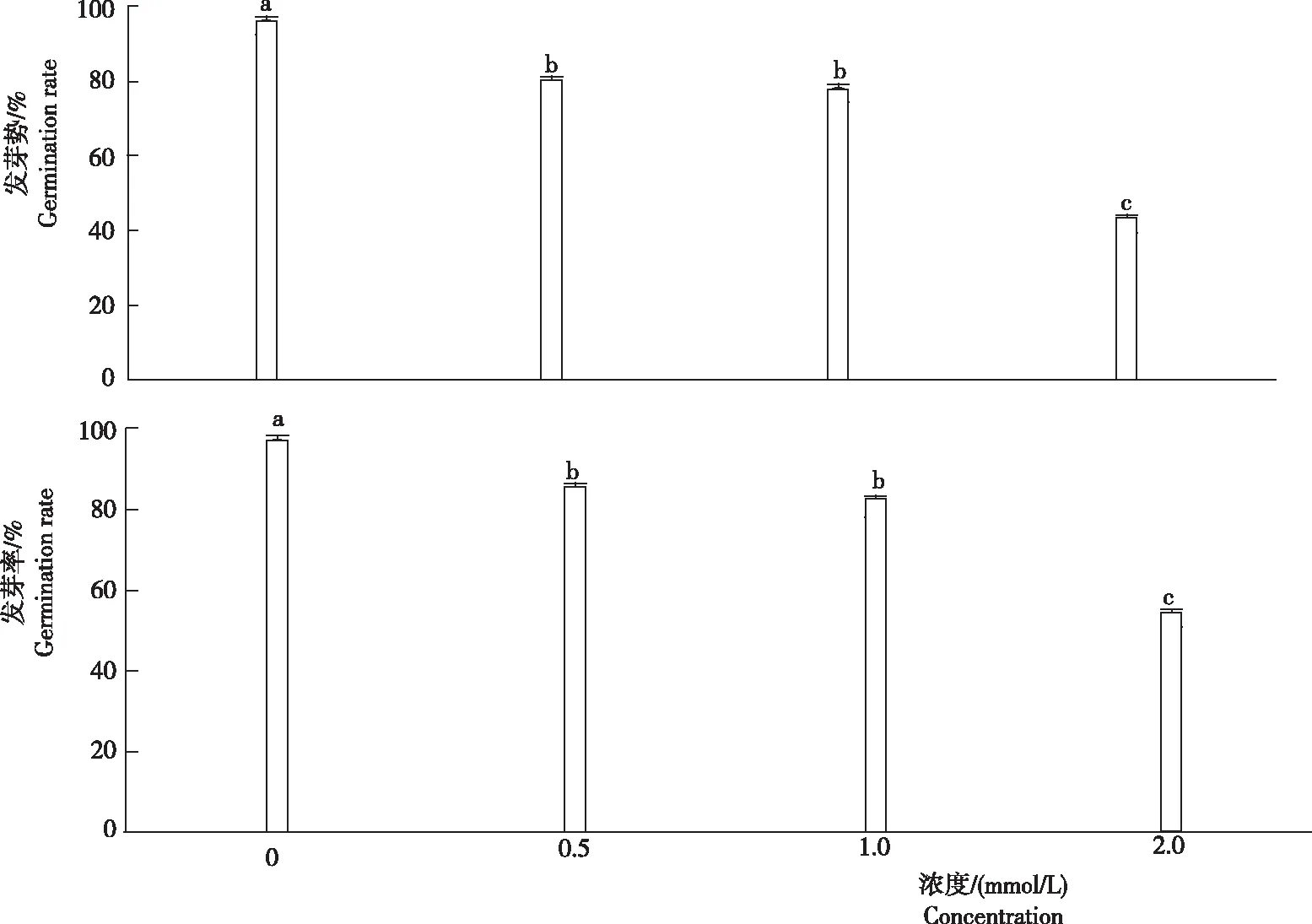
小麦种子在镉胁迫条件下能否正常萌发是其能否在镉污染土壤中生长的先决条件。用于反映种子萌发的重要参数是发芽势和发芽率,发芽势反映种子的发芽速度和整齐度,发芽率反映种子发芽多少,是种子质量的综合反映。由图1可知,随着镉浓度的升高,小麦种子的发芽势和发芽率均逐渐下降。所有镉处理小麦种子的发芽率和发芽势均显著低于对照。当镉胁迫浓度为2.0 mmol/L时,其发芽势和发芽率最低,分别为45%和53%。
注:不同小写字母表示处理间差异显著(P<0.05)水平,下同。
Note:Different letters indicate significant difference atP<0.05 level,the same below.
图1不同浓度镉胁迫下小麦种子的发芽势和发芽率
Fig.1 Germination potential and germination rate of wheat seeds under cadmium stress with different concentration
2.2镉胁迫对小麦叶绿素及丙二醛含量的影响
2.2.1叶绿素叶绿素是植物进行光合作用的重要色素,其含量是判断植物光合效率及其同化能力的重要指标之一。由图2可知,随着镉浓度的增加,小麦幼苗叶片叶绿素含量逐渐降低,且各处理均显著低于对照,镉浓度0.5 mmol/L、1.0 mmol/L和2.0 mmol/L处理分别较对照降低41.82%、47.27%和76.36%。表明,随着镉浓度增加,小麦幼苗的光合作用受到抑制,进而影响幼苗的生长和发育。
2.2.2丙二醛(MDA)丙二醛含量是植物组织在逆境下遭受氧化胁迫发生膜脂过氧化的产物,其含量高低反映膜受损程度。从图2可知,随着镉浓度的增加,小麦幼苗叶片中MDA含量逐渐上升。镉浓度0.5 mmol/L、1.0 mmol/L和2.0 mmol/L处理的MDA含量较对照显著增加,分别增加213.65%、617.33%和690.67%。表明,随着镉浓度的增加,引起小麦叶片内膜脂过氧化,从而引起膜的严重损伤。
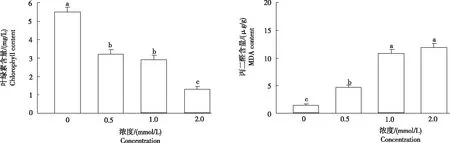
图2 不同浓度镉胁迫小麦幼苗叶片的叶绿素及丙二醛含量
2.3镉胁迫对小麦抗氧化酶活性的影响
植物体内抗氧化保护酶活性的高低是反映植物对逆境适应的重要指标。从图3可知,随着镉胁迫浓度的增大,小麦幼苗叶片的SOD、POD和CAT活性均呈先升后降趋势。在镉浓度为0.5 mmol/L时SOD活性最大,与对照相比增加60.71%,且差异显著。当镉浓度为2.0 mmol/L时,SOD活性最低,比对照降低9.52%,但与对照无显著差异,其原因可能是高浓度镉直接抑制SOD活性,或者对SOD酶基因的转录、翻译过程产生抑制。CAT和POD活性在镉胁迫下的变化规律与SOD类似,均在镉浓度为0.5 mmol/L时达到最大,分别比对照增加154.05%和183.33%,且均与对照差异显著;镉浓度为2.0 mmol/L时,与对照相当。
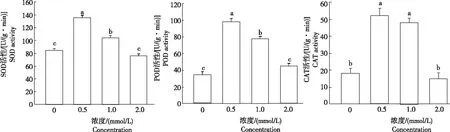
图3 不同浓度镉胁迫小麦的抗氧化酶活性
2.4镉胁迫对小麦幼苗根系及地上部镉含量的影响
从表1可知,随着镉处理浓度的提高,小麦根系和地上部的镉含量显著增加;在同一镉浓度下,小麦根系的镉含量显著高于地上部分。其中,镉浓度0.5 mmol/L、1.0 mmol/L和2.0 mmol/L处理小麦根系的镉含量分别是地上部的16.38倍、12.80倍和8.7倍。
表1不同镉浓度处理小麦根系和地上部的镉含量
Table 1 Cadmium content in aboveground part and root of wheat treated with different cadmium concentrations mg/kg

镉浓度/(mmol/L)cadmium concentration根系Root地上部Aboveground part0.52 998.86±92.21 c183.05±2.24 c1.04 076.46±103.52 b318.59±2.27 b2.04 705.93±13.32 a540.61±2.19 a
注:同列不同小写字母表示差异显著(P<0.05),下同。
Note:Different lowercase letters in the same column indicate significant difference atP<0.05 level.The same below.
2.5镉在小麦幼苗亚细胞组分中的分布
从表2可知,随着镉浓度的升高,小麦根系和地上的细胞壁组分和细胞器组分的镉含量均显著上升,且差异显著;可溶组分均呈先升后降的变化趋势,且差异显著。不同浓度镉处理下,各亚细胞组分吸附镉的比例均呈细胞器>细胞壁>可溶组分;镉浓度为0.5 mmol/L时对小麦已产生了严重伤害。根系累积的速度远远高于地上部的速度,同一镉浓度处理时,地上部亚细胞中的镉含量远低于根系。不同浓度镉处理后,镉在根系细胞器中的分布比例为78.07%~90.15%,在整个细胞亚细胞组分中占绝对优势;在细胞壁中的分布比例为9.81%~21.50%。镉处理后小麦地上部细胞器、细胞壁和可溶组分的镉分配比例分别为50.97%~62.71%、36.93%~48.76%和0.27%~0.87%。镉胁迫下可溶组分的镉含量在根系和地上部的比例含量均低于1%。
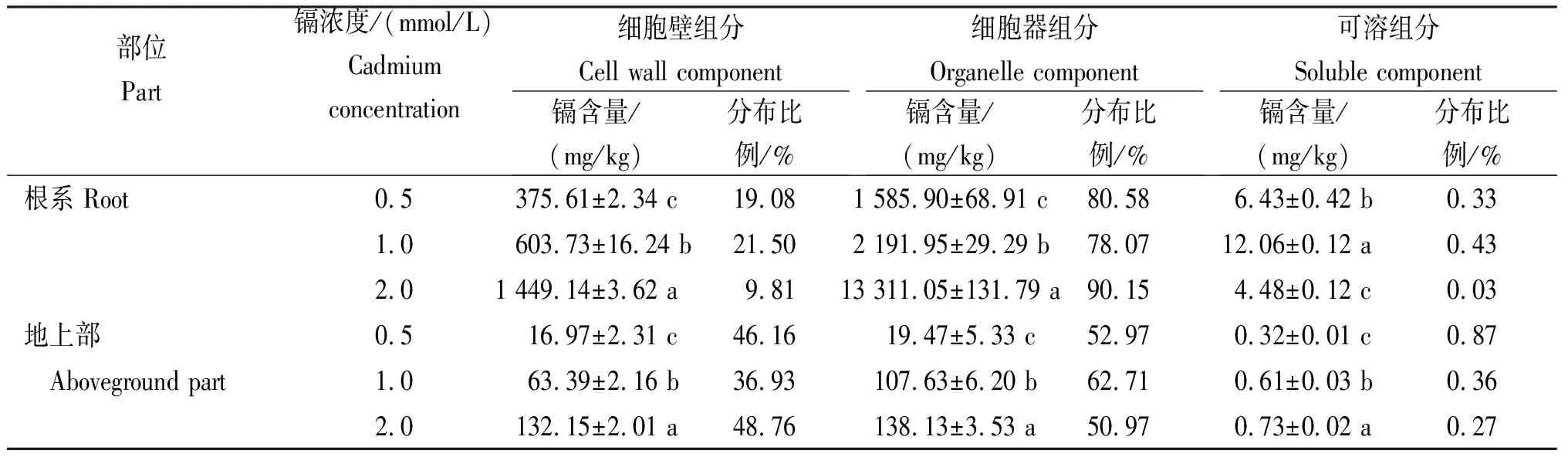
表2 不同浓度镉处理在小麦亚细胞的分布
3结论与讨论
3.1结论
在镉胁迫下,小麦种子发芽率和发芽势明显降低,小麦幼苗的叶绿素含量随着镉胁迫浓度的增加逐渐降低,SOD、POD和CAT等抗氧化酶活性均随着镉浓度的增加呈先升后降趋势,均在镉浓度0.5 mmol/L时达最大。在同一镉浓度下,小麦根系镉含量显著高于地上部;地上部亚细胞中的镉含量远低于根系。小麦地上部和根系大部分的镉分布在细胞壁和细胞器中,而在可溶组分中的分布较少。
3.2讨论
种子萌发是作物生长的关键时期和对外界胁迫最敏感的阶段,种子发芽质量好坏与农作物生长和经济效益之间有着直接的关系,通过观察种子发芽对外源镉的响应,可以更加深入了解镉胁迫对植物的毒害作用[22]。镉是重金属元素,是植物生长过程的非必需元素,但镉胁迫会对种子萌发和幼苗生长产生不同程度的影响。一般来说,种子的发芽势高,其种子的生命力就较强,种子出苗整齐一致,而发芽率则能够反映种子的出苗情况。研究结果表明,镉胁迫处理显著降低小麦种子的发芽势和发芽率,抑制小麦种子的萌发。光合作用是一个高度自我调节的过程,逆境过程可能会导致植株超微结构的改变和功能的破坏,由此光合速率被抑制[23]。研究结果表明,在小麦苗期,随着镉浓度升高,小麦幼苗叶绿素含量降低,光合作用受到抑制,阻碍了小麦的生长和发育。
在逆境胁迫下,通常植物会产生高度反应性的活性氧自由基(ROS),而活性氧积累到一定水平便会诱发膜脂不饱和脂肪酸发生连锁的过氧化反应,使膜结构遭受破坏、细胞功能失常,甚至造成植株死亡。植物可通过抗氧化系统、体内细胞的作用和根部截留等抗性机理来减少重金属的毒害,而抗氧化系统在植物抵抗逆境时至关重要。研究发现,随着镉浓度的增加,MDA含量显著增加,说明在镉胁迫下,小麦幼苗中积累了大量的有害物质,对小麦的细胞膜系统造成了严重损害。此外,小麦的抗氧化酶系统酶活性(SOD、POD和CAT)均随镉胁迫浓度的增加呈先升后降的变化规律,说明小麦具有一定的适应和抵抗镉伤害的能力,但镉浓度较高时,小麦幼苗的细胞发生了严重损伤,其酶活性出现不可逆下降,与何俊瑜等[24-25]研究结果一致。随着镉胁迫浓度的增加,小麦根系和地上部中镉含量显著增加,同一镉浓度处理下,根系中的镉含量高于地上部,该结果与镉在植物体内分布的普遍规律即地下部大于地上部结果一致。镉对植物的危害程度与其在亚细胞中的分布密切相关。研究结果表明,镉胁迫下,小麦根系和地上部中镉主要分布在细胞器和细胞壁中,在可溶组分中较少。与大多数研究结果不一致,其原因可能是不同植物有不同的解毒机制,同时也可能与该研究采用的镉处理浓度有着一定的关系。
