分子动力学模拟研究干燥阿达木单抗的活性保护
2019-10-08林介一李代禧刘宝林
林介一 李代禧 刘宝林

摘 要: 阿达木单抗是一种可与TNF-α特异性结合从而阻断自身免疫炎症反应的蛋白质药物。这种药物在冻干过程中结构不稳定且容易失活,严重影响了药物的疗效。本文用Gromacs分子动力学软件工具包研究蔗糖和海藻糖对阿达木单抗的活性结构稳定效果,揭示了保护剂对阿达木单抗的保护机制,从而为冻干工艺中阿达木单抗的处方设计提供了科学的筛选方法。结果表明,在300K条件下(二次升华温度),不添加保护剂时,阿达木单抗的活性结构会被完全破坏;而在蔗糖和海藻糖存在的情况下,阿达木单抗的热稳定性得到明显提高,并且蔗糖体系和海藻糖体系相比,表现出更好的保护效果,从而更好地抑制了阿达木单抗由于干燥失水而导致的结构塌缩和变性失活。
关键词: 阿达木单克隆抗体;活性结构;分子保护;分子动力学;保护剂
中图分类号: TP319 文献标识码: A DOI:10.3969/j.issn.1003-6970.2019.06.005
本文著录格式:林介一,李代禧,刘宝林,等. 分子动力学模拟研究干燥阿达木单抗的活性保护[J]. 软件,2019,40(6):2126
【Abstract】: Adalimumab is a TNF-inhibiting, anti-inflammatory, biologic medication. It binds to tumor necrosis factor-alpha (TNF-α), which normally binds to TNFα receptors, leading to the inflammatory response of autoimmune diseases. For the purpose to provide rational screen method for developing the freeze-drying formulation, the Gromacs was used to research the stabilization effect of sucrose and trehalose on the adalimumab. The results showed in the follows. The bioactive structure of adalimumab was completely destructed under temperature 300K in the absence of any protectants. The two protectants can obviously stabilize the bioactive structure of adalimumab. And sucrose more effectively inhibit the bioactive structural denature and the collapse of the adalimumab than sucrose during the loss of bound water.
【Key words】: Adalimumab; Bioactive structure; Molecular protection; Molecular dynamics
0 引言
阿达木单抗是一种通过抑制TNF-α治疗免疫疾病(科恩病,强制性脊柱炎,银屑病)的二聚体蛋白质药物[1,2]。目前,商品化的阿达木单抗(humira)是液体注射剂,这种制剂的贮存和运输成本较高[3,4]。然而,冻干工艺可以解决这个问题同时能够赋予蛋白质药物更好的稳定性[5]。
在冻干工艺中,为特定蛋白质设计处方是一项关键工作[6]。Annika等人[7]用菊粉作为口服疫苗的冻干保护剂,相较于溶液配方有效提高了疫苗的稳定性。St?rtzel等人[8]探究了精氨酸/蔗糖保护剂对于蛋白质药物在冻干工艺中的关键温度、药品外观以及稳定性的影响,为蛋白质药物的处方开发提供了经验。传统冻干保护剂的开发方法主要采用基于传统经验的重复试错。而如今让冻干工艺开发更具科学性和逻辑性已成为行业共识和迫切需求。同时,随着我国对知识产权保护的重视,开发个性且高效的药物处方也越来越紧迫。因此,了解蛋白质变性以及其与保护剂相互作用的机理是当今处方开发的必然要求。
随着计算机技术的发展,使分子动力学模拟计算蛋白质分子在干燥状态下的变化机制成为可能。李代禧等人[9]用分子动力学模拟研究了LEA蛋白对胰岛素的保护效果并分析了保护剂机理,说明了LEA蛋白在干燥状态下为胰岛素提供了类似水分子的溶剂环境而有效的保护了药物活性。本文模拟了干燥状态下蔗糖和海藻糖与阿达木单克隆抗体的相互作用及其活性结构变化,从不同角度分析了蔗糖和海藻糖对阿达木单抗的活性保护效果及保护机理,从而为处方开发提供了新的方法以及理论指导。
1 理论与方法
阿达木单抗的初始結构(图1A)取自于蛋白质数据库(ID:3wd5),并通过添加氯离子平衡阿达木单抗所带的净电荷(+5e)。蔗糖和海藻糖分子结构通过Gaussview 5.0构建并使用Gaussian09软件包,采用B3LYP/6-311++G**方法进行结构优化至收敛,优化后的分子结构如图1B所示。
本文使用Gromacs5.0.5工具包[10-12]在恒温恒容(NVT)条件下分别模拟了蔗糖和海藻糖与阿达木单抗在真空环境中的相互作用。在冻干工艺中,最终产品的水分含量约为2%[13]。因此,为了研究的准确性,同样向模拟体系中添加相应含量的水分子。各体系的详细组成如表1所示。阿达木单抗采用Amber99sb-ildn 力场,保护剂分子采用Amber 通用分子力场,水分子模型选择TIP3P模型。分子间Lennard-Jones与范德华相互作用的截断半径选择1.4 nm[14]。静电相互作用修正采用Particle Mesh Ewald方法[15]。
首先,将阿达木单抗初始结构置于10 × 10 × 10 nm的周期性盒子中。然后,在阿达木单抗周围随机定量添加保护剂分子和水分子,并采用最速下降法[16]进行1000步结构优化,再以LINear Constraint Solver (LINCS)[17]方法限制住所有化学键的键长,利用Maxwell分布设置体系各原子的初始速度。所有体系都在300K条件下进行模拟,并采用Velocity- rescale方法控制体系温度,耦合常数选为0.1。系统压力采用Berendsen方法维持在1 atm左右。之后,再将准备好的体系分别进行5 ns NVT 限制性预平衡,使体系中保护剂分子和水分子在阿达木单抗周围均匀分布。最后,将处理好的体系模型在NVT系综下进行100 ns常规分子动力学模拟。对照组以同样方法模拟,取模拟的最后10 ns轨迹进行数据分析[18]。
2 结果与讨论
2.1 不同保护剂对阿达木单抗结构稳定性的影响
均方根偏差[19](Root Mean Square Deviation, RMSD)可以反映特定构想与初始结构的偏离程度,其值越小表明特定构象与初始结构越接近[20]。图2A为不同体系中阿达木单抗的均方根偏差随时间变化的均值(RMSD)。从图2A中可看出,添加了保护剂的阿达木单抗的RMSD值相较于对照组(1.75 nm)有了显著降低,这表明在干燥状态下蔗糖和海藻糖都有效地增强了阿达木单抗活性结构的稳定性。但是,由阿达木单抗在蔗糖和海藻糖保护下的RMSD值分别是0.20 nm和0.22 nm,可以看出,蔗糖比海藻糖保护效果更好。
回旋半径[21](Radius of gyration, Rg)的定义为蛋白质结构中每个粒子与体系质心距离的几何平均值,其值反映了粒子结合的紧密程度,即粒子结合越紧密,Rg越小。图2B为不同体系中阿达木单抗的回旋半径(Rg)随时间变化的均值。从图2B可知,对照组中阿达木单抗的回旋半径是3.38 nm。阿达木单抗在蔗糖和海藻糖保护下的Rg值分别是2.34 nm和2.32 nm。可见,相较于对照组,海藻糖和蔗糖显著抑制了阿达木单抗的Rg值的升高,这表明干燥状态下阿达木单抗的分子形变得到了抑制。另外,相比于天然初始结构,阿达木单抗在蔗糖和海藻糖保护下的Rg值较低,这表明干燥状态下的阿达木单抗会由于水分的流失发生塌缩。但是,由阿达木单抗在蔗糖和海藻糖保护下的Rg值可以看出,蔗糖对蛋白质塌缩抑制更好。
2.2 不同保护剂对阿达木单抗相对自由能的影响
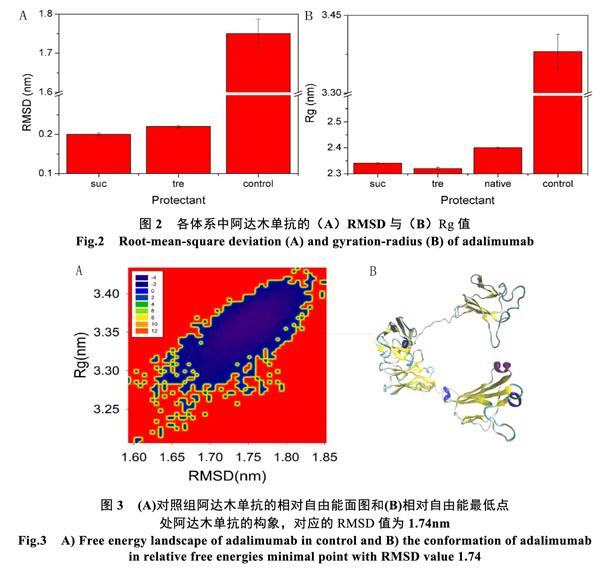
图3分别展示了干燥状态下(参照组)阿达木单抗的相对自由能面图[22](A)及其相对自由能最低点处阿达木单抗的构象(B)。由图3A可见,蓝色区域颜色越深,构象落到该区域概率越大,表明其相对自由能越低,构象越稳定。图3A中局部最小点的相对自由能值为5.04 kT,阿达木单抗在此点的构象如图3B所示。显然与天然态(图1A)相比, 在干燥环境中阿达木单抗构象的二聚体结构发生分离,两条链往相反的方向拉伸,说明了疏水环 境中阿达木单抗无法维持活性结构。疏水作用力作为维持蛋白质结构的主要驱动力[23,24],在极端缺水环境中,疏水作用力失衡造成阿达木单抗的结构的破坏。
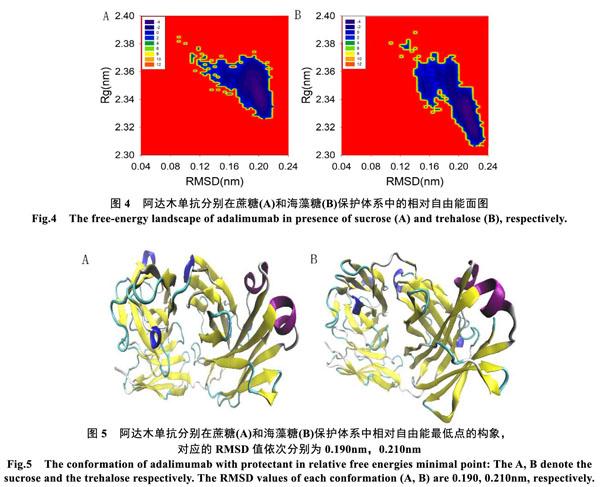
图4和图5分别展示了阿达木单抗分别在蔗糖和海藻糖保护下的相对自由能面图及其相对自由能最低点处阿达木单抗的构象。在蔗糖和海藻糖保护下阿达木单抗的自由能最小值分别为8.48 kT和8.40 kT。与参照组中阿达木单抗的自由能势阱5.04 kT相比,蔗糖和海藻糖均有效地提高了阿达木单抗在疏水环境中的热稳定性。并且在蔗糖和海藻糖保护下的阿达木构象(图5)与天然态(图1A)相比并没有发生明显的变化。这表明蔗糖和海藻糖有效地抑制了干燥状态下阿达木单抗双链的分离,稳定了蛋白质的三维结构。但是从保护效果来看,依然是蔗糖优于海藻糖。
2.3 蔗糖和海藻糖对阿达木单抗亲疏水表面的影响
亲疏水表面积指的是蛋白质的亲水和疏水残基的溶剂可及表面积[25],其值越大则残基在环境中的暴露面积越大。图6A为阿达木单抗的时间平均亲疏水表面积。从图6A中可以看出,与天然态相比,对照组中阿达木单抗的亲水表面积显著降低,与之相反,疏水表面积则发生剧烈的升高,最终导致亲疏水面发生反转。可见干燥后的阿达木单抗分子结构发生了巨大的形变。此外,在蔗糖和海藻糖体系中阿达木单抗的亲水面积均有所降低,但仍高于对照组,而疏水表面积则与天然态相近。这些结果表明,两种保护剂均可以有效抑制阿达木单抗疏水残基的外翻和亲水残基的内卷;但在极端脱水环境中阿达木单抗分子内的亲水相互作用增强,亲水表面积收缩。从亲疏水表面积变化结果总体评价来看,蔗糖比海藻糖能更好地抑制阿达木单抗在干燥状态下活性结构的形變。
2.4 不同保护剂对阿达木单抗二级结构的影响
无规则卷曲、β-折叠和α-螺旋是蛋白质构象主要的二级结构。图6B展示了不同体系中阿达木单抗二级结构在干燥状态下的变化情况。从图6B可知,相较于天然阿达木单抗,对照组中阿达木单抗的无规则卷曲数目有显著的升高,而β-折叠和α-螺旋的数量则发生显著降低。这表明在干燥环境中,阿达木单抗的二级结构大量转变成无规则卷曲,使得蛋白质的活性结构发生了较大的改变。α-螺旋有助于提高蛋白质的热稳定性[26,27],随着干燥环境中阿达木单抗的α-螺旋的解旋,对照组阿达木单抗的热稳定性降低,与3.2节的结果相印证。而添加了蔗糖和海藻糖保护的阿达木单抗二级结构的变化则较小,其中蔗糖体系的阿达木单抗的无规则卷曲、β-折叠以及α-螺旋更接近天然初始状态,因此蔗糖的保护效果最好。
2.5 保护剂与阿达木单抗相互作用分析
蔗糖和海藻糖都有效地維持了阿达木单抗在干燥状态下的活性结构稳定性,但二者的保护效果存在一定的差异。为了探究其原因,我们统计了截断半径0.35nm范围内阿达木单抗与保护剂之间形成的氢键数目以及单抗周围的保护剂数目(图7A)。结果分析可知,相比于海藻糖,蔗糖吸附在阿达木蛋白质表面的分子数目更多,并且也生成了更多的氢键。同时,通过计算聚集在阿达木单抗分子周围保护剂的溶剂可及表面积(图7B),可知蔗糖吸附和保护阿达木单抗的表面积更大。综上说明蔗糖更容易占有阿达木单抗的表面为蛋白质提供更接近水溶剂的氢键环境,从而保护蛋白质结构。
3 结论
本文利用分子动力学模拟研究了干燥状态下蔗糖和海藻糖分别对阿达木单抗活性结构的保护作用。结果表明,阿达木单抗分子因其具有极高柔性在干燥状态下会发生较大的形变导致分子变性失活。本研究中的两种保护剂可以通过氢键作用为干燥状态下的阿达木单抗分子提供类似于水溶液中的氢键环境,保护其蛋白质结构,且与海藻糖相比,蔗糖的干燥活性保护作用更好。本研究认为,相较于传统研究与生产中选择的海藻糖[28],蔗糖更适合作为阿达木单抗的冻干保护剂[29]。
参考文献
[1] Hu S, Liang S, Guo H, et al. Comparison of the Inhibition Mechanisms of Adalimumab and Infliximab in Treating Tumor Necrosis Factor α-Associated Diseases from a Molecular View [J]. Journal of Biological Chemistry, 2013, 288(38): 27059-67.
[2] HUMIRA Injection [package Insert] [J]. North Chicago, IL, USA: AbbVie, 2014,
[3] Schiestl M, Stangler T, Torella C, et al. Acceptable changes in quality attributes of glycosylated biopharmaceuticals [J]. Nature Biotechnology, 2011, 29(4): 310-2.
[4] Frokjaer S, Otzen D E. Protein drug stability: a formulation challenge [J]. Nature Reviews Drug Discovery, 2005, 4(4): 298-306.
[5] Langford A, Bhatnagar B, Walters R, et al. Drying of biopharmaceuticals: Recent developments, new technologies and future direction [J]. Japan Journal of Food Engineering, 2018, 19(1): 15-25.
[6] Costantino H R, Pikal M J. Lyophilization of Bioph-armaceuticals [M]. AAPS press, 2004
[7] Borde A, Ekman A, Larsson A, et al. Preparation and preclinical evaluation of a freeze-dried formulation of a novel combined multivalent whole-cell/B-subunit oral vaccine against enterotoxigenic Escherichia coli diarrhea [J]. European Journal of Pharmaceutics & Biopharmaceutics, 2016, 108(11): 18-24.
[8] St?rtzel P, Gieseler H, Gieseler M, et al. Freeze Drying of l-Arginine/Sucrose-Based Protein Formulations, Part I: Influence of Formulation and Arginine Counter Ion on the Critical Formulation Temperature, Product Performance and Protein Stability [J]. Journal of Pharmaceutical Sciences, 2015, 104(7): 2345-58.
[9] 张燕, 李代禧, 郭柏松, et al. 低温干燥过程中LEA-motif对热敏性药物胰岛素的活性保护研究 [J]. 应用化工, 2014, (8): 1540-3.
[10] Van D S D, Lindahl E, Hess B, et al. GROMACS: fast, flexible, and free [J]. Journal of Computational Chemistry, 2005, 26(16): 1701-16.
[11] 王宏涛, 孙剑伟. 基于BP神经网络和SVM的分类方法研究 [J]. 软件, 2015, 36(11): 96-9.
[12] 陈慧, 陈建华. 基于描述长度和层次聚类的Context模型量化 [J]. 软件, 2015, 36(12): 38-41.
