miR-129-3p靶向Smad3在TGF-β诱导NIH3T3细胞转分化为肌成纤维细胞过程中抑制细胞活力与迁移*
2019-09-23郝洲华卢晓明钟严艳李晓南
郝洲华, 卢晓明, 孟 浦, 钟严艳, 李晓南, 李 盛
(1华中科技大学医院外科, 湖北 武汉 430074; 华中科技大学同济医学院附属协和医院 2消化肿瘤外科, 3全科, 湖北 武汉 430022; 4华中科技大学医院全科, 湖北 武汉 430074)
慢性肾疾病在成人中是一种发病率较高的疾病,糖尿病、炎症和毒性物质等因素均可导致慢性肾疾病的发生,且发病率呈现逐年增加的趋势[1-3]。慢性肾疾病的普遍特征为肾小球硬化和肾间质纤维化[4],其中肾间质纤维化的主要成因是肌成纤维细胞的增殖和激活所造成的细胞外基质的过度产生,这是纤维化时疤痕组织的主要成分[5]。肌成纤维细胞是细胞外基质发生沉积的主要效应分子。在适当刺激诱导下,多种细胞可以转分化为肌成纤维细胞,比如血管周细胞、平滑肌细胞、上皮细胞和成纤维细胞等[6-8]。因此,深入了解肌成纤维细胞的特性,尤其是其形成过程对于理解慢性肾疾病的发生和发展过程是一个十分必须而迫切的事件,也可以为慢性肾疾病的治疗提供可能候选的靶点。
随着对精准医疗认识的不断深入,疾病诊断以及治疗反应性的生物标志物的鉴定显得至关重要[9]。微小RNA(microRNA,miRNA,miR)是一种大约为22 nt的非编码小RNA,主要在转录后水平调控基因的表达[10]。研究表明,miRNAs广泛参与到慢性肾疾病的发生和发展中,比如慢性肾疾病中常伴有miR-21的上调表达[10];miR-148a的异常表达与肾移植后功能失调密切相关[11];miR-328的上调表达可以抑制肾纤维化[12]。
miR-129的转录本有2个,分别为miR-129-1和miR-129-2。经过在5’端和3’端的加工处理后可以形成2个成熟的miRNAs:miR-129-5p和miR-129-3p[13]。最近的研究发现,miR-129-3p可通过促进细胞的侵袭和迁移等过程参与到各种肿瘤的发生过程中,而miR-129-5p却无此效应[13-14],但是miR-129在慢性肾疾病的功能研究资料却相对匮乏。本研究中我们利用转化生长因子β(transforming growth factor-β,TGF-β)诱导成纤维细胞转分化为肌成纤维细胞模型,以评估miR-129在此过程中所扮演的角色和相关分子机制。
材 料 和 方 法
1 肾组织样本获取
取肾癌患者经过手术切除的肾癌组织旁的肾组织(距肾癌浸润边缘2.5 cm);且该组病人在手术前经过正常尿常规检测,其结果均为正常。肾纤维化组织取自于糖尿病引起的肾纤维化患者。每组个体数均为8。
2 细胞和实验试剂
小鼠成纤维细胞系NIH3T3购自中国典型培养物保藏中心。高糖DMEM培养基(12100046)、胎牛血清(fetal bovine serum,FBS;16000-044)和谷氨酰胺(35050-061)购自Gibco;MTT购自武汉博士德;TRIzol® Reagent(15596026)购自Invitrogen;dNTP Mix(D7295)购自Sigma-Aldrich;反应缓冲液和逆转录酶(EP0041)、M-PER哺乳动物蛋白提取液试剂盒(78503)和Lipofectamine 3000(L3000001)购自Thermo Fisher Scientific;SuperReal PreMix试剂盒(FP202-01)购自北京天根生化公司;miR-129-3p和miR-129-5p的引物均购自广州市锐博生物科技有限公司;抗Ki-67(ab15580)和Smad3(ab40854)抗体购自Abcam;抗α-tubulin(AP0064)抗体购自Bioworld;双萤光素酶报告基因实验试剂盒(E1910)购自Promega。
3 实验方法
3.1细胞培养 NIH3T3细胞培养于含10% FBS和2 mmol/L谷氨酰胺的高糖DMEM培养基中。培养环境的温度为37 ℃, CO2含量为5%,相对湿度为95%。
3.2MTT法检测miR-129-3p对NIH3T3细胞活力的影响 当细胞处于对数生长期时,以每孔4 000个细胞的密度接种于96孔板中。细胞静置贴壁后给予刺激,刺激结束后在每孔中加入10 μL浓度为5 g/L的溶液(PBS缓冲液为溶剂),避光孵育4 h后,彻底去除上清,每孔加入100 μL DMSO溶液以充分溶解紫色甲臜结晶。利用多功能酶标仪在570 nm处检测各孔吸光度(A)值。
3.3划痕实验检测miR-129-3p对NIH3T3细胞迁移能力的影响 细胞接种于6孔培养板中,给予相应处理后使用200 μL移液枪枪头直接在中部划直线,并做好标记以确定相对位置。在细胞培养48 h后,在显微镜(Nikon, CKX53)下直接观察细胞重新覆盖空白区域的范围以评估其迁移能力。
3.4RT-qPCR法检测miR-129-3p和miR-129-5p的表达 按照TRIzol®试剂说明书提取组织或者细胞中总RNA。使用DEPC处理过的ddH2O将上述RNA溶解,测定浓度后以1 μg总RNA 20 μL体系进行逆转录反应。具体为将总RNA、Oligo dT和DEPC水共13 μL充分混合均匀,在65 ℃反应5 min。之后分别加入dNTP Mix、反应缓冲液和逆转录酶共7 μL,再次混匀,42 ℃反应60 min后在70 ℃反应10 min以终止反应。使用此过程获得的cDNA,按照SuperReal PreMix试剂盒说明书进行实时定量PCR以检测相应基因的mRNA表达水平。miR-129-5p的正向引物序列为5′-GGATGGCTGCTGTCTCCTT-3′,反向引物序列为5′-GGGCTTCCTGACTACTGTTGA-3′; miR-129-3p的正向引物序列为5′-AGGGTTCGGAGACATCCTG-3′,反向引物序列为5′-GGCTTCCGGCTATTGAGTTA-3′;U6 的正向引物序列为5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物序列为 5′-CGCTTCACGAATTTGCGTGTCAT-3′。反应程序参数为95 ℃预变性10 min后,进入以下循环:95 ℃反应10 s、62 ℃反应30 s、72 ℃反应10 s;经历40次循环后缓慢升温至95 ℃。反应结束后,按照2-ΔΔCt法计算各个基因相对表达量。
3.5Western blot法检测Ki-67和Smad3的蛋白表达水平 细胞接种于6孔培养板中,给予相应处理后按照M-PER哺乳动物蛋白提取液试剂盒说明书提取细胞总蛋白质。利用BCA法将各组样品定量至相同浓度后,分别取15 μg蛋白质进行SDS-PAGE。之后利用湿转法将蛋白质转移至PVDF膜,室温以5%脱脂奶粉封闭1 h后,加入相应 I 抗4 ℃条件下封闭过夜。次日洗涤后室温孵育相应 II 抗1 h,之后利用化学发光成像法进行成像。
3.6瞬时转染法检测miR-129-3p的功能 NIH3T3细胞接种于6孔培养板中,细胞贴壁后以转染试剂Lipofectamine RNAiMAX转染miR-129-3p的模拟物或者抑制剂片段。按照说明书进行操作,在细胞中加入miR-129-3p 模拟物或者抑制剂片段与Lipofectamine RNAiMAX的混合物后,6~8 h后更换为新鲜培养基进行培养。后续给予相应刺激以验证miR-129-3p的功能。
3.7双萤光素酶报告基因实验验证miR-129-3p靶基因Smad3将Smad3基因3’-UTR中与miR-129-3p结合的部位克隆至pGL3质粒,或将其结合位点进行突变后再克隆至pGL3质粒;上述操作将获得pGL3-Smad3野生型或者突变型载体。NIH3T3细胞接种于24孔板中贴壁后以Lipofectamine 3000共转染pGL3-Smad3各种质粒载体和miR-129-3p模拟物质粒。共同培养48 h后,根据试剂盒说明书操作以检测相应萤光素酶活性。
4 统计学处理
各项实验均进行独立重复3次或者以上,利用Graphpad Prism软件进行数据分析和统计。实验数据符合方差齐,用均数±标准差(mean±SD)表示。2组实验比较采用成组t检验,多组定量数据之间俩俩比较的差单因素方差分析。以P<0.05为差异具有统计学意义。
结 果
1 miR-129-3p在肾纤维化患者肾组织样本中的表达显著下调
RT-qPCR结果显示, miR-129-3p在肾纤维化患者肾组织中的表达量下降至肾癌旁组织对照组的38%,差异具有统计学意义(P<0.01),见图1A。而与肾癌旁组织相比,miR-129-5p在肾纤维化患者肾组织样本中的相对表达量,差异无统计学显著性,见图1B。进一步分析发现,肾癌旁组织对照组的miR-129-5p与miR-129-3p的表达量具有正相关性(r=0.598),肾纤维化组织miR-129-5p与miR-129-3p的表达量具有负相关性(r=-0.310)。
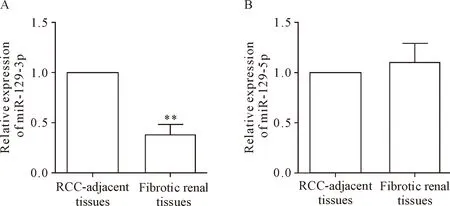
Figure 1.miR-129-3p (A), but not miR-129-5p (B), was down-regulated in the renal tissues from the patients with diabetic nephrofibrosis. RT-qPCR was used to detect the relative expression levels of miR-129-3p and miR-129-5p in the renal tissues from the renal cell carcinoma (RCC)-adjacent tissues of control subjects and the patients with diabetic nephrofibrosis. Mean±SD.n=8.**P<0.01vsRCC-adjacent tissues.
图1 肾纤维化患者肾组织中miR-129-3p表达量显著下调
2 miR-129-3p在肌成纤维细胞中表达下调
为了探讨miR-129-3p的下调在肾纤维化过程中的意义,根据文献[4]我们在NIH3T3细胞中给予10 μg/L TGF-β1诱导成纤维细胞NIH3T3 48 h后使其转变为肌成纤维细胞。接下来,我们采用RT-qPCR方法对miR-129-3p和miR-129-5p的表达分别进行检测,结果显示TGF-β1处理48 h后,miR-129-3p的表达水平呈现下降趋势(P<0.01),见图2A;与在肾纤维化组织样本中的检测结果类似,miR-129-5p的表达也没有明显改变,见图2B。
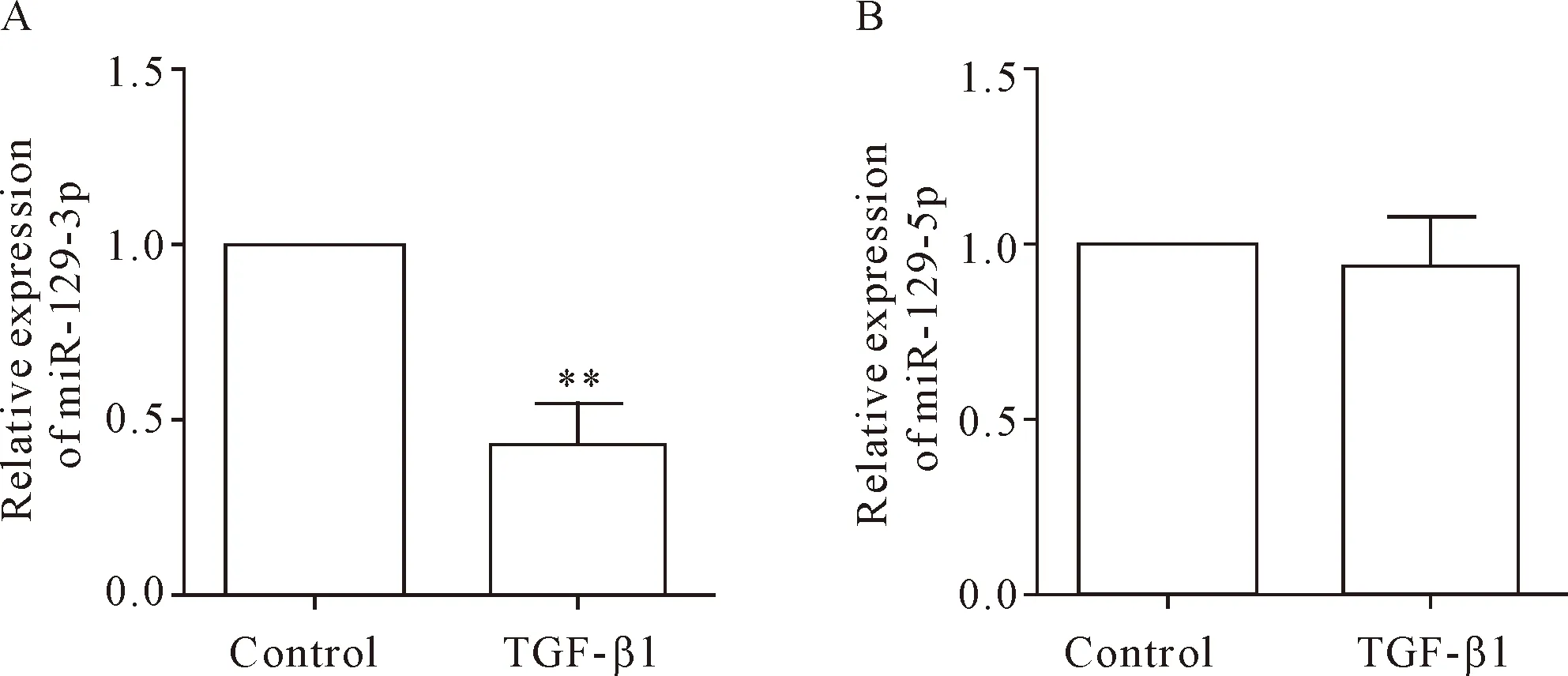
Figure 2.miR-129-3p (A), but not miR-129-5p (B), was down-regulated in the NIH3T3 cells treated with TGF-β1 at 10 μg/L for 48 h. The relative expression of miR-129-3p and miR-129-5p was detected by RT-qPCR. Mean±SD.n=3.**P<0.01vscontrol group.
图2 TGF-β1处理的NIH3T3 细胞中存在miR-129-3p的表达下调
3 上调miR-129-3p的表达在TGF-β诱导NIH3T3细胞转分化为肌成纤维细胞过程中抑制细胞活力
为了探讨miR-129-3p的表达是否与肾纤维化直接相关,我们在NIH3T3细胞给予TGF-β1诱导的同时给予miR-129-3p模拟物(使miR-129-3p水平升高,见图3A)以观察其对TGF-β诱导NIH3T3细胞转分化为肌成纤维细胞过程中细胞活力的影响。MTT结果显示,在给予miR-129-3p模拟物之后,不管是否存在TGF-β刺激,细胞活力均有所下降(P<0.05),见图3B。由于在各处理组中并没有观察到明显的细胞死亡现象,于是我们推测miR-129-3p模拟物对NIH3T3细胞活力的抑制作用可能与其抑制细胞增殖有关。为了验证以上设想,我们对Ki-67的表达进行了检测。与上述MTT结果一致,给予miR-129-3p模拟物后,不管是否存在TGF-β1刺激,Ki-67的表达均明显减少,见图3C。以上结果说明在肾纤维化过程中,上调miR-129-3p表达在TGF-β诱导NIH3T3细胞转分为肌成纤维细胞过程中可抑制细胞活力。
4 上调miR-129-3p表达在TGF-β诱导NIH3T3细胞转分化为肌成纤维细胞过程中抑制细胞迁移
划痕实验结果显示,给予miR-129-3p的模拟物之后,细胞的迁移行为被明显抑制。单独给予miR-129-3p模拟物可以使得NIH3T3细胞的迁移能力下降;而NIH3T3细胞被TGF-β1诱导后,其迁移能力受到抑制,miR-129-3p模拟物和TGF-β1同时存在时则被进一步抑制,见图4。
5 miR-129-3p负调控靶基因Smad3表达
利用在线生物信息学软件TargetScan对miR-129-3p的靶点进行了预测。由于TGF-β/Smad3信号通路在成纤维细胞转化为肌纤维细胞过程中发挥着重要作用[15-16],于是我们推测miR-129-3p可以作用于Smad3从而参与肌成纤维细胞的增殖和迁移。如图5A所示,miR-129-3p与Smad3的3′-UTR存在结合位点。图5B显示,双萤光素酶报告基因实验确定Smad3为miR-129-3p的直接作用靶点:在共同转染pGL3-Smad3质粒与miR-129-3p前体质粒时,萤光素酶活性显著下降;而在共同转染Smad3 3′-UTR突变质粒与miR-129-3p前体质粒时,萤光素酶活性与对照组的差异无统计学显著性。最后,我们在NIH3T3细胞中分别瞬时转染miR-129-3p的模拟物和抑制剂,并对Smad3的蛋白质表达水平进行了检测,发现miR-129-3p的抑制剂可以增加Smad3的表达水平(P<0.01);而miR-129-3p的模拟物可使得Smad3的表达水平下降,见图5C~E。
接下来我们直接验证了miR-129-3p是否可以通过靶向Smad3抑制TGF-β诱导的肌成纤维细胞的生长和迁移能力。首先,NIH3T3细胞中,在TGF-β1的刺激下,给予scrambled miRNA、miR-129-3p抑制剂或miR-129-3p抑制剂+Smad3干扰片段,结果显示,在给予miR-129-3p抑制剂之后,不管是细胞增殖标志物Ki-67的表达水平还是划痕实验所示的细胞迁移能力均有所增加;而在同时给予Smad3的干扰片段可以明显取消miR-129-3p抑制剂的效应,见图6。
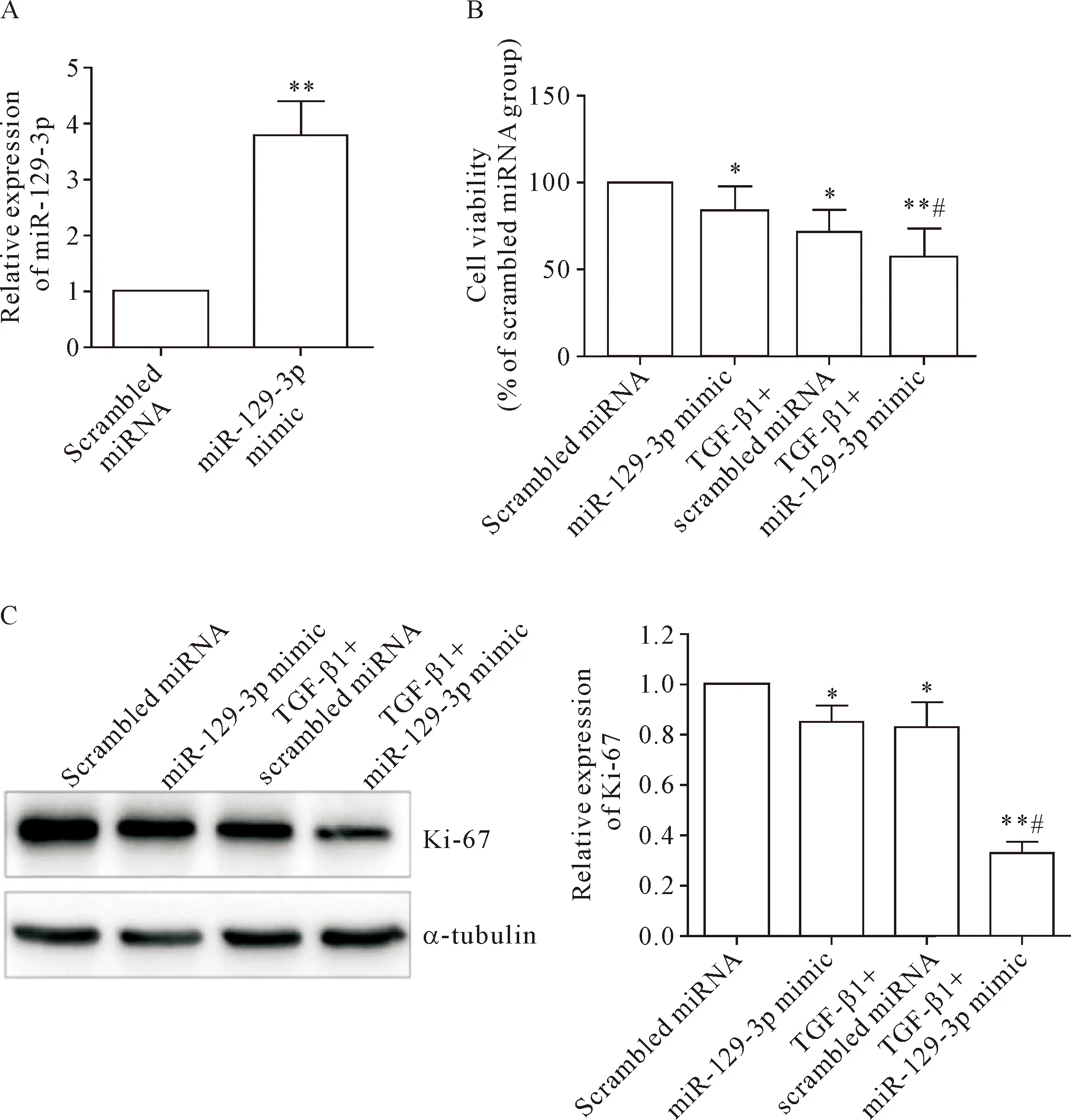
Figure 3.Up-regulation of miR-129-3p inhibited the viability of NIH3T3 cells during TGF-β-induced transformation into myofibroblasts. A: the over-expression efficacy of miR-129-3p mimic; B: MTT assay showing the decreased viability of TGF-β1-stimulated NIH3T3 cells after co-incubation with miR-129-3p mimic; C: Western blot for determining the protein expression of Ki-67 in the NIH3T3 cells after TGF-β1 treatment with or without transfection with miR-129-3p mimic. Mean±SD.n=3.*P<0.05,**P<0.01vsscrambled miRNA group;#P<0.05vsTGF-β1+scrambled miRNA group.
图3 上调miR-129-3p在TGF-β诱导NIH3T3细胞转分化为肌成纤维细胞过程中抑制细胞活力

Figure 4.Up-regulation of miR-129-3p inhibited NIH3T3 cell migration during TGF-β-induced transformation of into myofibroblasts. Mean±SD.n=3.*P<0.05,**P<0.01vsscrambled miRNA group;#P<0.05vsTGF-β1+scrambled miRNA group.
图4 上调miR-129-3p表达在TGF-β诱导NIH3T3细胞转分化为肌成纤维细胞过程中抑制细胞迁移
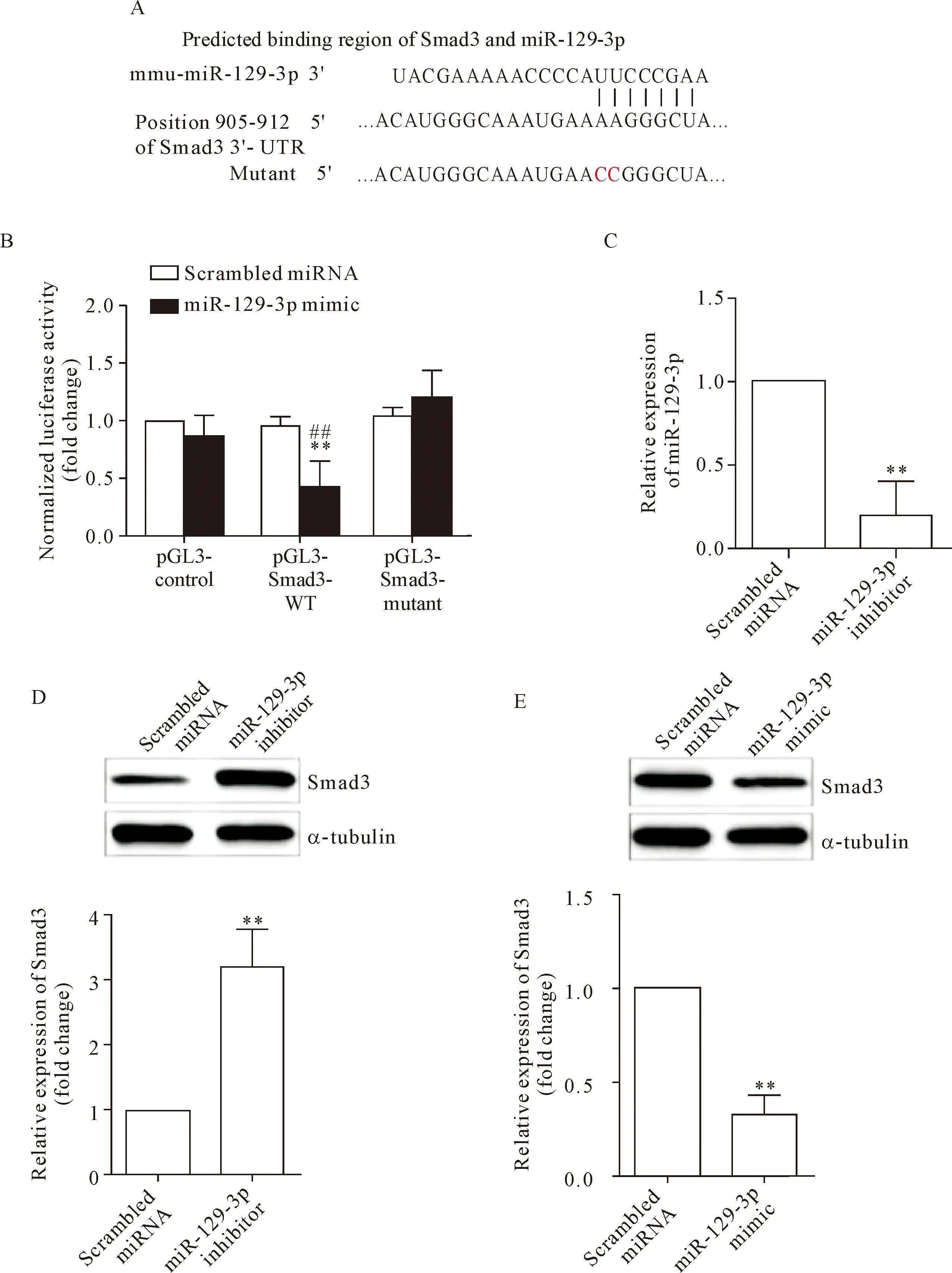
Figure 5.miR-129-3p directly targeted 3’-UTR of Smad3 and negatively regulated its expression. A: TargetScan software predicting binding sites between Smad3 3’-UTR and miR-129-3p; B: dual-luciferase reporter assay showing the relative luciferase activity of Smad3-WT and Smad3-mutant; C: knock-down efficacy of miR-129-3p inhibitor; D and E: miR-129-3p inhibitor increased the expression of Smad3 at protein level, whereas miR-129-3p mimic had the opposite effect. Mean±SD.n=3.**P<0.01vsscrambled miRNA group;##P<0.01vspGL3-control group.
图5 miR-129-3p直接靶向于Smad3 3’UTR并负性调控其表达
讨 论
在本研究中,我们发现在肾纤维化患者肾组织样本以及成纤维细胞NIH3T3转分化为肌成纤维细胞的过程中,miR-129-3p均呈现下调表达的趋势;在给予miR-129-3p的模拟物之后可以显著抑制(肌)成纤维细胞的活力和迁移行为。因此,我们的数据提示,在慢性肾疾病的病理进程中,miR-129-3p的下

Figure 6.miR-129-3p inhibited the growth and migration of myofibroblasts by directly targeting Smad3. miR-129-3p inhibitor promoted the protein expression of Ki-67 (A) and migration ability (B), which was reversed by knock-down ofSmad3expression. Mean±SD.n=4.*P<0.05,**P<0.01vsTGF-β1+scrambled miRNA group;#P<0.05vsTGF-β1+miR-129-3p inhibitor group.
图6 miR-129-3p通过靶向Smad3抑制TGF-β诱导的肌成纤维细胞的生长和迁移
调表达与肾纤维化的发生和发展相关。本研究为慢性肾疾病的分子病理机制提供了新的解释,同时也为其治疗提供了可能候选靶点。
miR-129转录本的另一成熟体miR-129-5p尽管是其主要产生形式[14],但在本研究模型中我们并没有发现其表达有显著改变,且在各组样本中miR-129-5p的相对表达量均高于miR-129-3p。除此之外,我们的数据也显示在肾癌旁正常肾组织中,miR-129-5p与miR-129-3p表达量的相关性(r=0.598)强于肾纤维化组织(r=-0.310)中,这提示我们除了miR-129-3p的下调参与到了慢性肾疾病的病理进程中,miR-129-5p与miR-129-3p的表达比例失调可能也是其中一个因素。
TGF-β在纤维化疾病[17]以及在细胞活力过程[18]中扮演至关重要的角色。我们的数据显示miR-129-3p可通过抑制TGF-β下游信号分子Smad3的表达调控细胞的活力和迁移行为。同时,在给予TGF-β刺激后,miR-129-3p对细胞增殖和迁移行为的抑制进一步加剧。最近研究表明miR-129-3p与miR-129-5p都可以通过调控细胞周期进而起到抑制细胞生长作用[19]。我们推测,miR-129-3p也可能通过调控TGF-β信号通路从而发挥抑制细胞活力和迁移的效应。
综上所述,我们的研究表明miR-129-3p的下调表达是慢性肾疾病病理进程中的一个重要事件,这为理解慢性肾疾病的分子机制提供了新途径,也为其干预治疗提供了可能靶点。
