P[9]轮状病毒受体结合特征及其人群抗体水平与HBGA相关性研究
2019-09-20侯玉珍郭伦爱陈俊锐张绪富戴迎春
侯玉珍,龙 艳,郭伦爱,陈俊锐,张绪富,戴迎春
轮状病毒(rotaviruses,RV)是引起婴幼儿和所有年龄人群病毒性胃肠炎的主要病原体,2016年引起全球大约13万例婴幼儿死亡和各年龄人群23万例死亡[1]。RV属于呼肠病毒科RV属,其基因组由11个双链RNA节段组成,分别编码6种结构蛋白(VP1-VP4,VP6,VP7)和6种非结构蛋白(NSP1-NSP6)。糖蛋白VP7和刺突蛋白VP4构成RV外衣壳,VP4蛋白经胰蛋白酶切割后裂解形成VP5*和VP8*两个蛋白,其中VP8*蛋白主要参与受体识别,介导病毒作用宿主细胞[2]。基于VP4序列,A组RV分为P [1]-P[40]40种基因型,基于VP8*序列,RV分为P[I]-P[V] 5个基因组[3-4]。 P[I]、P[IV]、P[V]主要感染动物,P[II]只感染人,P[III]既能感染人,也能感染动物。P[1]、 P[2]、P[3]和P[7]属于P[I]基因组,人群中广泛流行的P[4]、P[6]和P[8]属于P[II]基因组,P[9]、P[14]和P[25]属于P[III]基因组。
研究发现RV VP8*可以识别HBGA作为其感染受体或配体[2,5]。HBGA具有丰富的多态性,包括ABO、分泌型和Lewis三个基因家族,在世界人群中广泛分布[6]。不同P型的RV与HBGA的结合具有型别特异性,不同人群对各型RV易感性也存在差异[7]。因而,研究RV与HBGA的相互作用对于阐明RV的感染机制及宿主范围具有重要意义。
2009-2014年间P[9]RV在我国成都、武汉和济南等地被检出[8-10]。P[9]RV属于P[III]基因组,既能感染人也能感染犬和猫[11],具有在人和动物中跨物种传播的潜在可能。本研究表达和纯化了P[9]RV VP8*蛋白,对其与HBGA的结合特征进行了研究,同时,检测广东汕尾地区人群P[9]RV抗体水平,分析P[9]RV抗体与HBGA的相关性,为RV感染机制的研究及疾病防控提供一定的基础。
1 材料与方法
1.1 材料
1.1.1样本采集 于2015年1月24-27日采集广东省汕尾市3~88岁(平均年龄51.2岁)一般人群配对的唾液和血清样本206份;266份唾液样本源于南方医院并已确定HBGA表型,为本实验室保存[12],随机选取45份用于本研究HBGA结合试验。
1.1.2试剂 感受态细胞TOP10和BL21购于天根生化科技有限公司,质粒提取试剂盒,琼脂糖切胶回收试剂盒,T4连接酶,BamHI和SalI内切酶购自美国thermo fisher scientific公司,GST-Resin购自上海七海富泰生物科技有限公司,凝血酶购自英国GE公司,LB肉汤、LB琼脂购自北京路桥,氨苄青霉素、IPTG购自sigma, HRP-羊抗人IgG购自美国Abcam,表达载体pGEX-4T-1和兔抗VP8*血清为本实验室保存。
1.2 方法
1.2.1P[9]RV VP8*基因序列合成 P[9]RV VP8*基因序列参照GenBank公布的AB077766基因序列,序列范围位于10-702位点共693个碱基,在VP8*基因序列的上、下游分别加入BamH I和SalI酶切位点,序列由华大基因合成。
1.2.2pGEX-4T-1-VP8*重组表达载体的构建 将华大基因提供的含有质粒pUC57-VP8*的穿刺菌涂于含氨苄青霉素(100 mg/mL)的营养琼脂平板,根据thermo fisher scientific提质粒试剂盒说明书提取质粒后进行BamH I和SalI双酶切,切胶纯化VP8*基因片段与经BamHI和SalI双酶切的pGEX-4T-1表达载体连接,连接产物转化至感受态细胞TOP10,pGEX-4T-1-VP8*重组质粒经双酶切鉴定。
1.2.3重组pGEX-4T-1-VP8*蛋白的诱导表达与纯化 将鉴定正确的重组质粒转化到感受态细胞BL21,挑取单个菌落接种于4个5 mL含有氨苄青霉素(100 mg/mL)的LB液体培养基中,37 ℃,200 r/min震荡培养12~16 h,将培养物以1∶100的稀释度接种于新鲜LB液体培养基中,37 ℃震荡培养3.5 h至OD600为0.4~0.6,加入IPTG至终浓度为0.4 mmol/L。继续22 ℃ 220 r/min震荡培养12~16 h。于4 ℃,5 000 r/min离心菌液12 min,弃上清,收集菌体,用80 mL PBS充分重悬菌体,并将菌液于冰浴中对其进行超声破碎,于4 ℃,12 000 r/min离心75 min。利用GST-resin对GST融合蛋白进行纯化获得GST-VP8*,或者用凝血酶除去融合蛋白的GST标签蛋白,纯化获得VP8*进行SDS-PAGE电泳检测。
1.2.4VP8*蛋白的Western blot鉴定分析 取10 μLVP8*蛋白进行SDS-PAGE凝胶电泳,转印至硝酸纤维素膜,依次用5% BSA封闭、兔抗VP8*血清(1∶1 000)、HRP-羊抗兔IgG(1∶3 000)孵育、PBST充分洗涤,最后HRP-DAB底物显色。
1.2.5各型唾液HBGA受体与GST-VP8*蛋白结合的梯度试验 应用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测[12],在南方医院采集的唾液样本中随机选取各型HBGA(分泌型A、B、O和非分泌型N)各两份,将唾液用PBS缓冲液按终浓度1∶1 000稀释后每孔100 μL包被于96孔酶标板上,4 ℃过夜;0.05%PBST洗板5次,每孔加入5%脱脂奶粉-PBS 200 μL于37 ℃封闭1 h;0.05%PBST洗板5次,将P[9]RV GST-VP8*蛋白经1%脱脂奶粉-PBS3倍梯度稀释(15 μg/mL,5 μg/mL和1.7 μg/mL)后,加入到相应的孔中,37 ℃孵育1 h;0.05%PBST洗板5次,每孔加入兔抗VP8*血清(1∶3 000)100 μL,37 ℃反应1 h;0.05%PBST洗板5次,每孔加入HRP-羊抗兔IgG(1∶3 000)100 μL,37 ℃反应1 h;0.05%PBST洗板5次,使用TMB避光显色10 min后每孔加入100 μL 2 mol/L磷酸终止反应,测定波长为450 nm的吸光值,阳性信号的截断值为背景/空白孔的平均值加三倍标准差约为OD450=0.2。
1.2.6唾液样本与P[9]RV结合试验 将45份在南方医院采集的唾液样本(HBGA分型A型21份,B型8份,O型8份,N型8份)用PBS缓冲液按终浓度1∶1 000稀释后每孔100 μL包被于96孔酶标板,4 ℃过夜;0.05%PBST洗板1次,每孔加入5%脱脂奶粉-PBS 200 μL于37 ℃封闭1 h;0.05%PBST洗板1次,每孔加入1%脱脂奶粉-PBS稀释的GST-VP8*蛋白(10 μg/mL)100 μL,37 ℃孵育1 h;0.05% PBST洗板5次,每孔加入兔抗VP8*血清(1∶3 000)100 μL,37 ℃反应1 h;0.05%PBST洗板5次,每孔加入HRP-羊抗兔IgG(1∶3 000)100 μL,37 ℃反应1 h;0.05%PBST洗板5次,使用TMB避光显色10 min后每孔加入100 μL 2 mol/L磷酸终止反应,测定波长为450 nm的吸光值。
1.2.7血清中P[9]RV特异性IgG的检测 206份血清样本取自广东省汕尾市的一般人群。利用P[9]RV VP8*蛋白作为捕获抗原,采用ELISA检测血清样本中P[9]RV特异性IgG抗体。用PBS缓冲液稀释VP8*蛋白至0.5 μg/mL每孔100 μL包被于96孔酶标板上,4 ℃过夜;0.05%PBST洗板1次,每孔加入5%脱脂奶粉-PBS 200 μL于37℃封闭1 h;0.05%PBST洗板1次,每孔加入1%脱脂奶粉-PBS两倍梯度稀释的血清样本,37 ℃孵育1 h;0.05%PBST洗板1次,每孔加入用1%脱脂奶粉-PBS稀释的HRP-羊抗人IgG(1∶3 000),37 ℃反应1 h;0.05%PBST洗板5次,使用TMB避光显色10 min后每孔加入100 μL 2 mol/L磷酸终止反应,测定波长为450 nm的吸光值。
1.2.8唾液HBGA表型鉴定 206份唾液样本取自广东省汕尾市的一般人群。唾液HBGA表型检测包括ABO、Lewis以及分泌型,采用ELISA方法检测。将煮沸的唾液用PBS缓冲液1∶1 000稀释后每孔100 μL包被于96孔酶标板上4 ℃过夜;0.05%PBST洗板1次,每孔加入5%脱脂奶-PBS 200 μL于37 ℃封闭1 h;0.05%PBST洗板1次,将单克隆抗体包括A、B、H、Lewis b、Lewis x和Lewis y经1%脱脂奶粉-PBS 1∶300稀释后,加入到相应的孔中,37 ℃孵育1 h;Lewis a 4 ℃过夜;0.05%PBST洗板5次;其中Lewis a相对应的二抗为HRP-羊抗鼠IgG(1∶300);余为HRP-羊抗鼠IgM(1∶300),37 ℃,反应1 h;0.05%PBST洗板5次,使用TMB显色10 min后每孔加入100 μL 2 mol/L磷酸终止反应,测定波长为450 nm的吸光值。
1.2.9统计分析 采用SPSS 23.0统计软件进行统计分析。抗体阳性和阴性两组HBGA表型比较采用χ2检验,不满足χ2检验条件时,采用Fisher确切概率法检验,检验水准α=0.05。
2 结 果
2.1pGEX-4T-1-VP8*表达载体的构建 pGEX-4T-1-VP8*重组质粒经BamH I与SalI双酶切鉴定,获得大小约5 kb的pGEX-4T-1载体和700 bp的VP8*片段(图1),表明成功构建pGEX-4T-1-VP8*表达质粒。

M:DNA分子量标准;1:pGEX-4T-1-VP8*双酶切产物图1 pGEX-4T-1-VP8*重组质粒BamHI与Sal I双酶切鉴定Fig.1 Production of pGEX-4T-1-VP8* plasmid digested by BamH I and Sal I
2.2P[9]RVVP8*蛋白的表达与纯化 通过原核表达系统,得到可溶形式的P[9]RV VP8*蛋白,SDS-PAGE电泳结果显示:融合蛋白大小约为52 kD条带,经凝血酶去除GST标签蛋白后获得约为28 kD 的目的蛋白,与预期VP8*蛋白大小一致(图2)。为了进一步验证原核表达系统表达VP8*蛋白的特异性,将SDS-PAGE凝胶分离的目的蛋白转印到PVDF膜上,经特异性抗体进行Western blot分析,在大小为52 kD和28 kD位置显示条带,证明了研究所用的原核表达系统BL21(DE3)表达的VP8*蛋白具有特异性(图3)。
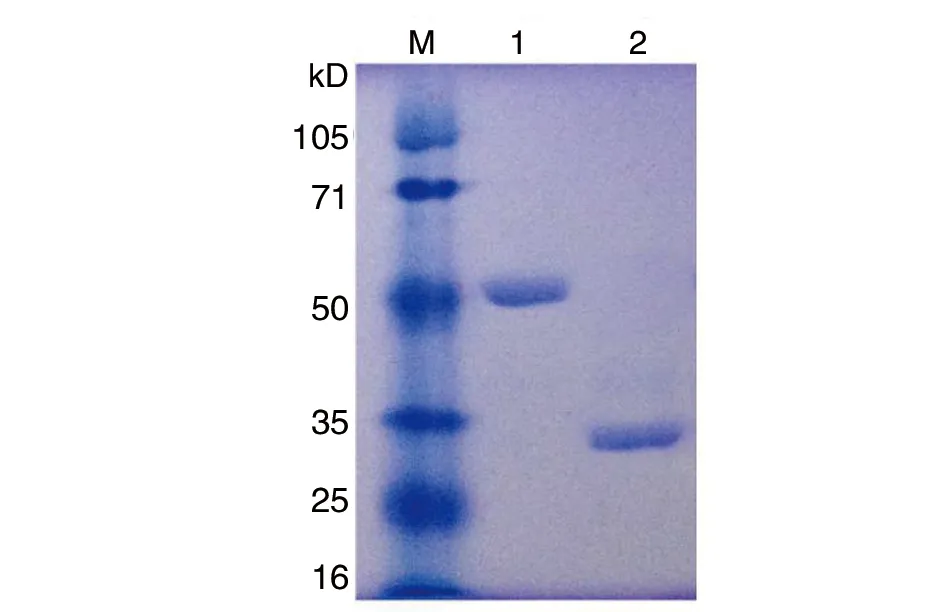
M:蛋白质分子量标准;1:纯化的GST-VP8*蛋白;2:凝血酶切后VP8*蛋白图2 纯化GST-VP8*蛋白的SDS-PAGE检测Fig.2 Production of the GST-VP8* fusion protein

M:蛋白质分子量标准;1:纯化的GST-VP8*蛋白;2:凝血酶切后VP8*蛋白图3 纯化P[9]VP8*蛋白Western blot印迹分析Fig.3 Western blot analysis of the P[9]VP8* protein
2.3P[9]RV GST-VP8*蛋白与唾液HBGA受体 结合P[9]RVGST-VP8*蛋白与唾液HBGA受体的结合情况如图4所示。GST-VP8*蛋白与A型分泌型HBGA受体结合,且呈梯度反应关系,与B、O型和非分泌型不结合。进一步以中国人群唾液样本验证P[9]RV与HBGA受体结合特征,随机抽取45份唾液样本用于本研究验证,根据梯度实验结果,为保证OD值的有效性及背景值的可参考性,我们把后续实验中GST-VP8*蛋白与唾液HBGA受体结合实验的浓度定为10 μg/mL。结果如图5所示:GST-VP8*蛋白与A型分泌型HBGA受体结合,与B、O型和非分泌型不结合。各型OD均值分别为A=0.751,B=0.135,O=0.130,N=0.160。

注:1×,3×,9×表示三倍梯度稀释的GST-VP8*蛋白浓度分别为15 μg/mL,5 μg /mL和1.7 μg/mL图4 P[9]RV与唾液HBGA受体结合梯度图Fig.4 Binding activity of P[9]RV to HBGA receptor

图5 P[9]RV与唾液样本结合方式Fig.5 Binding activity of P[9]RV to saliva sample
2.4血清P[9]RV IgG抗体与唾液HBGA表型的关系 采集广东省汕尾市206名一般人群配对的血清和唾液样本,检测血清P[9]RV特异性IgG抗体滴度和唾液HBGA表型。206份血清样本中P[9]RV特异性IgG检出率为13.6%(28/206)。血清P[9]RV特异性IgG与HBGA表型有关。与P[9]RV特异性IgG阴性的个体相比,A型HBGA受体在P[9]RV特异性IgG阳性的个体中所占的比例明显较高(P=0.001),分泌型受体在P[9]RV特异性IgG阳性的个体中所占的比例明显较高(P=0.017);相反,Lea+/Lex+在P[9]RV特异性IgG阳性的个体中所占的比例明显较低(P=0.014)。
表1 P[9]RV IgG抗体与唾液HBGA表型的关系
Tab.1 Association between P[9]RV IgG and the phenotypes of HBGA

分型P[9]RV抗体阳性 (%)P[9]RV抗体阴性(%)P血型28178A15(53.6)32(18.0)B6(21.4)37(20.8)0.001O6(21.4)104(58.4)AB1(3.6)5(2.8)Lewis分型28178Leb+/Ley+27(96.4)129(72.5)Lea+/Lex+0(0)28(15.7)0.014Lea+b+/Lex+y+1(3.6)21(11.8)分泌状态28178分泌型28(100)150(84.3)0.017非分泌性0(0)28(15.7)
注:Leb+/Ley+和Lea+b+/Lex+y+属于分泌型,Lea+/Lex+属于非分泌型。
3 讨 论
VP8*是RV表面刺突蛋白VP4的远端,主要参与受体识别,介导病毒识别宿主细胞,研究表明,重组VP8*蛋白可以识别HBGA受体,提示VP8*蛋白可成为研究RV-HBGA相互作用的理想模型[13]。本研究以P[9]RV为对象,表达纯化了VP8*蛋白,通过唾液HBGA结合鉴定,发现P[9]RV特异性地与A型HBGA结合。国外有研究使用当地RV融合VP8*蛋白,采用血凝结合试验得出P[III]RV与A型分泌型HBGA受体结合的模式[13]。本研究利用中国人群唾液样本,证实了P[9]RV VP8*与A型分泌型HBGA受体结合,而不与B、O型分泌型HBGA受体及非分泌型HBGA受体结合。
我们还研究了一般人群血清样本中P[9]RV特异性IgG阳性率和HBGA表型之间关系。发现A型分泌型HBGA个体配对的血清中P[9]RV特异性IgG阳性率明显较高,A型分泌型存在于Leb+/Ley+和分泌型HBGA个体中,不存在于Lea+/Lex+和非分泌型HBGA个体中,因此,Leb+/Ley+和分泌型HBGA个体配对的血清中P[9]RV特异性IgG阳性率明显较高,而Lea+/Lex+和非分泌型HBGA个体配对的血清中不存在P[9]RV特异性抗体。表明A型分泌型HBGA受体可能是P[9]RV重要的宿主易感因素。
我国1980-2011年间P型RV中P[8]和P[4]为主要流行株,检出率分别为50.2%和18.2%,P[9]的检出率较低为0.9%[14]。研究RV与HBGA受体的关系有助于理解RV的流行病学。我们课题组对P[8]和P[4]RV与HBGA结合方式开展了研究[12],发现P[8]和P[4]RV能识别具有A、B和O分泌者的HBGA受体,且分泌型人群占我国总人群的80%~90%人[15],表明P[8]和P[4]RV具有广谱易感人群,一定程度上解释了P[8]和P[4]RV为主要流行株的原因。本研究发现P[9]RV VP8*与分泌型A型HBGA受体结合,而不与分泌型B、O型HBGA受体及非分泌型HBGA受体结合,P[9]RV易感人群范围较窄,解释了我国P[9]RV检出率低于P[8]RV检出率这一现象。
Wang等[16]发现我国两株罕见的人P[9]型RV可能来源于犬和猫。P[9]RV能够跨物种传播可能是因为这些物种具有某种相同的物质,本研究发现,P[9]RV VP8*与分泌型A型HBGA受体结合,在很多动物物种中也表达A型HBGA受体[17],动物和人类中都具有A型HBGA抗原可能是P[9]RV跨物种传播的原因。
利益冲突:无
