两种饲养方式下苏尼特羊肉的氧化稳定性
2019-09-18罗玉龙李文博王柏辉赵丽华
罗玉龙,刘 畅,李文博,王柏辉,窦 露,杜 瑞,要 铎,赵丽华,苏 琳,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
在肌肉组织中,氧化稳定性是由脂质氧化与抗氧化能力共同决定的。脂质氧化主要是脂肪酸发生链式反应并产生一系列代谢产物,包括醛、酮、醇、烃等,在大多数情况下,脂质过度氧化会产生令人不愉悦的气味[1-2]。同时,肉中存在的抗氧化系统能抑制氧化,使肉质氧化达到平衡;不合理的饲养方式会使机体过度氧化,加快苏尼特羊的衰老,使羊肉的质量下降。肉中的抗氧化系统主要包括抗氧化酶系统与非酶系统:抗氧化酶系统以超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidases,GPx)为主;非酶系统指的是肌肉组织中的生育酚、类胡萝卜素、酚类化合物等抗氧化物质[3]。但当氧化平衡被破坏后,肉品会加速氧化并引起品质劣变,其货架期会大幅缩短[4]。目前有关抗氧化系统的研究已有报道,但对肉中脂质氧化产物的研究还比较少。Descalzo等发现肉中抗氧化系统由维生素、酚类物质、抗氧化酶等组成,这些物质能清除脂质氧化形成的自由基,达到抑制脂质氧化的作用[5]。Luciano等发现在肉羊饲料中添加单宁后,羊肉的抗氧化能力得到了明显提升[6]。Ponnampalam等发现牧草中的VE能抑制放牧饲养羊肉中的脂质过度氧化[7]。但以上学者对羊肉的氧化稳定性鲜有系统、全面的研究,本团队也仅对绒山羊肉的抗氧化系统进行了一定的研究[8]。因此,本实验通过对放牧饲养和舍饲饲养苏尼特羊肉的脂质氧化产物含量、抗氧化能力、抗氧化酶活力以及相关调控基因表达量进行测定,对比两种饲养方式对苏尼特羊肉氧化稳定性的影响;同时,分析脂质氧化产物含量与抗氧化能力之间的联系,为苏尼特羊的科学化饲养提供一定的理论依据和指导方向。
1 材料与方法
1.1 材料与试剂
从乌拉特中旗畜牧业育种园区内随机选取发育正常、健康无病的放牧饲养和舍饲饲养苏尼特羊各12 只(公母各6 只)。放牧饲养羊主要摄食牧草(包括中间锦鸡儿、芨芨草、蒙古葱、碱韭等);舍饲饲养羊则以摄食饲草料(包括玉米秸秆、葵盘粉等)为主,并补充玉米精料及育肥饲料。
甲醇、氯仿、三氯乙酸(均为分析纯) 国药集团化学试剂有限公司;CAT试剂盒、SOD试剂盒、GPx试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总蛋白定量试剂盒 南京建成生物工程研究所;2,2’-联氮基-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS) 美国Amresco公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC) 美国赛默飞世尔科技公司;RNAiso Plus、6×loading buffer、Marker DL2000、Premix Taq®Version 2.0、PremeScriptTMRT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTM大连宝生物工程有限公司。
1.2 仪器与设备
Trace 1300型气相色谱(gas chromatography,GC)仪、ISQ型质谱(mass spectrometer,MS)仪、固相微萃取(solid-phase microextraction,SPME)手柄 美国赛默飞世尔科技公司;SPME萃取头 美国Supelco公司;5810-R型低温台式冷冻离心机 德国Eppendorf公司;BG-power 5000型稳压稳流电泳仪 北京百晶生物科技有限公司;水平电泳槽、凝胶成像分析仪、CFX96TM型实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)仪 美国Bio-Rad公司;普通PCR仪 美国Applied Biosystems公司。
1.3 方法
1.3.1 样品处理
实验羊宰前禁食并停止饮水,屠宰后从每只羊的股二头肌取约15 g肌肉,置于无菌无酶冻存管中于液氮中存放,于-80 ℃冰箱中保存待用。
1.3.2 脂质氧化产物含量的测定
肉样前处理:将肉样解冻后去筋膜,切块并用液氮速冻,用粉碎机粉碎,称取5 g粉碎肉样放入20 mL样品瓶中,再将老化过的萃取头插入样品瓶,距离样品1 cm,60 ℃水浴吸附40 min后取出萃取头,插入GC进样口,在250 ℃下解吸4 min。
GC-MS条件[9]:TR-5色谱柱(30 m×0.25 mm,0.25 μm),载气为He;载气流速1.0 mL/min;进样口、离子源和传输线温度均为250 ℃;进样方式:不分流进样;升温程序:40 ℃保持3 min;以4 ℃/min升至150 ℃,保持1 min;再以5 ℃/min升温至200 ℃,以20 ℃/min升至230 ℃,保持5 min;质量扫描范围m/z30~400;溶剂延迟时间1 min。MS数据经MEANLIB、NISTDEMO和Wiley Library软件检索,取正反匹配度大于800数据。用峰面积表示苏尼特羊肉中脂质氧化产物含量(106AU/g)。
1.3.3 硫代巴比妥酸值、抗氧化酶活力和T-AOC的测定
肉样4 ℃解冻后用预冷的生理盐水漂洗,称取0.5 g,加9 倍体积生理盐水,在冰水浴中8 000 r/min匀浆30 s,制成质量分数10%组织匀浆液,4 ℃、4 000 r/min离心10 min,取上清液,并按照试剂盒说明书分别测定上清液中蛋白含量、SOD活力、GPx活力、CAT活力、硫代巴比妥酸(thiobarbituric acid,TBA)值以及T-AOC。
1.3.4 自由基清除率的测定
自由基清除率(radical scavenging ability,RSA)的测定参照文献[10]的方法。将25 mL 14 mmol/L ABTS溶液与等体积的2.45 mmol/L K2S2O8溶液混合,黑暗条件下反应16 h,使ABTS完全氧化而形成ABTS阳离子自由基反应液。稀释ABTS阳离子自由基反应液,使其在734 nm波长处的吸光度为0.750±0.020。取1.3.3节组织提取液50 μL与6 mL ABTS阳离子自由基反应液混合,30 ℃水浴反应6 min后在734 nm波长处测吸光度。用等体积的去离子水代替组织提取液作为空白,RSA按下式计算。
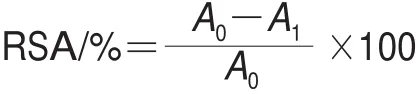
式中:A0为空白组吸光度;A1为样品组吸光度。
1.3.5 铜离子还原能力的测定
参照Apak等[11]的方法测定铜离子还原能力(cupric reducing antioxidant capacity,CUPRAC),将50 μL 1.3.3节组织提取液的上清液加入到反应体系(1 mL 10 mmol/L氯化铜溶液、1 mL 1 mol/L乙酸铵溶液、1 mL 7.5 mmol/L新铜溶液(溶剂为体积分数96%乙醇溶液))中,室温反应1 h,在450 nm波长处测吸光度。同时,用等体积的蒸馏水代替肌肉提取物作为空白对照,CUPRAC以抗坏血酸质量计。
1.3.6 基因表达量的测定
1.3.6.1 引物与探针
引物序列如表1所示,由上海生工生物工程有限公司设计并合成,以18S rRNA作为内参基因。

表1 qPCR引物Table 1 Primers used for real-time polymerase chain reaction
1.3.6.2 总RNA的提取与反转录
称取约100 mg肉样,参照文献[12]中方法进行RNA的提取。测定RNA的吸光度(A260nm/A280nm)及质量浓度后,用质量分数1.5%琼脂糖凝胶电泳检测RNA质量。将RNA样品稀释至500 ng/μL,参照反转录试剂盒说明书的两步法进行反转录,将得到的cDNA放入-20 ℃冰箱内保存。
1.3.6.3 qPCR分析
以c D N A为模板,S Y B R为荧光染料,按照CFX96TMReal-Time PCR Detection System的二步法操作。PCR体系:12.5 μL SYBR®Premix ExTaqTMII、1.0 μL引物F、1.0 μL引物R、2.0 μL cDNA模板、8.5 μL RNase Free dH2O。PCR程序为:预变性95 ℃、30 s;变性95 ℃、5 s,退火60 ℃、30 s,延伸72 ℃、30 s,共35 个循环;延伸72 ℃、10 min。采用2-ΔΔCt法计算目的基因的相对表达量。
1.4 数据统计与分析
数据用SPSS 20.0软件进行方差分析,组间显著性检验用Duncan’s法多重比较,数据用平均值±标准差表示,用Excel软件作图。
2 结果与分析
2.1 氧化指标分析结果
2.1.1 不同饲养方式苏尼特羊肉中脂质氧化程度
羊肉在宰后成熟过程中极易被氧化而产生一些代谢产物,这不仅能引起羊肉的劣变,还能加速肉中肌红蛋白的氧化,造成肉色变差,通常用TBA值反映肉的脂质氧化程度[13-14]。舍饲饲养苏尼特羊肉的TBA值高度显著高于放牧饲养(P<0.001),达到6.10 U/mg,这表明舍饲饲养苏尼特羊肉的脂质氧化程度更严重。放牧饲养羊肉的TBA值(1.37 U/mg)较低,这是由于放牧饲养羊长期摄食大量的绿色牧草,而牧草中含有丰富的抗氧化物质,能够清除组织内的自由基,有效阻止脂质氧化,从而使得放牧饲养羊肉的脂质氧化程度较低[15]。
2.1.2 不同饲养方式苏尼特羊肉脂质氧化产物比较
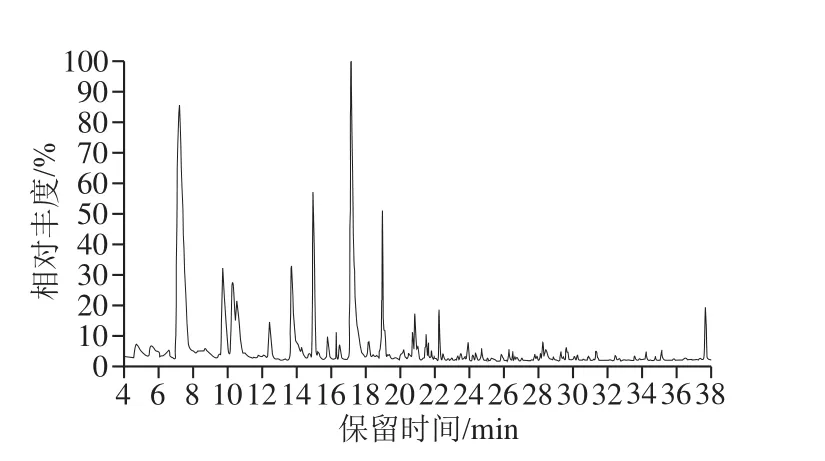
图1 舍饲饲养苏尼特羊肉脂质氧化产物的GC-MS图Fig. 1 Gas chromatography-mass spectrometric (GC-MS) profile of lipid oxidation products in meat from forage plus concentrate-fed sheep
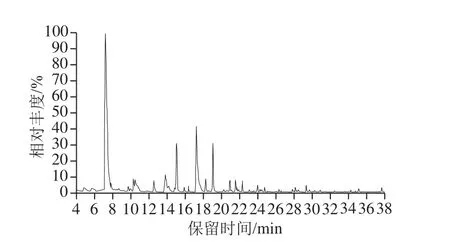
图2 放牧饲养苏尼特羊肉脂质氧化产物的GC-MS图Fig. 2 GC-MS analysis of lipid oxidation products in meat from grazed sheep
由图1、2可知,共检测到26 种脂质氧化产物,分别属于醛类、酮类、醇类和烃类化合物。肉中的脂质氧化可产生醛、醇、酮以及烃类等物质,其含量在适宜的范围内可对羊肉的风味产生积极的影响;含量过高则说明肉中脂质过度氧化,会导致肉的劣变[16]。
由表2可知,检测到的醛类物质主要包括己醛、庚醛、辛醛、壬醛以及苯甲醛等。己醛主要来源于亚油酸和花生四烯酸的氧化,是评定肉类脂氧化状态的重要指标[17]。己醛和壬醛是主要的脂质氧化产物,而少部分的支链醛和芳香醛则由蛋白质降解或与糖类相互作用产生[18]。在饱和醛中,放牧饲养苏尼特羊肉中的己醛、辛醛和壬醛的含量显著低于舍饲饲养(P<0.05);不饱和醛中,舍饲饲养苏尼特羊肉中(E)-2-辛烯醛和(E,E)-2,4-十二碳二烯的含量显著高于放牧饲养(P<0.001,P<0.05);在芳香醛中,放牧饲养苏尼特羊肉中苯甲醛的含量显著高于舍饲饲养(P<0.05)。整体上,对脂质氧化程度影响比较大的醛类物质主要有己醛、庚醛、辛醛、壬醛,均在舍饲饲养羊肉中含量较高。
醇类物质也是脂质氧化的产物,其中1-戊醇和1-己醇由棕榈酸和油酸产生,而1-辛烯-3-醇的前体物质为亚油酸和花生四烯酸,由LOX催化产生[19]。由表2可知,舍饲饲养苏尼特羊肉中1-辛烯-3-醇的含量显著高于放牧饲养(P<0.05),但己醇和苯甲醇含量显著低于放牧饲养(P<0.01,P<0.05)。两种羊肉中含量比较高的醇类物质为1-辛烯-3-醇,是脂质氧化产物中醇类物质的主要组成部分。
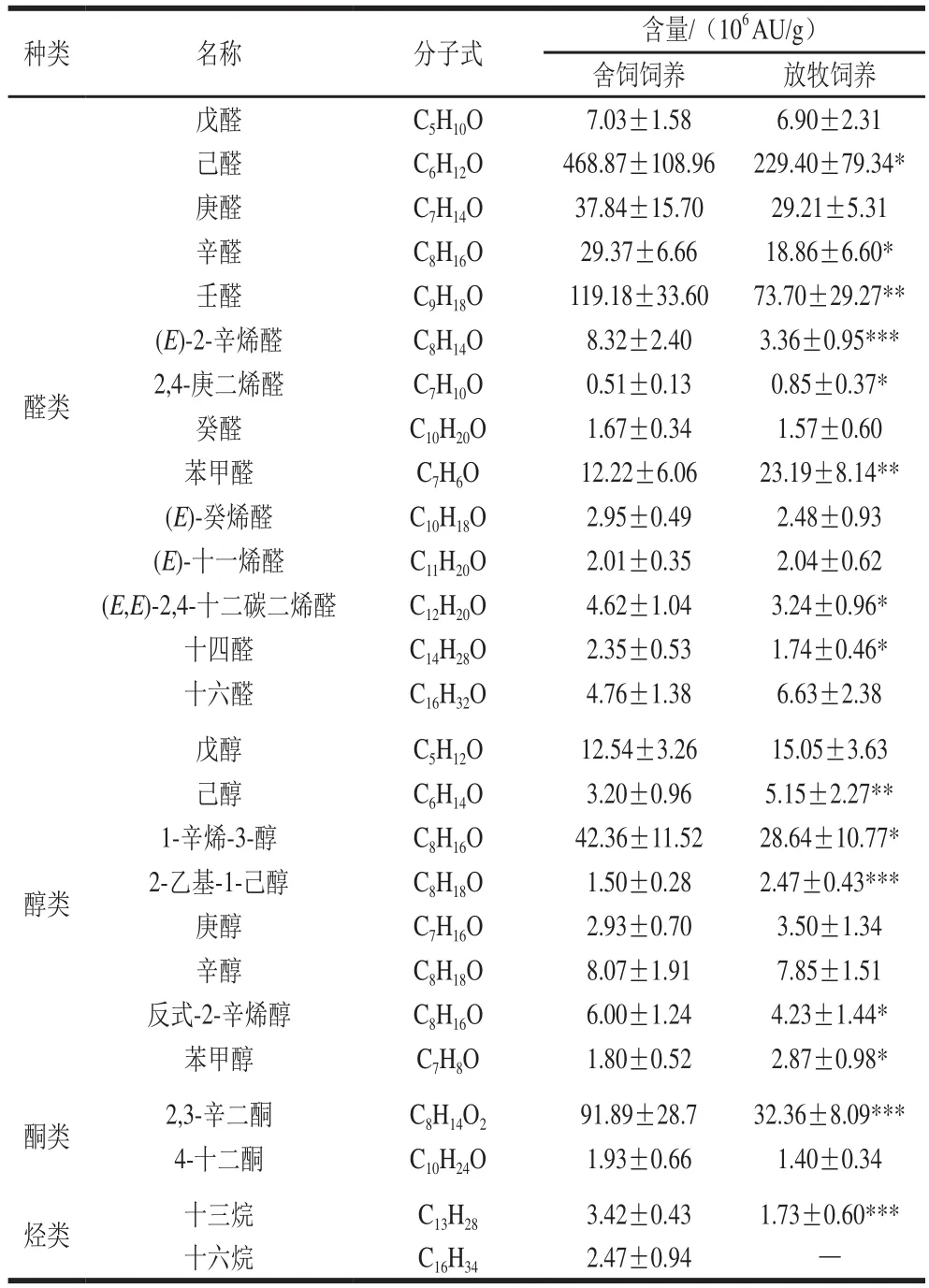
表2 两种饲养方式苏尼特羊肉的脂质氧化产物Table 2 Lipid oxidation products identified in meat from Sunit sheep subjected to two feeding patterns
酮类化合物是脂肪氧化的另一种产物,本研究中共检测出2 种酮类化合物。其中,舍饲饲养羊肉中2,3-辛二酮含量高度显著高于放牧饲养(P<0.001)。在脂类物质氧化过程中,烷氧基被另一个烷游离基氧化从而生成2,3-辛二酮,其是酮类中最主要的脂质氧化产物[20]。
烷烃类化合物主要由脂肪酸烷氧自由基均裂产生,在肉中占的比例较少[21]。苏尼特羊肉中共检测出2 种烃,分别为十三烷和十六烷。其中,放牧饲养羊肉中十三烷的含量显著高于舍饲饲养(P<0.05),而十六烷仅在放牧饲养羊肉中被检测到。整体上,烷烃类物质含量较低,不是脂质氧化的主要产物。
综上,脂质氧化的主要产物为己醛、庚醛、辛醛、1-辛烯-3-醇以及2,3-辛二酮。这些物质均在舍饲饲养羊肉中含量较高,进一步反映了舍饲饲养羊肉的脂质氧化程度比较严重。
2.2 两种饲养方式苏尼特羊肉抗氧化能力
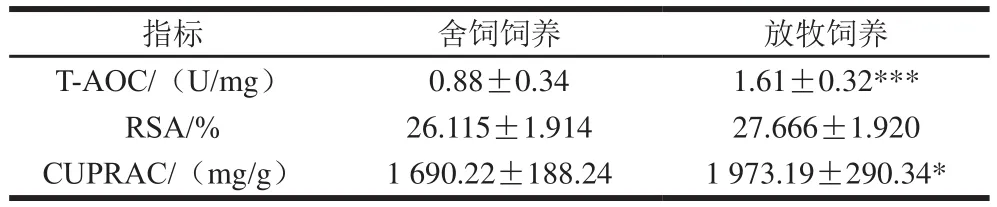
表3 两种饲养方式苏尼特羊肉的抗氧化能力Table 3 Antioxidant properties in meat from Sunit sheep subjected to two feeding patterns
动物机体内存在着一套抗氧化机制,包括非酶与酶类物质,其可清除组织内的自由基,使机体呈现一种动态平衡[22]。由表3可知,放牧饲养羊肉中的T-AOC高度显著高于舍饲饲养(P<0.001),这说明放牧饲养羊肉的抗氧化能力较强。自由基可引发脂质氧化链式反应,而RSA则反映肌肉组织中所有抗氧化物质组成的抗氧系统对自由基的清除能力[23]。RSA在饲养方式上没有显著性差异(P>0.05)。CUPRAC能反映肉中抗氧化物质的含量,放牧饲养羊肉中的CUPRAC显著高于舍饲饲养(P<0.05)。整体上,放牧饲养羊在抗氧化方面具有优势,这可能与肉中含有丰富的抗氧化成分有关,这些抗氧化成分能减轻肉质的氧化损伤[24]。
2.3 两种饲养方式苏尼特羊肉中抗氧化酶活力

表4 两种饲养方式苏尼特羊肉的抗氧化酶活力Table 4 Antioxidant enzymes activities in meat from Sunit sheep subjected to two feeding patterns
肉中抗氧化酶系统通常以SOD、CAT和GPx为代表。SOD是第一个激活酶,它能清除超氧阴离子自由基产生H2O2和O2,随后CAT和GPx清除H2O2,其活力能反映肉中抗氧化酶清除自由基的能力[25]。由表4可知,放牧饲养羊肉的SOD活力高度显著高于舍饲饲养(P<0.001);CAT、GPx活力显著高于舍饲饲养(P<0.05)。CAT可继续将由SOD催化产生的H2O2分解为H2O和O2;GPx可清除细胞液和线粒体中的脂质氧化产物、H2O2及自由基,避免组织产生氧化损伤[26]。整体上,放牧饲养羊抗氧化酶活力高于舍饲饲养,一方面,这可能是因为放牧饲养羊摄入了大量的抗氧化活性物质,对抗氧化酶活力有协同促进的作用;另一方面,放牧饲养羊活动范围较广,运动量较舍饲饲养羊大,这也提高了其肌肉中抗氧化酶的活力[27]。有研究表明,适量的运动可增强抗氧化酶活力,清除组织中的自由基[28];而舍饲饲养羊活动范围受限,运动量小,抵抗机体氧化的能力弱,从而导致其抗氧化酶活力较低。
2.4 两种饲养方式苏尼特羊肉的抗氧化酶相关基因表达量
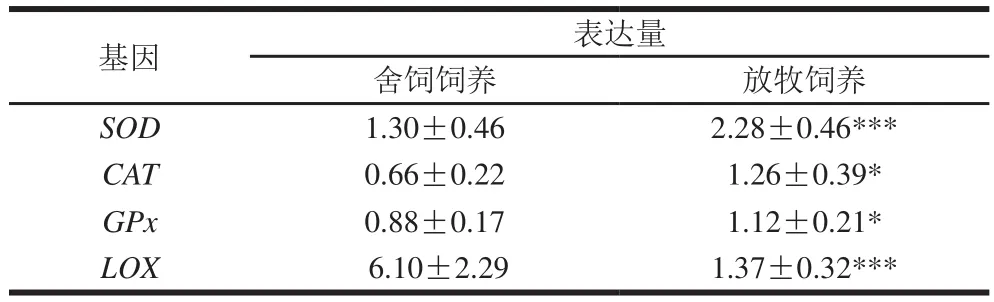
表5 两种饲养方式苏尼特羊肉的抗氧化酶相关基因表达量Table 5 Antioxidant gene expression in meat from Sunit sheep subjected to two feeding patterns
组织内调控抗氧化酶的相关基因有SOD、CAT和GPx,这些基因的表达量可进一步反映抗氧化酶的活性[29];而LOX基因能调控LOX活性,并反映肉中MDA含量。如表5所示,在两种饲养条件下,4 种基因在苏尼特羊肉中均有表达,放牧饲养羊肉中3 种抗氧化酶基因的表达量均高于舍饲饲养,其中SOD基因的表达量高度显著高于舍饲饲养(P<0.001);CAT和GPx基因的表达量显著高于舍饲饲养(P<0.05)。抗氧化酶基因的表达量能反映抗氧化酶的活性,进一步从分子水平上验证了放牧饲养羊的抗氧化能力较舍饲饲养好。Vahedi等的研究也证实了羊肉中的抗氧化酶基因(SOD、GPx)表达量的增加能提高抗氧化酶活性[29]。脂质的酶促氧化是在LOX的作用下进行的,并会产生一些挥发性物质,放牧饲养羊LOX基因表达量高度显著低于舍饲饲养羊(P<0.001),这说明舍饲饲养羊肉中调控LOX的基因非常活跃,从而加速了舍饲饲养羊肉的脂质氧化。
3 结 论
舍饲饲养苏尼特羊肉TBA值高于舍饲饲养,并且羊肉中的脂质氧化产物含量较高,这表明舍饲饲养羊肉的脂质氧化程度比较严重。放牧饲养羊的T-AOC、CUPRAC和SOD、CAT、GPx活力均高于舍饲饲养羊,这说明放牧饲养羊肉的抗氧化能力较高,能有效抑制肉中的脂质氧化。进一步分析两种饲养方式下羊肉中的抗氧化酶相关基因表达量,发现舍饲饲养羊肉中LOX基因表达量高于放牧饲养,而SOD、CAT和GPx基因表达量均低于放牧饲养,从分子水平验证了舍饲饲养羊肉脂质氧化程度更严重,而放牧饲养羊肉的抗氧化能力较好。
