僵蚕中有效成分白僵菌素的研究进展
2019-09-10陈文文胡美变彭伟吴纯洁
陈文文 胡美变 彭伟 吴纯洁
摘 要 目的:调查僵蚕中有效成分白僵菌素(BEA)的研究現状,为BEA的临床应用提供参考。方法:以“白僵菌素”“合成”“药理活性”“检测”“毒性”“临床应用”“Beauverin”“Synthesis”“Pharmacological action”“Detection”“Toxicity”“Clinical application”等为关键词,组合查询建库至2018年12月在中国知网、万方数据、维普网、PubMed、ScienceDirect、Web of Science等数据库中的相关文献,对BEA的合成、药理作用、检测方法、毒性等研究进展进行综述。结果与结论:共检索到相关文献690篇,其中有效文献47篇。BEA是僵蚕有效成分之一,近年来文献报道的BEA合成方式多为生物合成,其中采用不同培养基和培养条件由多种镰刀菌属菌种生物合成的报道最多。BEA在工业应用及实验室研究中表现出多种多样的生物活性,包括杀虫、抗肿瘤、抑菌、抗病毒、抗惊厥、抗结核和抗疟原虫等作用。目前通常采用高效液相色谱法或高效液相色谱-质谱法检测BEA,其中质谱法最低检测限可达到10 pg/mL以下,方法灵敏,特异性高。BEA有免疫毒性和基因毒性,但其毒动学行为研究很少。BEA作为一个有潜力的药物,有可能用于癌症或病毒和细菌感染;但基于其免疫毒性和基因毒性,可考虑将其作为先导化合物进行结构改造和活性机制研究。
关键词 白僵菌素;抗肿瘤;抗惊厥;生物合成;检测;毒性;临床应用
僵蚕为蚕蛾科昆虫家蚕4~5龄的幼虫感染(或人工接种)白僵菌而致死的干燥体,具有息风止痉、祛风止痛、化痰散结之功效。白僵菌素(Beauverin,BEA)是一种由球孢白僵菌和镰刀菌等真菌产生的真菌毒素,也是中药僵蚕的有效成分之一。已有研究表明,BEA具有杀虫、抗肿瘤、抑菌、抗病毒、抗惊厥等作用[1-5]。为了解僵蚕中有效成分BEA在药效、毒理及其作用机制方面的研究概况,笔者以“白僵菌素”“合成”“药理活性”“检测”“毒性”“临床应用”“Beauverin”“Synthesis”“Pharmacological action”“Detection”“Toxicity”“Clinical application”等为关键词,组合查询建库至2018年12月在中国知网、万方数据、维普网、PubMed、ScienceDirect、Web of Science等数据库中的相关文献。结果,共检索到相关文献690篇,其中有效文献47篇。现对BEA的合成、药理作用、检测方法、毒性等研究进展进行综述,以期为BEA的临床应用提供参考。
1 BEA的合成、分离及纯化
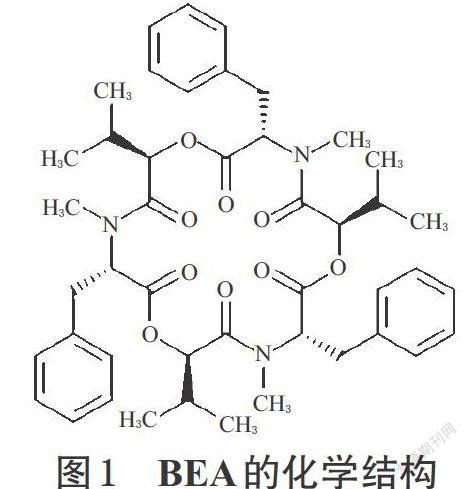
BEA于1969年由Hamil RL首次从球孢白僵菌的菌丝体中提取得到[6],分子量为783 Da,分子式为C45H57N3O9,是由3个相同的D-2-α-2羟异戊基-L-N-苯基组成的环状化合物,具有环状三羧酸肽的结构见图1。BEA为白色针状晶体,熔点93~94 ℃,耐热、较稳定;可致细胞核变形、组织崩解,100 ℃下加热1 h 仍可保持毒性[7]。
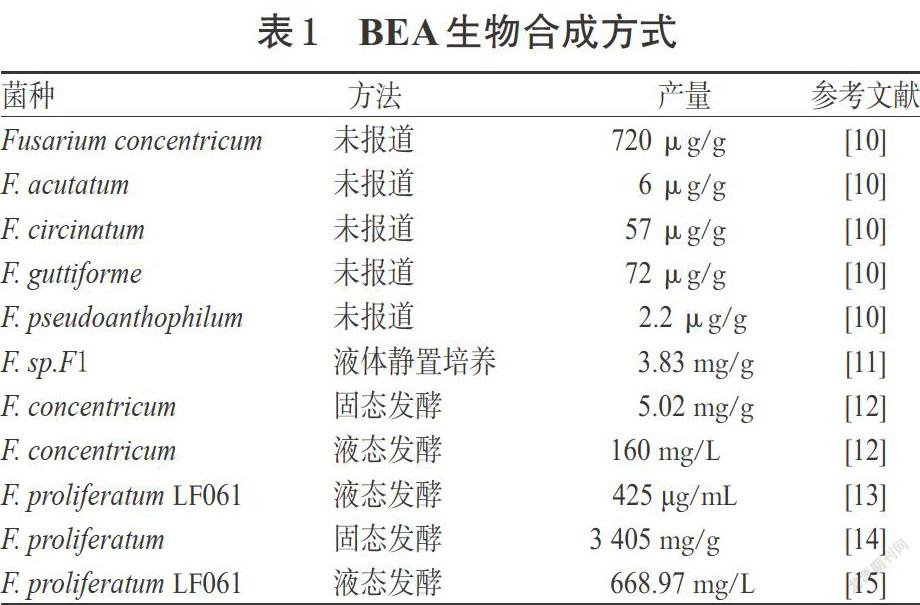
1971年,就已有文献报道了BEA的化学合成方法[8];1988年,Peeters H等[9]从球孢白僵菌(Beauveria bassiana)中分离纯化出BEA合成酶,并在体外通过前体添加的方法合成了BEA。近年来文献报道的BEA的合成方式多为生物合成,详见表1。目前已报道多种镰刀菌、部分棒束孢白僵菌、球孢白僵菌可产BEA[2]。
关于BEA的分离及纯化方法,Wang QX等[16] 将尖孢镰刀菌(F. oxysporum)发酵菌丝体用乙酸乙酯反复提取后,蒸干,得粗提物;粗提物用水分散后,用二氯甲烷萃取;萃取物经过凝胶柱、硅胶柱、ODS反相柱和反相高效液相制备色谱处理,最终得到BEA。Xu LJ等[17]将盾叶薯蓣镰刀菌属内寄生菌(F. redolens)的发酵菌丝体用正丁醇提取后浓缩得粗提物,然后通过硅胶柱、凝胶柱、反相色谱柱纯化制得BEA。周立刚等[18]通过发酵培养镰刀菌(F. sp. Dzf2),对其内生真菌Dzf2培养物的提取物进行反复的柱层析,包括常规的硅胶柱层析、Sephadex LH-20凝胶柱层析、RP-18反相柱层析,得到BEA。总之,近年来少见化学合成方法报道,研究者多采用不同培养基和条件、由多种镰刀菌属菌种生物合成BEA。
2 BEA的药理作用研究
BEA具有生物活性,包括杀虫、抗肿瘤、抑菌、抗病毒、抗惊厥等作用[1-5]。
2.1 杀虫作用
Hamill RL等首次发现了BEA的杀虫活性,后来有学者发现微克级的BEA即对红头丽蝇、埃及伊蚊、草盲蝽、草地贪夜蛾、麦二叉蚜等具有杀虫效果[3,7]。目前,BEA在工业上主要用作真菌性杀虫剂,是一种完全天然无毒的生物农药,在安全性和环境保护方面优于多数植源性农药,可用于农业或林业防治多种害虫。此外,昆虫病原真菌可在昆虫体内繁殖并随昆虫活动广泛传播,所以少量孢子就能产生良好的杀虫效果[19]。
2.2 抗肿瘤作用
近年来,多项研究表明BEA可诱导多种细胞凋亡,其中BEA对不同肿瘤细胞的凋亡诱导作用备受关注。Zhan J等[19]报道,BEA可能参与细胞程序性死亡相关蛋白的激活,在前列腺癌细胞系PC-3M和乳腺癌细胞系MDA-MB-231中显示出迁移抑制活性,表明其具有抗肿瘤活性。Jow G和Chen BF等[20-21]报道,BEA在人白血病细胞中可能通过增加细胞色素C从线粒体的释放,使半胱氨酸天冬氨酸蛋白酶3(Caspase-3)活性增加,并改变其细胞形态从而诱导细胞凋亡。Cal L等[22]研究了BEA在骨髓来源的人细胞系中的作用,包括人单核细胞淋巴瘤细胞U-937和人早幼粒白血病细胞HL-60,结果表明BEA的半数抑制浓度(IC50)分别为10、12 μg/mL;Lin HI等[23]报道了BEA可诱导人非小细胞肺癌A549细胞凋亡,下调磷酸化的B细胞淋巴瘤因子2(p-Bcl-2)蛋白的表达,增加线粒体细胞色素C的释放,激活Caspase-3,其IC50为2.4~7.8 μg/mL。Wu XF等[24]的研究表明,BEA的抗肿瘤作用可能通过下调磷脂酰肌醇3激酶-蛋白激酶(PI3-Akt)信号通路,抑制T细胞增殖、活化和γ干扰素信号和转录活化蛋白1-转录因子T-BET(IFN-γ-STAT1- T-BET)信号的转导,并通过抑制Bcl-2、磷酸化Bad以及增强Caspase-3、Caspase-9、Caspase-12和聚腺苷二磷酸-核糖聚合酶(PARP)的裂解而导致活化的T细胞凋亡。此外,BEA对人肝癌细胞Hep G2、人胚肺成纤维细胞MRC-5、人乳腺癌细胞MCF-7、人中枢神经系统癌(胶质瘤)细胞SF-268、人胰腺癌细胞MIA Pa ca-2、新生儿人角质形成细胞、人食管上皮细胞、人视网膜母细胞瘤Y79、猪肾上皮细胞系、Vero非洲绿猴肾成纤维细胞、CY-1(猴肾)细胞也表现出细胞毒性[1,25-28]。
2.3 抑菌及抗病毒作用
BEA对许多革兰氏阳性和革兰氏阴性致病菌均具有较大的活性。研究发现,尽管BEA和青霉素类的抗菌药物均来自真菌产生的氨基酸,但是其抗菌作用机制却并不相同:青霉素是阻断革兰氏阳性细菌细胞壁的肽聚糖生物合成,BEA则主要作用于细菌的细胞器(核糖体或细胞核等)和酶[3]。BEA可抑制的细菌包括革兰氏阳性菌如芽孢杆菌、双歧杆菌、消化链球菌、类芽孢杆菌、产气荚膜梭菌、肠球菌、李斯特菌、结核杆菌、溶血葡萄球菌,革兰氏阴性菌如农杆菌、绿脓杆菌、大肠埃希菌、疮痂病菌、黄瓜角斑病菌、大肠埃希菌CECT 4782、肠沙门菌、痢疾志贺氏菌和小肠结肠炎耶尔森菌等[1]。
BEA单独使用时无抗真菌活性,可能是由于它本身即是真菌的一种代谢产物,但其与抗真菌药物联用时可表现出协同抗菌作用。Fukuda T等[29]发现,BEA不仅能够增强咪康唑对普通白色念珠菌的抑制作用,而且对耐氟康唑的白色念珠菌也有抑制作用,可降低咪康唑对氟康唑耐药白色念珠菌的IC50值。Zhang LX等[30]报道了BEA能显著提高酮康唑对不同真菌病原体的抑制活性,0.5 mg/kg的BEA与0.5 mg/kg的酮康唑联用可大大提高感染近平滑假丝酵母菌小鼠的存活率,减少动物器官(包括肾、肺和脑)中的真菌菌落数,且比单独使用50 mg/kg高剂量酮康唑的效果更好。
Shin CG等[31]报道了BEA对HIV1型整合酶有较强的抑制活性,其IC50为1.9 μmol/L,并认为BEA有可能成为一种新的整合酶强效抑制剂。
2.4 其他药理作用
2.4.1 抗惊厥作用 郭晓恒等[4-5]从僵蚕抗惊厥活性部位分离得到β-谷甾醇、麦角甾-6,22-二烯-3β,5α,8α-三醇及BEA等3个单体活性成分,并对其抗惊厥活性进行筛选。结果发现,125 mg/kg BEA对尼可刹米所致小鼠惊厥的出现时间有延迟作用,故而认为BEA具有抗惊厥活性。
2.4.2 对细胞色素P450酶(CYP)的抑制作用 有研究报道BEA在人肝微粒体中能够较强地抑制CYP3A4和CYP2C19的代谢反应,IC50分别为1.2、1.3 μmol/L,且抑制类型分别为竞争性抑制(CYP3A4)和混合型抑制(CYP2C19)。但在鼠肝微粒體中,BEA是CYP3A1/3A2的强抑制剂,IC50值为1.27 μmol/L,但其对CYP2C6和CYP2D2未表现出抑制效果[32]。
2.4.3 抗结核和疟原虫 Nilanonta C等[33]从昆虫病原真菌拟青霉BCC 1614粗提物中分离鉴定出了BEA同系物beauvericin和beauvericin A,研究结果表明两者均具有抗结核和疟原虫的活性。
由上述文献可知,BEA对多种细胞系均表现出细胞毒性,其作用机制可能与增加细胞色素C释放和激活Caspase-3有关;BEA对多种革兰氏阳性和革兰氏阴性菌具有较强的抑制活性,其主要作用于细菌的细胞器(核糖体或细胞核等)和酶;BEA单独使用虽无抗真菌活性,但可增加部分抗真菌药的抑菌效果,对HIV1型整合酶也有较强的抑制活性;此外,BEA还有抗惊厥、抑制CYP酶、抗结核和疟原虫等作用,有较大的药用价值。
3 BEA的检测方法研究
关于BEA检测方法的文献报道较多,目前常采用高效液相色谱法(HPLC)、超高效液相色谱-串联质谱法(UPLC-MS/MS)、液质联用法(LC-MS)或高效薄层色谱法(HPTLC)等。
Sewram V等[34]采用LC-MS法检测镰刀菌和自然污染玉米中的BEA,在荷质比(m/z)为445和784时分别观察BEA的质子化分子离子信号。结果,纯BEA的最低检测限为20 pg(信噪比为2),BEA在自然污染玉米中的最低检测限为0.5 mg/kg。
Josephs RD等[35]采用Waters Acquity UPLC系统与Waters Quattro Premier XETM质谱仪耦合,以正离子源(ESI+)模式扫描,测定小麦、玉米、大米、面食等谷类食品中BEA及恩镰孢素a、a1、b1等。该方法样品预处理快速简单,仅需液-液萃取目标毒素,色谱分离较快,节省了大量的成本和时间,所得检测限为0.1~1.0 μg/kg,定量限为0.3~2.9 μg/kg。
Taevernier L等[36]建立了UPLC-MS/MS法同时测定人皮肤弗朗茨扩散细胞样品中的BEA和恩镰孢素a、a1、b、b1、d、e、c/f。结果显示,其检测限为10~17 pg/mL,总运行时间仅为4.5 min,准确度和精密度均良好。
Uhlig S等[37]报道了一种用LC-MS法同时检测谷物中包含BEA在内的5种恩镰孢素的方法。该方法采用乙腈-水提取真菌次生代谢产物,以常压化学电离LC-MS法定量,无需对样品提取物进行进一步处理,选取[M+NH4]+与[M+H]+的离子反应,对化合物进行特异性检测。结果,BEA平均回收率为99%~115%,检测限为3.0 μg/kg。
此外,Kostecki M和Devreese M等[38-39]也报道了BEA的相关检测方法,检测限可低至10 pg/mL以下,方法灵敏,特异性高。
4 BEA的毒性研究
BEA的毒性极大地限制了其应用。BEA对哺乳动物的毒性较大,可影响动物或人类的健康,目前对其毒性的研究均以动物实验为基础,无法评估其对人体的毒理学后果。据欧洲食品安全局报告,BEA急性暴露并不构成对人类和动物的真正威胁,其毒性作用可能是慢性接触所致[2]。
4.1 免疫毒性
有研究证实,BEA可抑制肿瘤坏死因子α(TNF-α)诱导的免疫调节因子核因子κB(NF-κB)的激活,但不抑制NF-κB的基础活性。转录因子NF-κB是与严重疾病、炎症、凋亡和癌症相关的免疫调节基因表达中一个非常重要的调节因子[40]。有研究表明,胚胎碱性磷酸酶(SEAP)的分泌依赖于NF-κB,其与TNF-α(5 ng/mL,24 h)孵育后,SEAP的活性可提高3.3倍;但是用0.5、1 μmol/L的BEA预孵育1 h后,TNF-α激活的NF-κB量可分别降低至69%和54%[41]。
4.2 基因毒性
基因毒性是指对影响细胞完整性的遗传物质的破坏性作用。有研究结果表明,BEA有损伤DNA的作用;但也有研究显示,BEA可降低H2O2诱导的DNA损伤。例如有研究表明,在暴露于BEA的细胞中,可观察到核间DNA碎片、染色体凝聚、膜泡、细胞收缩、凋亡体形成和凋亡形态变化,并且呈现出时间依赖性[20,23,42];而pk15、cho-k1和caco-2细胞分别在0.5、1、12 μmol/L的BEA中暴露24 h后,采Comet分析法可检测到显著的DNA损伤[43-45];而另一研究发现,BEA预处理可使HL60和KB-3-1细胞中由H2O2诱导的DNA损伤分别降低30%和34%[46]。
4.3 毒动学研究
对BEA的毒动学行为研究目前还较少。Devreese M和Rodríguez-Carrasco Y等[39,47]研究了BEA及其结构相似的Enniatin B对小鼠连续给药3 d后(剂量5 mg/kg)在其血清、尿液、肌肉、结肠、脂肪、脑、肾和肝提取物中的分布情况。结果显示,除尿液外,所有生物样本中均检测到BEA原型,未发现代谢产物;BEA在亲脂性組织中具有生物累积性,所测得的生物样品中的浓度比Enniatin B高出18倍以上,其浓度最高值出现在解毒器官肝脏中。
5 结语
BEA作为一个有潜力的药物,有可能用于治疗癌症、病毒和细菌感染等。目前,关于BEA已知的杀虫、抑菌、抗HIV病毒、抗惊厥等的药理作用机制报道还很少,仅有少数文献对BEA抗肿瘤作用的机制进行了研究,结果显示,BEA可能是通过增加线粒体细胞色素C的释放、增加Caspase-3活性、改变细胞形态、下调PI3-Akt信号通路等途径发挥的作用。
BEA具有潜在的多种药理活性,但其免疫毒性和基因毒性限制了其使用,今后的研究可考虑将BEA作为先导化合物,并将研究重点放在揭示BEA的各种活性机制和结构改造上,以更好地开发其药用价值。
参考文献
[ 1 ] SOOD S,SANDHU SS,MUKHERJEE TK. Pharmacolo- gical and therapeutic potential of beauvericin:a short review[J]. J Proteomics Bioinf,2017,10(1):18-23.
[ 2 ] MALLEBRERA B,PROSPERINI A,FONT G,et al. In vitro mechanisms of beauvericin toxicity:a review[J]. Food Chem Toxicol,2018,111(1):537-545.
[ 3 ] WANG Q,XU L. Beauvericin,a bioactive compound produced by fungi:a short review[J]. Molecules,2012,17(3):2367-2377.
[ 4 ] 郭晓恒,严铸云,刘涛,等.僵蚕单体化合物抗惊厥活性[J].中国实验方剂学杂志,2013,19(17):248-250.
[ 5 ] 郭晓恒,吴用彦,宋登敏,等.僵蚕氯仿部位的分离纯化及其抗惊厥活性[J].中国医药工业杂志,2014,45(5):431-433.
[ 6 ] HAMIL RL,HIGGENS CE,BOAZ HE,et al. The structure of beauvericin,a new desipeptide antibiotic toxic to Artemia salina[J]. Tetrahedron Lett,1969,10(49):4255- 4258.
[ 7 ] MONTI SM,FOGLIANO V,LOGRIECO A,et al. Simultaneous determination of beauvericin,enniatins,and fusaproliferin by high performance liquid chromatography[J]. J Agric Food Chem,2000,48(8):3317.
[ 8 ] OVCHINNIKOV YA,IVANOV VT,MIKHALEVA II. The synthesis and some properties of beauvericin[J]. Tetrahedron Lett,1971,12(2):159.
[ 9 ] PEETERS H,ZOCHER R,KLEINKAUF H. Synthesis of beauvericin by a multifunctional enzyme[J]. J Antibiot,1988,41(3):352-359.
[10] FOTSO J,LESLIE JF,SMITH JS. Production of Beau- vericin,Moniliformin,Fusaproliferin,and Fumonisins B,and Bby fifteen ex-type strains of species[J]. Appl Environ Microbiol,2002,68(10):5195-5197.
[11] 朱颖雷,钟坤,邵志宇,等.镰刀菌Fusarium sp.F1制备白僵菌素的初步研究[C]//上海:上海市化学化工学会2007年度学术年会,2007:168-169.
[12] 霍秦秦,郝玉有,储炬,等.产白僵菌素镰孢菌发酵培养基的初步研究[J].中国抗生素杂志,2012,37(11):817- 820、836.
[13] 段寶玲,张立新,张雪霞,等.白僵菌素的制备方法:中国,201310725157.6[P]. 2013-12-25.
[14] 张立新,贺伟,刘梅.一种制备白僵菌素的方法:中国,201410211035.X[P]. 2015-11-25.
[15] 孙安徽.白僵菌素在构巢曲霉中异源表达的研究[D]. 合肥:安徽大学,2016.
[16] WANG QX,LI SF,ZHAO F,et al. Chemical constituents from endophytic fungus Fusarium oxysporum[J]. Fitoterapia,2011,82(5):777-781.
[17] XU LJ,WANG JH,ZHAO JL,et al. Beauvericin from the endophytic fungus,Fusarium redolens,isolated from Dio- scorea zingiberensis and its antibacterial activity[J]. Nat Prod Commun,2010. DOI:10.1016/j.jbiotec.2008.07.304.
[18] 周立刚,姜微波,彭友良,等.一种产白僵菌素的盾叶薯蓣内生镰孢菌及其抗细菌活性:中国,CN200810056844.2[P]. 2008-01-25.
[19] ZHAN J,BURNS AM,LIU MX,et al. Search for cell motility and angiogenesis inhibitors with potential anticancer activity:beauvericin and other constituents of two endophytic strains of Fusarium oxysporum[J]. J Nat Prod,2007,70(2):227-232.
[20] JOW G. Beauvericin induces cytotoxic effects in human acute lymphoblastic leukemia cells through cytochrome C release,caspase 3 activation:the causative role of calcium[M]. Mumbai:Himalaya Pub. House,2004:165-173.
[21] CHEN BF,TSAI MC,JOW GM. Induction of calcium influx from extracellular fluid by beauvericin in human leukemia cells[J]. Biochem Biophys Res Commun,2006,340(1):134-139.
[22] CAL L,FORNELLI F,RAMIRES R,et al. Cytotoxic effects of the mycotoxin beauvericin to human cell lines of myeloid origin[J]. Pharmacol Res,2004,49(1):73-77.
[23] LIN HI,LEE YJ,CHEN BF,et al. Involvement of Bcl-2 family,cytochrome c and caspase 3 in induction of apoptosis by beauvericin in human non-small cell lung cancer cells[J]. Cancer Lett,2005,230(2):248-259.
[24] XU XF,XU R,OUYANG ZJ,et al. Beauvericin ameliorates experimental colitis by inhibiting activated T cells via downregulation of the PI3K/Akt signaling pathway[J]. PloS One,2013. DOI:10.1371/journal.pore.0083013.
[25] LADA I,EYSTEIN S,ERIKSEN GS,et al. Cytotoxicity of enniatins A,A1,B,B1,B2 and B3 from Fusarium ave- naceum[J]. Toxicon,2006,47(8):868-876.
[26] WANG W,JONES C,CIACCIZANELLA J,et al. Fumonisins and Alternaria alternata lycopersici toxins:sphinganine analog mycotoxins induce apoptosis in monkey kidney cells[J]. Proc Natl Acad Sci:USA,1996,93(8):3461-3465.
[27] TOLLESON WH,MELCHIOR WB,MORRIS SM,et al. Apoptotic and anti-proliferative effects of fumonisin B1 in human keratinocytes,fibroblasts,esophageal epithelial cells and hepatoma cells[J]. Carcinogenesis,1996,17(2):239-249.
[28] KLARIĆ MŠ,PEPELJNJAK S,DOMIJAN A M,et al. Lipid peroxidation and glutathione levels in porcine kidney PK15 cells after individual and combined treatment with fumonisin B1,beauvericin and ochratoxin A[J]. Basic Clin Pharmacol Toxicol,2010,100(3):157-164.
[29] FUKUDA T,ARAI M,YAMAGUCHI Y,et al. New beauvericins,potentiators of antifungal miconazole activity,produced by beauveria sp. FKI-1366: Ⅰ Taxonomy,Fermentation,isolation and biological properties[J]. J Antibiot,2004. DOI:10.7164/antibiotics.s7.110.
[30] ZHANG LX,YAN KZ,ZHANG Y,et al. High-throughput synergy screening identifies microbial metabolites as combination agents for the treatment of fungal infections[J]. Proc Natl Acad Sci:USA,2007,104(11):4606- 4611.
[31] SHIN CG,AN DG,SONG HH,et al. Beauvericin and enniatins H,I and MK1688 are new potent inhibitors of human immunodeficiency virus type-1 integrase[J]. J Anti- biot,2009,62(12):687-690.
[32] 梅黎. Beauvericin對细胞色素P450的抑制作用及其在大鼠体内的药代动力学研究[D].广州:中国科学院广州生物医药与健康研究院,2008.
[33] NILANONTA C,ISAKA M,KITTAKOOP P,et al. Antimycobacterial and antiplasmodial cyclodepsipeptides from the insect pathogenic fungus Paecilomyces tenuipes BCC 1614[J]. Planta Med,2000,66(08):756-758.
[34] SEWRAM V,NIEUWOUDT TW,MARASAS WFO,et al. Determination of the Fusarium mycotoxins,fusaproliferin and beauvericin by high-performance liquid chromatography-electrospray ionization mass spectrometry[J]. J Chromatogr A,1999,858(2):175-185.
[35] JOSEPHS RD,KRSKA R,SCHUHMACHER R,et al. A rapid method for the determination of the Fusarium mycotoxinbeauvericin in maize[J]. Fresenius J Anal Chem,1999,363(1):130-131.
[36] TAEVERNIER L,VERYSER L,VANDERCRUYSSEN K,et al. UHPLC-MS/MS method for the determination of the cyclic depsipeptide mycotoxins beauvericin and enniatins in in vitro transdermal experiments[J]. J Pharm Bio- med Anal,2014,100(9):50-57.
[37] UHLIG S,IVANOVA L. Determination of beauvericin and four other enniatins in grain by liquid chromatography- mass spectrometry[J]. J Chromatogr A,2004,1050(2):173-178.
[38] KOSTECKI M,GRABARKIEWICZ-SZCZESNA J,GOLINSKI P. Simultaneous analysis of beauvericin and moniliformin in fungal cultures and in cereal grain samples[J]. Mycotoxin Res,1997,13(1):17-22.
[39] DEVREESE M,BAERE SD,BACKER PD,et al. Quantitative determination of the Fusarium mycotoxins beauvericin,enniatin A,A1,B and B1 in pig plasma using high performance liquid chromatography-tandem mass spectrometry[J]. Talanta,2013,106(6):212-219.
[40] ZHENGWU S,ROLAND A. NF-kappaB activation and inhibition:a review[J]. Shock,2002,18(2):99-106.
[41] WÄTJEN W,DEBBAB A,HOHLFELD A,et al. The mycotoxin beauvericin induces apoptotic cell death in H4IIE hepatoma cells accompanied by an inhibition of NF-κB- activity and modulation of MAP-kinases[J]. Toxicol Lett,2014,231(1):9-16.
[42] DOMBRINK-KURTZMAN MA. Fumonisin and beauvericin induce apoptosis in turkey peripheral blood lymphocytes[J]. Mycopathologia,2003,156(4):357-364.
[43] KLARIĆ M Š,DARABOŠ D,ROZGAJ R,et al. Beauvericin and ochratoxin A genotoxicity evaluated using the alkaline comet assay:single and combined genotoxic action[J]. Arch Toxicol,2010,84(8):641-650.
[44] PROSPERINI A,JUAN-GARCÍAA,FONT G,et al. Beauvericin-induced cytotoxicity via ROS production and mitochondrial damage in Caco-2 cells[J]. Toxicol Lett,2013,222(2):204-211.
[45] MALLEBRERA B,JUAN-GARCIAA,FONT G,et al. Mechanisms of beauvericin toxicity and antioxidant cellular defense[J]. Toxicol Lett,2016,246(1):28-34.
[46] DORNETSHUBER R,HEFFETER P,LEMMENS-GRUBER R,et al. Oxidative stress and DNA interactions are not involved in Enniatin- and Beauvericin-mediated apoptosis induction[J]. Mol Nutr Food Res,2010,53(S2):1112-1122.
[47] RODRÍGUEZ-CARRASCO Y,HEILOS D,RICHTER L,et al. Mouse tissue distribution and persistence of the food-born fusariotoxins Enniatin B and Beauvericin[J]. Toxicol Lett,2016,247(2):35-44.
(收稿日期:2019-06-22 修回日期:2019-11-20)
(編辑:孙 冰)
