鮰爱德华氏菌的红色荧光蛋白标记及其应用
2019-09-10刘春陈晓虹姜兰曹际振李凯彬王英英常藕琴王芳石存斌林明辉王庆
刘春 陈晓虹 姜兰 曹际振 李凯彬 王英英 常藕琴 王芳石存斌 林明辉 王庆

摘要:为研究鲴爱德华氏菌与宿主的相互作用关系,本研究构建带有红色荧光蛋白基因的pMDmCherry表达载体,通过电击转化法将载体成功导人鮰爱德华氏菌zb1141菌株中,获得了红色荧光蛋白标记的鲴爱德华氏菌菌株。在倒置荧光显微镜下观察,重组鲴爱德华氏菌显示特异性红色荧光。稳定性检测结果表明,标记菌株传至28代,重组质粒稳定率仍为100%。用标记菌株感染斑马鱼仔鱼后,能在激光共聚焦显微镜下实时观察到细菌在鱼体内的分布情况;标记菌株体外感染小鼠巨噬细胞后,也能观察到病原菌与巨噬细胞的相互作用情况。说明标记菌株具有良好的特异性和可视性,为鮰爱德华氏菌对宿主的致病性研究提供了一种良好的生物材料。
关键词:鮰爱德华氏菌;红色荧光蛋白;斑马鱼;巨噬细胞
中图分类号: S917.1
文獻标识码:A
文章编号: 1000-4440( 2019) 03-0661-06
鮰爱德华氏菌(Edwardsiella ictaluri)隶属肠杆菌科、爱德华氏菌属,是一种兼性的胞内寄生菌,可感染斑点叉尾鲴等多种名特鱼类[1]。鱼体感染后表现为内脏器官的充血、出血、炎症、变性和坏死,严重的在头部形成开放性的溃疡灶[2]。自1979年,Hawke首次报道鮰爱德华氏菌感染斑点叉尾鮰以来,该细菌在世界各地迅速蔓延,目前已在澳大利亚、泰国、越南、日本、中国等相继发现鮰爱德华氏菌感染鱼类发病,感染对象包括南方大口鲇、斑点叉尾鲴、黄颡鱼、长吻鮠、鳗鲶和虹鳟等,发病率和死亡率均较高,严重影响水产养殖业的发展[3-6]。为了有效地预防和控制鮰爱德华氏菌病的发生与传播,研究鮰爱德华氏菌对宿主的致病性及感染途径,深刻认识其致病机理显得尤为重要。
荧光蛋白是部分生物体产生的在特定波长光照射下可激发对应颜色荧光的蛋白质。荧光蛋白激发的荧光具有检测灵敏性高、特异性强和细胞毒性小等优点[7],大量研究结果显示,荧光蛋白是理想的荧光标记物,利用荧光蛋白标记病原菌,对其进行定位和示踪,可实现细菌在体内的实时监测,研究病原菌入侵的动态过程[8]。目前在水产养殖领域,已有相关用荧光蛋白标记迟缓爱德华氏菌(Edwardsiellatarda)、嗜水气单胞菌(Aeromonas hydrophila)、杀鲑气单胞菌(Aeromonas salmonicida)等致病菌及其对宿主的侵染途径的研究报道[9-11]。
本研究从患病斑马鱼体内分离出l株高致病性的鮰爱德华氏菌,构建带有mCherry基因的pMDmCherry载体,通过电击转化到鲴爱德华氏菌中。进一步将mCherry基因标记的鲴爱德华氏菌感染斑马鱼仔鱼和小鼠巨噬细胞RAW264.7,利用激光共聚焦显微镜观察标记细菌在鱼体内的扩散分布情况及标记细菌与体外巨噬细胞的相互作用关系。本研究为mCherry标签进行细菌标记使菌落观察更具可视性和特异性提供数据支持,也为鮰爱德华氏菌对宿主的致病性及感染途径研究提供更加便捷、可行的方法。
1 材料与方法
1.1 试验材料
鮰爱德华氏菌菌株zbl141由本实验室分离保存,含启动子的质粒PRUAL和含红色荧光蛋白基因的质粒pLVX-PAnzCherry-C1由本实验室保存。小鼠巨噬细胞RAW264.7购自广州市哈蓝生物科技有限公司,胎牛血清和DMEM培养基均购自美国Gibco公司,间氨基苯甲酸乙酯甲烷磺酸盐(MS-222)、1-苯基-2-硫脲为Sigma公司产品,大肠杆菌DH5a由本实验室保存。胶回收试剂盒Agarose GelDNA Purification Kit Ver.2.0、DNA Taq酶、dNTP、DNA分子Marker为宝生物工程(大连)有限公司产品,Plasmid Mini Kit I为Omega公司产品,基因组提取试剂盒(细菌)购自天根生化科技(北京)有限公司。
1.2 重组表达质粒pMDmCherry的构建
1.2.1 启动子和mCherry连接片段的扩增根据启动子和mCherry基因序列,利用Primer5.O软件设计2对扩增引物,由上海生工生物工程有限公司合成。用于扩增启动子基因的上游引物为PPS:5’-CGC-CTAGGATACGCACACCGTGGAAAC-3',下游引物为PPA:5’_CCrITGCTCACCArITITITCrITCCTCCA_3’;扩增mCherry基因的上游引物为MCS:5’-AG-GAAGAAAAAATGGTGAGCAAGGGTGA-3’,下游弓l物为MCA:5’-GCGTTCGAATTACTACTTGTACAGC-T-3’。
以质粒PRUAL为模板,PPS/PPA为引物,按照常规PCR方法扩增启动子基因序列,反应条件为95 cC 2 min;94℃30 s,56℃40 s和72℃90 s,35个循环,72 cc延伸10 min。以质粒pLVX-PAmCher-ry-CI为模板,MCS/MCA为引物,PCR扩增mCherry基因序列。琼脂糖凝胶电泳纯化回收PCR产物。
采用融合PCR方法,由于设计时PPA和MCS引物有一段重复序列,因而PCR扩增的启动子和mCherry基因就含有互补片段。以纯化的的启动子和mCherry产物1:1混合作为模板,常规PCR方法不加引物扩增10个循环,结束后直接添加PPS、MCA作为上下游引物,PCR方法扩增30个循环。琼脂糖凝胶电泳纯化回收PCR产物。
1.2.2 重组质粒连接、转化与鉴定 将方法1.2.1纯化回收的启动子和mCherry连接片段与pMD18-TVector克隆载体(TaKaRa) 16℃连接2h后,转化至DH5a感受态细胞,挑取阳性单菌落,送至上海生工生物工程有限公司测序确认,构建好的pMDmCherry质粒保存备用。
1.3 重组鮰爱德华氏菌的构建
参照杜以帅等[91的方法制备鮰爱德华氏菌电转感受态细胞。分别取100 ng构建的pMDmCherry质粒和70μl鮰爱德华氏菌感受态细胞于预冷的1mm电转杯中混匀,在2.1 kV、25 μF、400 Q条件下,快速电脉冲,脉冲时间为5 ms。电击结束后加入l ml BHI培养液,在28℃100 r/min条件下振荡培养3h。4℃.5 000 r/min离心10 min,弃掉800μl上清液,重悬细菌沉淀,取200μl转化产物涂布于含羧苄青霉素( Amp)抗性的BHI琼脂平板上,28℃培养48 h。
1.4 mCherry标记的鮰爱德华氏菌的筛选与鉴定
1.4.1 荧光检测取20μl的阳性克隆菌菌液均匀涂布在载玻片上,用TI-S荧光显微镜(Nikon,日本)下观察,同时以野生菌株作为阴性对照,挑选能发出强烈红色荧光信号的菌株。
1.4.2 PCR鉴定挑取发红色荧光的菌株,用引物MCS/MCA进行PCR扩增,反应条件同方法1.2.1,PCR产物在1.0%琼脂糖凝胶电泳回收后测序确认。
1.4.3 质粒稳定性试验参照李静等[1O]的方法并改进,将标记好的细菌在含有Amp的BHI中28℃培养过夜,接种量为111 000(体积比),每24 h转接1次。同时取200μl涂布于含Amp抗性的BHI琼脂平板上,28℃培养24 h后,分别挑取单菌落在荧光显微镜下检测,记录荧光数。质粒稳定率=发红色荧光菌落数/总菌落数×100%。
1.5 标记的鮰爱德华氏菌在感染斑马鱼仔鱼体内的动态分布检测
健康的雌性斑马鱼与雄性斑马鱼进行交配,收集所产的受精卵。受精后12 h的受精卵用0.20mmol/L的1一苯基-2-硫脲浸泡,抑制黑色素生成。取刚孵化出膜的仔鱼,经0. 020-/0 MS-222麻醉后,显微注射标记鮰爱德华氏菌菌液(lx10CFU/ml),控制显微注射液滴大小使注射体积为1 nl(即每尾仔鱼100 CFU),分别在感染后Oh、12 h、24 h用激光共聚焦显微镜观察标记细菌在鱼体内的动态分布情况,另外设一个未感染组作为阴性对照。
1.6标记鮰爱德华氏菌与小鼠巨噬细胞体外的相互作用
RAW264.7传代至8孔腔室载玻片中,每孔加入300μl新鲜DMEM细胞培养液(含10%胎牛血清),在5% CO2、37℃条件下培养20 h。为了便于观察,细胞贴壁50%左右时,加入30μl经麦氏比浊法稀释的标记鮰爱德华氏菌,终浓度为1×10CFU/ml,侵染时间分别为Oh、4h、24 h、48 h、72 h。侵染完成后用FluoView FV1200激光扫描共聚焦显微镜(Olympus Japan)进行观察,另外设一个未感染组作为阴性对照。
2 结果与分析
2.1 重组表达质粒pMDmCherry的构建
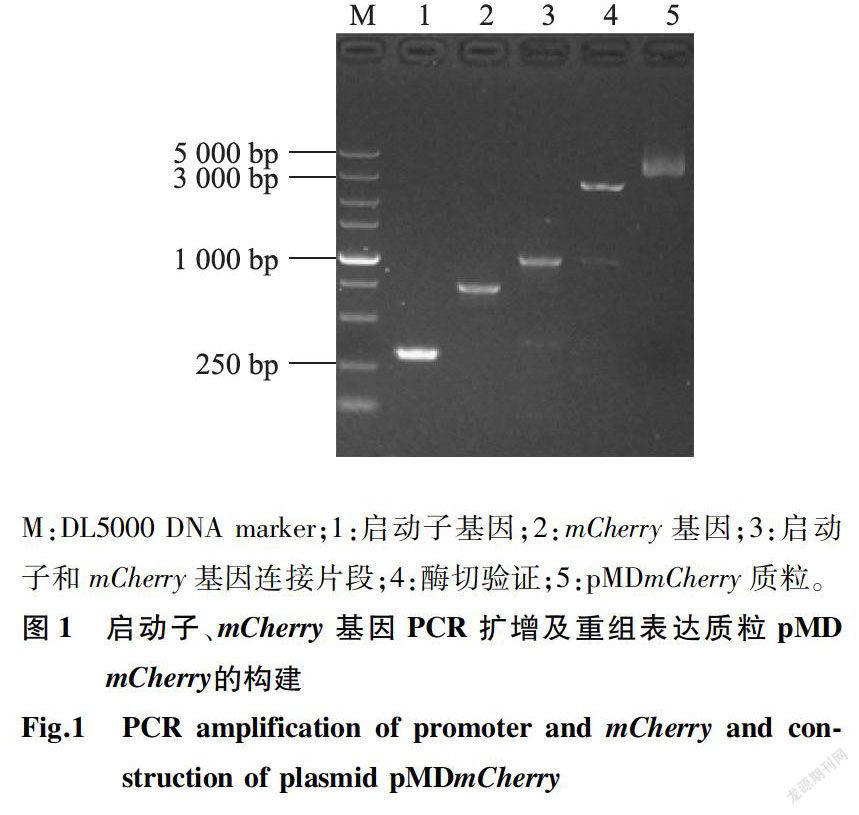
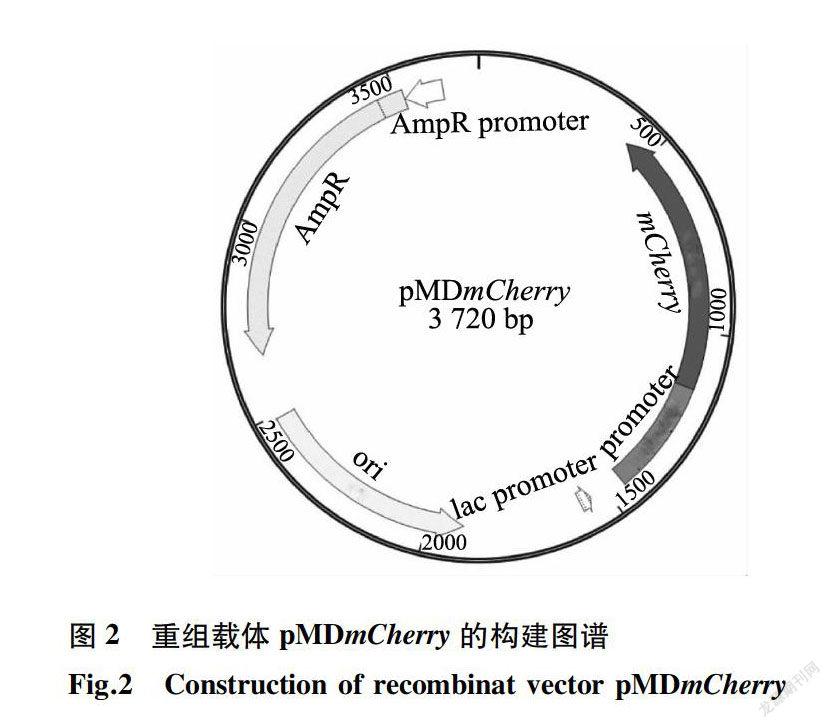
以质粒PRUAL为模板,用特异性引物扩增启动子基因,長度约300 bp(图1)。以质粒pLVX-PAmCherry-C1为模板,用特异性引物扩增mCherry基因,长度约700 bp;2个片段连接扩增长度为1 000bp左右(图1)。连接片段克隆至质粒pMD18-T,重组质粒双酶切后,切出大小约为1000 bp和2 700bp 2条DNA片段,分别与pMD18-T和连接片段基因大小一致(图1)。测序结果也显示连接片段碱基没有发生任何突变,即成功构建重组质粒pMDmCherry,构建图谱见图2。
2.2 mCherry标记的鮰爱德华氏菌的筛选与鉴定
阳性克隆菌用荧光显微镜观察,筛选出了稳定高效表达红色荧光蛋白的菌株(图3)。以筛选出的重组菌株为模板,用引物MCS/MCA进行PCR扩增,获得700 bp左右的片段,经过测序确认为mCherry基因片段;目前标记菌株已传至28代,所有菌落均发红色荧光,质粒稳定率可达100%。这些结果表明,重组质粒能够在鲴爱德华氏菌中稳定表达,红色荧光标记鮰爱德华氏菌构建成功。
2.3 标记鮰爱德华氏菌在感染斑马鱼仔鱼体内的动态分布
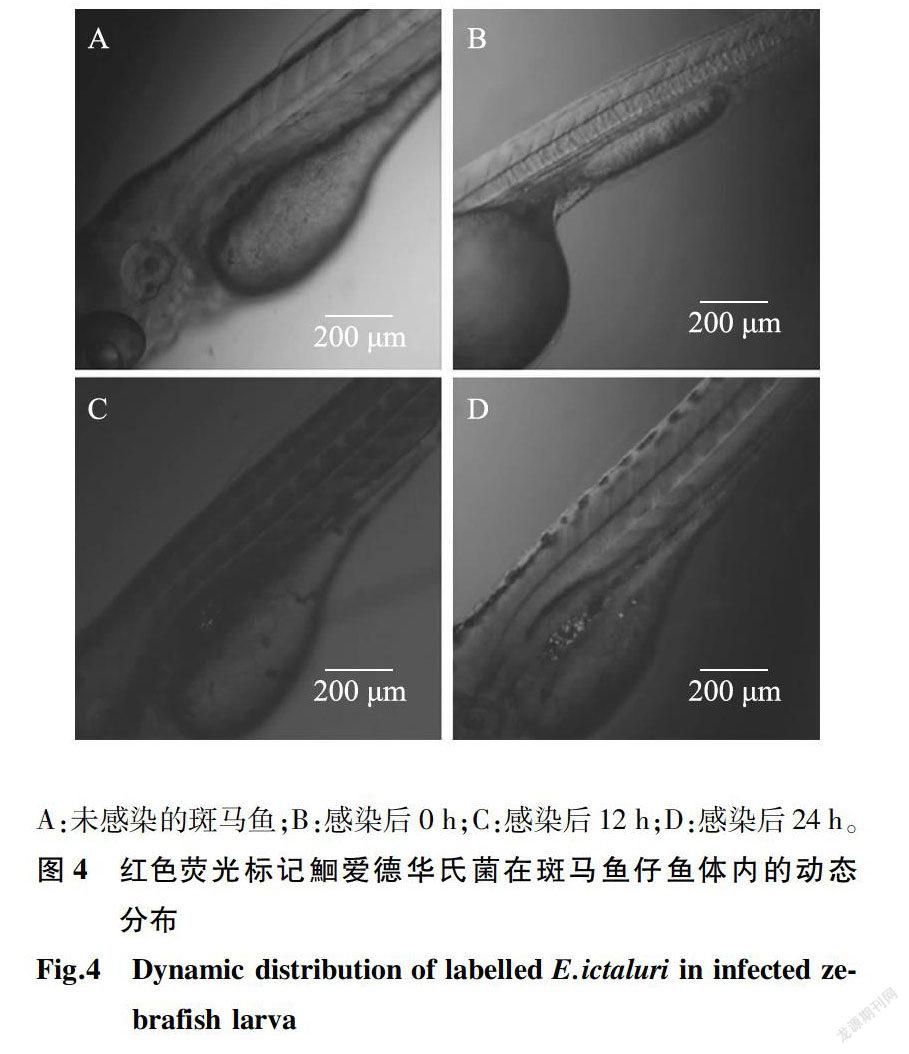
标记鮰爱德华氏菌显微注射感染斑马鱼仔鱼后,在感染部位及附近血管中呈现红色荧光(图4B);感染12 h,红色荧光增多,出现在仔鱼内脏部位(图4C);感染24 h,在内脏、肌肉及血液中都有大量红色荧光出现(图4D)。阴性对照组无荧光(图4A)。
2.4 标记鮰爱德华氏菌与小鼠巨噬细胞在体外的相互作用
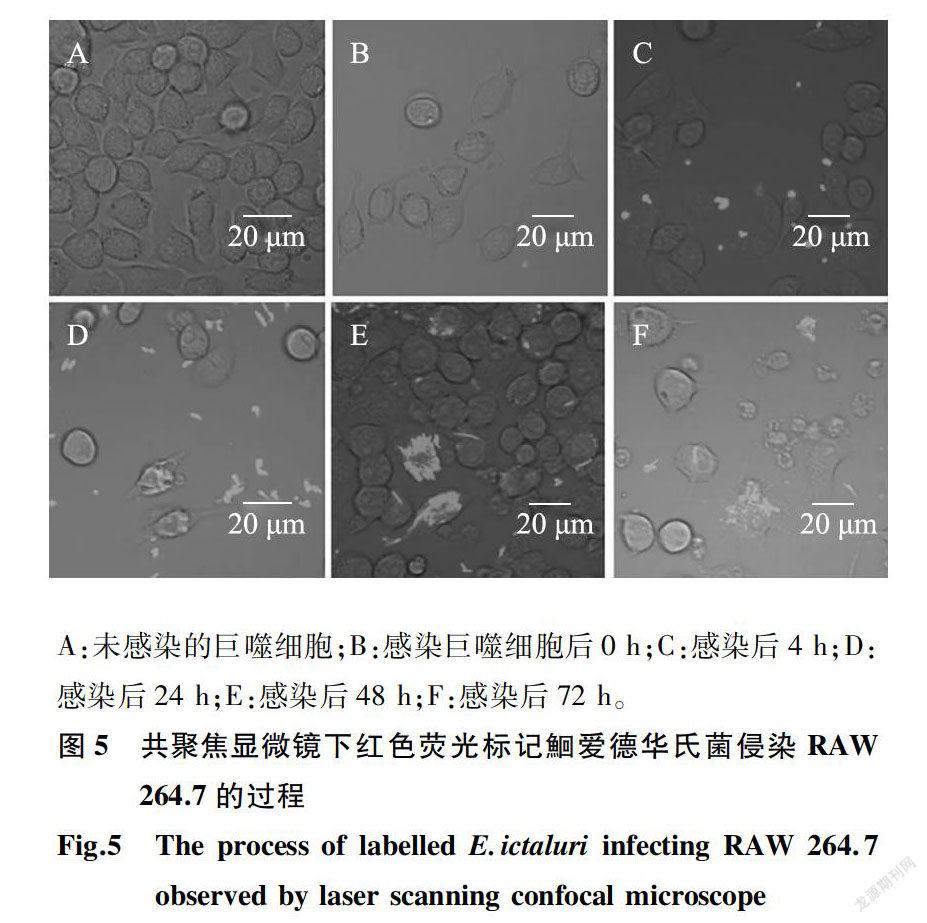
激光共聚焦显微镜观察发现,阴性对照组巨噬细胞贴壁生长,细胞形态呈较规则的圆形或椭圆形(图SA);感染Oh观察到红色标记细菌游离在培养基中,少量贴壁细胞开始变形,出现梭形细胞和多角形(图SB);感染4h,游离红色标记细菌聚集增多,少量巨噬细胞开始吞噬标记细菌(图5C);感染24 h游离标记细菌大量增加,部分巨噬细胞吞噬病原菌(图SD);感染48 h,游离标记细菌减少,巨噬细胞内标记细菌大量增殖,有少量细胞破裂死亡(图SE);感染72 h,标记细菌明显减少,巨噬细胞大量脱落死亡(图SF)。
3 讨论
应用现代生物技术对病原进行标记,观察病原侵染轨迹,是研究病原致病过程,了解病原宿主相互作用机理的有效手段[12]。本研究目的是探讨鮰爱德华氏菌在宿主体内的动态变化,研究病原菌与宿主的相互作用关系。为了跟踪病原菌活体状态下的致病过程,就需要选择一种既稳定又可靠的标记物。mCherry是一种来自于蘑菇珊瑚的红色荧光蛋白,相对于其他荧光蛋白,mCherry具有对光致漂白作用耐受、荧光亮度高、光稳定性卓越、可与绿色荧光蛋白共同标记研究对象等诸多优点,因而得到广泛的应用[13-15]。本研究利用电转化法将红色荧光蛋白基因mCherry导入zbl141菌株,得到的转化菌株保持了和野生型相似的菌落形态,插入基因能稳定遗传,能使mCherry蛋白在入侵巨噬细胞及宿主的菌株中表现出高强度表达,使鮰爱德华氏菌致病机理的相关研究变得更加便捷。
合适的质粒载体和启动子是决定mCherry重组质粒能否在鲴爱德华氏菌中高效稳定表达的关键因素。pMD18-T是一种广泛应用于高效克隆PCR产物的专用载体,这种载体拷贝数高,分子量较小,易于转化,但其自身不带启动子。启动子活性高低在很大程度上影响外源蛋白质的表达,研究结果表明庆大霉素抗性启动子( Gentamycin-resistancepromoter)能高效启动GFP在诺卡氏菌(ⅣocardLabrasiliensis)中的表达[16-17]。本试验中使用pMD18-T作为载体,利用庆大霉素抗性启动子融合mCherry基因构建重组表达质粒,转化至鮰爱德华氏菌中。荧光检测结果表明,构建的质粒能在鮰爱德华氏菌中高效表达,且多次传代后,标记细菌依然能够发出较强的红色荧光。
传统的研究病原菌在动物体内侵染的动力学方法,主要是通过病原菌感染动物后,用平板培养活菌计数测定不同器官中病原菌含量,这是一种间接的方法,不能直观反映病原菌的入侵情况,试验动物间个体差异也会影响试验结果的准确性[9];放射性标记的方法可以定量检测细菌,但是放射性物质对生物体有毒性,且这种方法也不能区分死亡的和活的细菌[18]。本研究中利用构建的红色荧光标记鮰爱德华氏菌后,通过显微注射感染斑马鱼仔鱼,由于斑马鱼仔鱼身体是透明的,在激光共聚焦显微镜下借助绿色激光,可清晰观察到斑马鱼体内的红色标记细菌,在不处死动物的情况下可对鱼体内病原菌的变化进行连续观察,在同一动物身上能获得一系列的动态试验数据,更为直观、综合地了解整个感染过程,提高研究的效率。
巨噬细胞是天然免疫应答的主要效应细胞,可以有效吞噬和消化外来物质,它是机体抵御外来微生物侵袭的第一道防线[19-20]。有研究报道鮰爱德华氏菌是一种兼性细胞内寄生菌,它可以在斑点叉尾鲴和南方鲇等鱼类宿主巨噬细胞中生存、繁殖[6,12],因而了解鮰爱德华氏菌与巨噬细胞的相互作用关系,特别是研究鮰爱德华氏菌在巨噬细胞内入侵、存活及繁殖机制是研究鮰爱德华氏菌致病性的关键。马慧等[22]将布鲁氏菌(Brucella melitensis)体外感染小鼠巨噬细胞后,利用绿色荧光标记的菌株结合红色荧光探针标记的溶酶体、内质网和高尔基体等细胞器,研究测定了侵染细菌与胞内各细胞器结合的时间,为布鲁氏菌在细胞内的生存繁殖及其分子机制提供了理论参考。目前有学者建立了与鮰爱德华氏菌同属的迟缓爱德华氏菌小鼠巨噬细胞感染模型,并用小鼠巨噬细胞进行了病原与宿主互作关系研究,发现了迟缓爱德华氏菌与宿主互作的新机制[ 23-24]。
参考文献:
[1]耿毅,汪开毓,范方玲,等,养殖黄颡鱼(Pelteobagrusfulvidraco)爱德华氏菌(Edwardsiella ictaluri)的分离鉴定与生物学特性研究[J].海洋与湖沼,2010,41(1):61-67.
[2]耿毅,汪开毓,陈德芳,等,鮰爱德华氏菌与鮰爱德华氏菌病[J].水产科技情报,2009,36(5):236-240.
[3] YE S, LIH,QIAO G,et al-First case of Edwardsiella ictaluriin-fection in China farmed yellow catfish Pelteobagrus fulvidraco[J].Aquaculture, 2009. 292(1):6-10.
[4]JARBOE H H.BOWSER P R,ROBINE‘I7EH R.Pathology asso-ciated with a natural Edwardsiella ictaluri infection in channel cat-fish( Ictalurus punctatus Rafinesque)[J].Journal of Wildlife Dis-eases. 1984. 20(4): 352-354.
[5] 肖洋,雷燕,唐紹林,等,养殖长吻鮠Leiocassis longirostris鮰爱德华氏菌Edwardsiella ictaluri的分离鉴定及药敏试验[J].水产学杂志,2015,28(1):39-44.
[6]黄小丽,李成伟,耿毅,等,南方鲇鮰爱德华氏菌感染的病理损伤特征及病原分布研究[J].中国预防兽医学报,2014,36(10):771-774.
[7]吴沛桥,巴晓革,胡海,等,绿色荧光蛋白CFP的研究进展及应用[J].生物医学T程研究,2009,28(1):83-86.
[8]吴超柱,徐凡,郜炎龙,等.荧光标记技术在生物学和医学研究中的应用[J].重庆理T大学学报(自然科学),2014,28(5):55-62.
[9]杜以帅,张丽娜,马晓娜,等.绿色荧光蛋白标记杀鲑气单胞菌的构建及其初步应用[J].海洋科学,2016,40( 12):30-35.
[10]李静,张晓露,刘永杰,等,绿色荧光蛋白基因标记嗜水气单胞菌的研究[J].畜牧与兽医,2009, 41(3):1-4.
[11] LING S H,WANG X H, LIM T M, et al.Green fluorescent pro-tein-tagged Edwardsiella tarda reveals portal of entry in fish[J].FEMS Microbiol Lett, 2001, 194(2): 239-243.
[12]高会会,侯立婷,李槿年,等,拟态弧菌的绿色荧光蛋白标记及其在感染草鱼体内的动态分布[J].水产学报,2015, 39(4): 557-565.
[13]KNODLER L A, VALLANCE B A, CELLI J, et al-Disseminationof invasive Salmonella via bacterial-induced extrusion of mucosalepithelia[ J]. Proc Natl Acad Sci USA, 2010, 107( 41):17733-17738.
[14] LAC.ENDUK E L,VALIDOV S,LAMERS G E. et al.Genetictools for tagging Gram-negative bacteria with mCherry for visualiza-tion in vitro and in natural habitats, biofilm and pathogenicitystudies[J].FEMS Microbiol Lett, 2010, 305(1):81-90.
[15]RUSSO P. ITURRIA I,MOHEDANO M L,et al-Zebrafish gutcolonization by mCherry-labejled lactic acid bacteria[J].Appl Mi-crobiol Biotechnol, 2015, 99(8):3479-3490.
[16] SALINAS-CARMONA M C,ROCHA-PIZANA M R.Constructionof aNocardia brasiliensis fluorescent plasmid to study Actinomyce-toma pathogenicity[J].Plasmid, 2011, 65(1):25-31.
[17]孫海烨,张梁,李由然,等,利用增强型绿色荧光蛋白研究不同启动子在乳酸克鲁维酵母中的功能[J].生物技术通报,2017,33(6):197-206.
[18] CHU W, LU C.In vivo fish models for visualizing Aeromonas hy-drophila invasion pathway using C.FP as a biomarker[J].Aquacul-ture, 2008, 277(3):152-155.
[19]罗文涓,杨剑,敖妙,等.PRRSV诱导猪体内肺泡巨噬细胞炎症模型的建立[J].南方农业学报,2018 ,49(1):155-163.
[20]倪黎纲,赵旭庭,王宵燕,等.姜曲海猪肺泡巨噬细胞的分离培养与鉴定[J].江苏农业科学,2017 ,45( 23):163-165.
[21]BOOTH N J,ELKAMEL A,THUNE R L.Intracellular replicationof Edwardsiella ictaluri in channel catfish macrophages[J].Journal of Aquatic Animal Health, 2011, 18(2): 101-108.
[22]马慧,苟亚峰,刘朋涛,等,绵羊布鲁氏菌侵染小鼠巨噬细胞的荧光表征与分析[J].石河子大学学报(自然科学版), 2014, 32(5):536-542.
[23]倪春山.重要海洋病原细菌迟钝爱德华氏菌感染小鼠及细胞的研究模型建立[D].上海:华东理T大学,2015.
[24] CHEN H, YANG D, HAN F,et al-The bacterial T6SS effectorEvpP prevents NLRP3 inflammasome activation by inhibiting theCa( 2+) -dependent MAPK-Jnk Pathway[J].Cell Host Microbe,2017,21(1):47-58.
