高考热点探析
2019-09-10骆小科
骆小科
摘要:近年来比较水溶液中离子浓度大小一直是高考化学的热点题型。解此类题型首先要明确离子浓度的基本概念,以及掌握两个平衡(弱电解质电离平衡、盐水解平衡)和三个守恒(电荷守恒、物料守恒、质子守恒)。
关键词:水溶液;离子浓度
决定溶液中离子浓度大小的因素很多,需综合考虑物质的量、溶解度、电离度、盐类的水解等因素。这个知识点之所以让学生觉得很难,是因为大多数学生对离子浓度的相关知识点没有做到系统的整理、知识点较为分散,导致学生做到相关题型时会比较慌张,不止如何下笔。本文对此问题进行了简要分析,并讲解了一些经典例题,以期为化学教师和即将参加高考的同学提供一些帮助。
一、离子浓度的基本概念、理论
我们首先要理解离子浓度,就要从弱电解质的电离平衡、区分强弱电解质和盐的水解平衡、水的电离平衡以及pH等相关知识点着手。
1.我们比较离子浓度的大小,要根据其电离的特点,进而强弱电解质区分开来,水溶液中强电解质完全电离,并且不会以电解质分子的形式存在。例如:在HC1溶液中:c(H)>c(Cl)>c(OH);在NaOH溶液中的OH离子浓度大于Na大于H,而NaC1溶液中的:Na离子浓度和Cl浓度相同,而 H 离子浓度与OH浓度相同,并且前者要大于后者。
在水溶液中,能夠发生电离的弱电解质只有少数,例如:CHCOOH在25°0.1mol/L的状态下,其电离度只有1.32%,溶液中包括少量H和CHCOO离子,非常少的OH离子,而HO和CHCOOH分子居多。所以离子浓度大小排序应为,c(CHCOOH)>c(H)>c(CHCOO)>c(H)>c(OH);多元弱酸如HCO还要考虑分步电离:HCO⇋H+HCO;HCO⇋H+CO。弱电解质的电离程度很小,且多元弱酸分步进行电离,依次减弱,以第一步为主,所以,其离子浓度大小排序为c(HCO)>c(H)>c(HCO)>c(CO),c(H)>c(OH)。
2.我们要通过盐类的水解,进而对离子浓度的大小进行比较,最终明白被水解的是哪些物质。盐类水解程度很小,多元弱酸根阴离子,是通过分步进行水解的,从第一步开始逐级减弱。如:NaCO离子浓度大小排序为c(Na)>C(CO3)>c(OH)>c(HCO)>c(HCO),c(OH)>c(H)。
要想将比较离子浓度大小这部分知识点吃透,就要深刻理解水解和电离的物质都是哪些。一般情况下,没有必要水解的是弱酸电离出的酸根离子,没有必要考虑电离的是弱酸以及正盐水解产生的酸式根,然而离子浓度较大的,如弱酸的酸式盐溶液中的酸式根,就要对电离和水解都了解。
二、电离、水解的主次问题
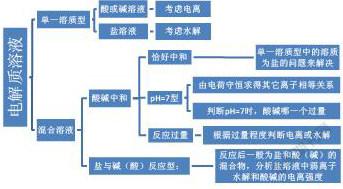
在溶液中通常存在着强电解质的电离、弱电解质的电离、弱根离子(弱酸的酸根或弱碱的阳离子)的水解、水的电离等几种情况,由于强电解质在水溶液中完全电离,故这一步电离产生的离子在溶液中通常是最多的,弱电解质的电离、弱根离子的水解程度相差不多,这两种情况产生离子的多少需要根据具体情况而定,水的电离最微弱,水电离产生的离子通常最少。解题思路如图所示。

三、电解质溶液中的守恒关系
1.电荷守恒:
正电荷总数等于负电荷总数。
例如在HS溶液中电荷守恒关系表现为:在HS中存在的阳离子有H,阴离子有HS,S,OH,故此溶液的电荷守恒关系为:c(H)=c(HS)+c(OH)+2c(S)。并且一定不要忘记c(S)前的系数,这里考察电荷守恒等式成立的前提条件的理解,所以这里需要注意:电荷守恒中,阳离子和阴离子所带的正负电荷数是一定相等的,所以等式中离子前面的系数就是离子所带电荷。
2.原子守恒(物料守恒):
离子会通过电解质溶液的电离或水解,转变为其他离子或分子的形式,尽管如此,处于离子或分子中的特殊元素,其原子的总数没有因其发生变化,例如NaCO在0.1mol/L的溶液状态下原子守恒关系式表现为:固体状态下NaCO中,Na与C的原子个数比为2:l,NaCO溶于水后,CO发生两步水解:第一步:CO+HO=HCO+OH,第二步:HCO+HO=HCO+OH,溶液中C原子分別在CO,HCO,HCO中存在。根据原子守恒有c(Na)=2{c(CO)+(HCO)+(HCO)}。
3.质子守恒:
分子或离子在电解质溶液中,得到质子(H)的物质的量应等于失去质子(H)的物质的量,例如在Na2S溶液中,水电离产生H,OH两种离子,OH以离子形式存在于溶液中,H转移到三个部分:仍然以H形式存在,与S结合形成HS,以及与HS结合生成HS。最终得出c(OH)=c(H)+c(HS)+2c(HS)。
例题:NaHCO溶液中比较离子浓度的大小,正确的选项为( )
A:c(H)>c(Na)>c(CO)>c(HCO)>c(OH)
B:c(HCO)>c(Na)>c(CO)>c(OH)>c(H)
C:c(HCO)>c(Na)>c(OH)>c(H)>c(CO)
D:c(Na)>c(HCO)>c(OH)>c(CO)>c(H)
解析:溶液中NaHCO发生电离:NaHCO=Na+HCO,因为是强电解质,所以完全电离,故这一步骤产生的Na和HCO最多,又因为HCO会发生水解,所以c(Na)>c(HCO)。HCO即发生电离:HCO=H+CO,也同时发生水解:HCO+HO=HCO+OH,由于NaHCO在水中显碱性,所以产生的离子水解要大于电离,即c(OH)>c(CO)。HCO,电离产生的H,CO的浓度是相等的,比较两者浓度大小应该考虑水的电离:HO=H+OH因为水电离也会产生H,所以c(H)>c(CO)。故此题选D。
比较离子浓度大小不但考查学生对离子浓度大小的顺序的掌握程度,同时还考察学生对溶液中各种守恒(电荷守恒、原子守恒、质子守恒等)关系等知识的了解。这种综合性题目使解题需要一定的灵活性和技巧性,从近年来高考的命题趋势变化来看,溶液中离子浓度大小的比较属于主流试题,今后仍然会是高考的热点题目。
参考文献:
[1] .王进娥.溶液中离子浓度大小的比较[J].新课程(教育学术),2011(2).
[2] .刘海洋.离子浓度大小的比较[J].成才之路,2011(5):43-43.
[3] .李玉芹.浅析离子浓度大小比较[J].数理化解题研究,2011(3):57-59.
[4] .程锋利.浅析高考热点——离子浓度大小比较[J].西部大开发旬刊,2010(8):84-84.
[5] .王瑾.高考热点题型分析——离子浓度大小的比较[J].考试(教研版),2008(2):82-82.
(作者单位:广东省惠州市博罗县博罗中学)
