EB病毒相关伯基特淋巴瘤差异基因表达分析
2019-09-10郑雨薇肖华王维文刘雯
郑雨薇 肖华 王维文 刘雯

[摘要] 目的 從分子层面分析EB病毒(EBV)相关伯基特淋巴瘤(BL)的差异表达基因(DEGs),为其诊疗提供新的思路。方法 从美国国立生物技术信息中心(NCBI)获取EBV阳性与阴性BL相关基因芯片数据集GSE100458。通过morpheus筛选出DEGs,分别将上调和下调基因输入Database for Annotation Visualizationand Integrated Discovery(DAVID)数据库,进行GO分析;进一步采用cytoscape筛选出10个TOP基因,实时荧光定量PCR方法验证其在EBV阳性与阴性BL细胞系中表达情况。结果 分析EBV阳性和EBV阴性的BL细胞系的前400个DEGs,包括200个上调基因和200个下调基因,上调基因主要集中在生长因子活性通路、肝素结合通路、细胞外间隙通路;下调基因主要集中在伽马微管蛋白结合通路、内质网膜通路、逆行性小囊泡运输通路。对DEGs进行蛋白质相互作用分析后,筛选出核心基因乙酰辅酶A羧化酶β(ACACB)等10个基因。实时荧光定量PCR检测结果显示,在EBV阳性与阴性BL组间,CDH1、PRPF19、UBE2N、F2、H6PD、VEGFA、YARS共7个基因的转录表达差异有统计学意义(t=3.878~32.601,P<0.05),ACACB、CTTN、IGF1共3个基因表达差异无统计学意义(P>0.05)。结论 EBV感染可导致宿主细胞基因表达谱的改变,生物信息学分析法可初步筛选出DEGs和相互作用的蛋白,为进一步深入研究提供有价值的信息和思路。
[关键词] 疱疹病毒4型;伯基特淋巴瘤;基因表达;生物信息学
[中图分类号] R373.9 [文献标志码] A [文章编号] 2096-5532(2019)04-0423-06
[ABSTRACT] Objective To analyze the differentially expressed genes (DEGs) in EB virus (EBV)-associated Burkitt lymphoma (BL) at molecular level, and to provide new ideas for its diagnosis and treatment. Methods The EBV-positive and-negative BL-related gene microarray data set GSE100458 was obtained from the National Center for Biotechnology Information (NCBI). DEGs were screened out by Morpheus, and the up-regulated and down-regulated genes were entered into the Database for Annotation Visualization and Integrated Discovery (DAVID) for GO analysis. Ten top genes were identified by cytoscape, and their expression in EBV-positive and EBV-negative BL cell lines was verified by real-time fluorescence quantification PCR. Results The top 400 DEGs of EBV-positive and EBV-negative BL cell lines were analyzed, including 200 up-regulated genes and 200 down-regulated genes. The up-regulated genes were mainly concentrated in the growth factor activity pathway, heparin binding pathway, and extracellular gap pathway. The down-regulated genes were mainly concentrated in the gamma-tubulin binding pathway, endoplasmic reticulum pathway, and retrograde small vesicle transport pathway. After protein interaction analysis of DEGs,10 core genes such as acetyl coenzyme A carboxylase beta (ACACB) were screened out. Quantitative real-time PCR results showed that there were significant differences in transcriptional expression of 7 genes (CDH1, PRPF19, UBE2N, F2, H6PD, VEGFA, and YARS) between EBV-positive and EBV-negative BL groups (t=3.878-32.601,P<0.05), and there were no significant diffe-rences in the expression of ACACB, CTTN, and IGF1 (P>0.05). Conclusion EBV infection can lead to changes in the gene expression profiles of host cells. Bioinformatics analysis can preliminarily screen out DEGs and interacting proteins, providing valuable information and ideas for further research.
[KEY WORDS] herpesvirus 4, human; Burkitt lymphoma; gene expression; computational biology
EB病毒(EBV)是重要的DNA肿瘤病毒,与伯基特淋巴瘤(BL)、霍奇金病、某些T细胞源和B细胞源性非霍奇金淋巴瘤、鼻咽癌以及胃癌等多种人类淋巴细胞及上皮细胞肿瘤的发生发展均密切相关[1]。地方性BL感染的EBV有两种不同类型的毒株,即1型和2型EBV,两种类型毒株特异性有所不同[2]。1型EBV毒株广泛分布在世界各地,尽管淋巴细胞样细胞系中1型EBV转化率比2型高, 但2型EBV在非洲地区更为常见;两种类型EBV均在非洲地方性BL中被发现,并且流行于撒哈拉以南的非洲健康人群中。然而,尚无研究对比初发地方性BL中1型和2型EBV的突变情况,病毒变异是否影响肿瘤的发生尚不清楚[3]。基因表达汇编(GEO)是基因表达数据资源库,其中汇聚大量的表达谱数据,是多种生物信息学分析均需要使用的重要资源[4-5]。本文通过GEO数据库得到有意义的基因,进而验证EBV影响的BL的发生机制。
1 资料与方法
1.1 数据收集
从美国国立生物技术信息中心(NCBI)GEO数据库下载GSE100458基因表达谱,包括4种细胞系的14个克隆,其中Mutu、Akata和Awia细胞系分别包含2个EBV阳性和2个EBV阴性克隆;Elijah细胞系包含1个EBV阳性和1个EBV阴性克隆。GSE100458基于GPL23270 [HG-U133_Plus_2] Affymetrix Human Genome U133 Plus 2.0 Array平台分析得来。
1.2 差异表达基因(DEGs)鉴定
采用R语言和Limma包筛选出DEGs,符合P值<0.01和|logFC|≥2标准。通过morpheus进行基因表达聚类分析,根据噪声比大小筛选出DEGs[6]。
1.3 DEGs的GO分析
获得DEGs后,将DEGs列表提交到线上软件Database for Annotation,Visualization and Integrated Discovery(DAVID,https://david.ncifcrf.gov)v6.8,分别进行上调基因和下调基因的GO分析[7]。GO(http://www.geneontology.org)是分析DEGs和基因产物功能的工具,包括生物过程、分子功能和细胞成分[8]。最终,通过GO分析选择被强化的DEGs的功能,以P<0.05为差异有统计学意义。
1.4 蛋白质-蛋白质相互作用(PPI)网络分析
采用Search Tool for theTetrieval of Interacting Genes(STRING)數据库分析DEGs之间的相互作用关系,以解释更深刻的分子机制。首先将DEGs列表提交到STRING上,采用组合分数>0.4选取实验证实的相互作用,然后用cytoscape软件分析构建PPI网络系统。根据蛋白质与蛋白质相互作用度筛选出顶级中枢基因。
1.5 DEGs表达
1.5.1 细胞培养 将EBV阳性淋巴瘤细胞系Raji、Daudi,EBV阴性淋巴瘤细胞系Ramos,置于37 ℃、含体积分数0.05的CO2、99%湿度培养箱常规培养,细胞汇合度达90%时弃培养液,收集2个不同批次细胞用于RNA提取。
1.5.2 RNA提取 用TRIzol法提取3种细胞系RNA,RNA浓度在200~1 000 μg/L、纯度A260/A280在2.0左右为可使用范围[9]。
1.5.3 cDNA合成 采用cDNA逆转录试剂盒灭活基因组DNA,反应体系为10 μL,内含:5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,RNA 1 μg,剩余用RNase Free dH2O补足。反应条件42 ℃、2 min。向上述反应体系中加入:PrimeScript RT Enzyme Mix 1 μL,RT Primer Mix 1 μL,5×Prime Script Buffer 4 μL,RNase Free dH2O 4 μL;反应条件为:37 ℃孵育15 min,85 ℃反应5 s。
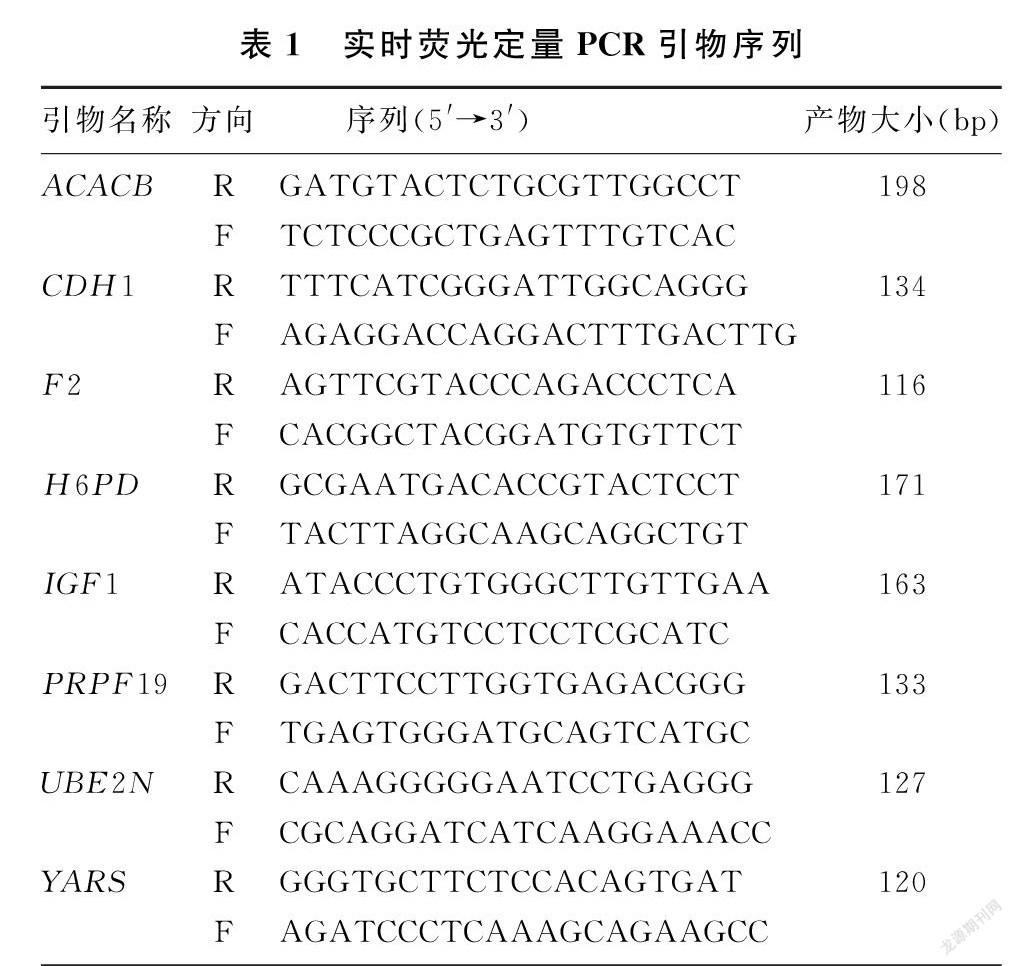
1.5.4 实时荧光定量PCR 扩增引物在Pubmed上进行设计,引物序列见表1。反应体系为20 μL,包括:SYBR GreenⅠreal-time PCR Master Mix 10 μL,上下游引物分别0.5 μmol/L,cDNA模板2 μL,无RNase水6 μL。PCR扩增条件为:95 ℃预变性15 min;94 ℃、15 s,60 ℃、 30 s,70 ℃、30 s,扩增40个循环,每次循环结束后进行荧光检测。同时扩增内参照基因GAPDH以检测RNA的完整性和反转录效果。扩增结束后,95 ℃、1 min,55 ℃、30 s后逐步升温至95 ℃进行溶解曲线分析,确定扩增产物的特异性。
1.6 统计学分析
采用GraphPad Prism(version 6.01)软件进行统计学分析,计量资料结果以±s形式表示,数据间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 聚类分析热图
从GEO数据集中筛出的GSE100458由7个EBV阳性BL细胞系和7个EBV阴性BL细胞系组成,根据Morpheus软件,以噪声比绝对值≥0.5的标准,筛选出200个上调基因和200个下调基因。DEGs聚类表达谱见图1A。
2.2 GO分析
利用DAVID在线软件对400个DEGs分类分析结果显示,上调基因主要参与调控生长因子活性通路(GO:0008083)[10]、调控肝素结合通路(GO:0008201)、细胞外间隙通路(GO:0005615)、片状伪
2.3 PPI分析
在蛋白质间相互作用图中,颜色越亮、面积越大,说明与其他蛋白质关联度越大[11](图1D)。从中筛选10个关联度最大的蛋白,其全称、缩写、关联度见表2。
2.4 基因表达验证
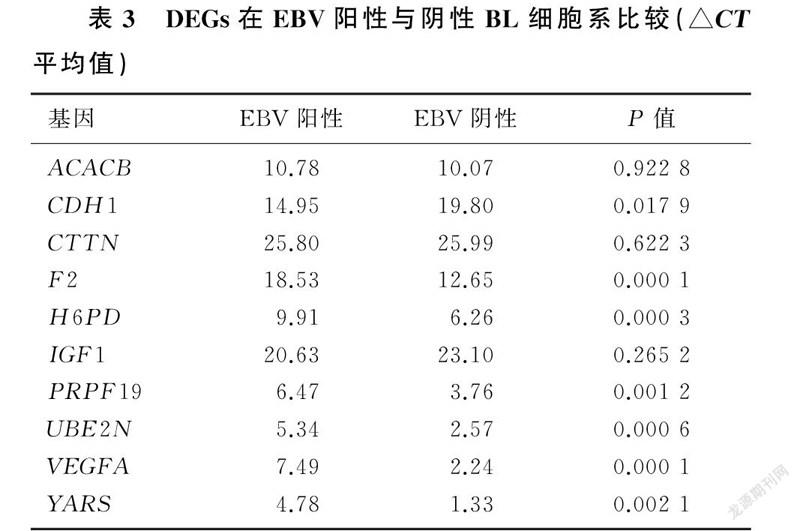
实时荧光定量PCR结果显示,EBV阳性与阴性BL细胞系中ACACB、CTTN、IGF1表达差异无统计学意义(t=0.103~1.294,P>0.05),与网络数据不相符;CDH1、PRPF19、UBE2N表达差异有统计学意义(t=3.878~9.730,P<0.05),网络数据和实验数据相符合;F2、H6PD、VEGFA、YARS表达差异均有统计学意义 (t=7.055~32.601,P<0.01),网络数据和实验数据不一致。见表3。
3 讨 论
生物信息学分析可为认识蛋白结构及功能研究提供线索。随着生物技术和信息技术的发展,新的生物信息学具有经济、便利、快捷的特点,可以为科学研究提供有价值的信息。本研究利用生物信息学软件,对EBV阳性和EBV阴性的BL细胞系相关特征进行了研究,初步筛选出表达差异基因,研究蛋白质与蛋白质之间相互作用的关系,为深入开展相关研究提供了理论依据。
本实验研究表明,上调基因参与的生长因子活性通路(GO:0008083)刺激肿瘤的发生。孕酮受体为乳癌生长因子活性的潜在指标,有研究表明原发性乳癌孕酮受体缺乏与预后不良相关,低孕酮受体状态可作为乳癌肿瘤细胞中活化生长因子信号传导的指标,因此可以用于侵袭性肿瘤表型对抗激素治疗[12]。据此,上调基因参与的生长因子活性通路可能对BL的治疗和预后有着重要的作用。上调基因参与的调控肝素结合通路(GO:0008201)可促进神经母细胞瘤分化[13]。本文研究中的上调基因参与调控的肝素结合通路也可能与促进BL的分化生长有关,刺激了肿瘤的发生。上调基因参与的细胞外间隙通路(GO:0005615)为细胞之间的电耦合,由称为间隙连接的质膜相互作用而介导[14]。哺乳动物心脏的主要连接蛋白是连接蛋白43,连接蛋白43含量的降低是心脏病的一般致病特征,并且其他连接蛋白类型的表达水平的变化可能有助于改变患病心脏的电生理功能。细胞外间隙通路影响细胞的电生理功能,这是否意味着电生理功能也对BL的发生发展有着重要作用,还需要进一步的实验证明。上调基因参与片状伪足通路(GO:0030027),转移到远处位点的肿瘤细胞在其通过血管期间受到血流动力学剪切力,片状伪足通路可以减少其通过血液转移的阻力[15]。BL通过淋巴途径转移,片状伪足通路对淋巴液的剪切力可能对其也有一定的影响,导致了BL的转移,上调了肿瘤的发生发展。上调基因参与钙介导的信号通路(GO:005084),有研究结果表明线粒体裂变与细胞溶质钙信号通路形成正反馈环,促进肝细胞癌细胞自噬[16]。线粒体裂变与细胞溶质钙信号通路形成的正反馈环也可能参与了BL细胞的自噬,但这并不一定意味着其会下调BL的发生。上调基因参与钾离子跨膜运输通路(GO:0071805),有学者进行的荧光和膜片钳实验表明,电压可以驱使分子插入和离开脂质双层,从而打开和关闭钾离子的传输,进而影响肿瘤的形成[17]。下调基因参与伽马微管蛋白结合通路(GO:0043015),在果蝇卵母细胞分裂的前中期(Ⅰ期)中双极纺锤体组装和动粒微管附着需要伽马微管蛋白通路[18-19]。这表明伽马微管蛋白通路可能与祖细胞的分裂增殖有关,进而抑制肿瘤的生成。下调基因参与poly(A) RNA结合通路(GO:0044822),Poly(A)RNA结合蛋白以高亲和力和特异性结合聚腺苷RNA,并出现了许多新的作用,这些作用有助于基因表达的微调[20]。结合本研究结果认为其应该与BL的下调有关。下调基因参与内质网膜通路(GO:0005789),有研究表明萝卜硫素是一种天然存在的化学预防剂,通过线粒体介导的细胞凋亡有效抑制肝细胞癌细胞的增殖,内质网膜通路被认为可能是萝卜硫素诱导肝癌细胞凋亡的最重要机制[21]。内质网膜通路参与了肿瘤细胞凋亡,这与BL发生的下调有关。下调基因参与蛋白酶体调节粒子通路(GO:0008541),蛋白质稳态失衡导致细胞功能障碍、细胞死亡和病变。真核生物中的蛋白质降解途径主要分为蛋白酶体介导的降解和溶酶体介导的降解,目前蛋白酶体可作为癌症的治疗靶标[22],今后BL的治疗可能要与蛋白酶体调节粒子通路相联系。下调基因参与逆行性小囊泡运输通路(GO:0006890),高尔基体是分泌途径的中心分选和生物合成中枢,并且使用囊泡运输来回收酶[23]。若逆行性小囊泡运输通路机制发生损伤,则高尔基体功能出现损伤进而影响肿瘤的发生发展。
本文通过对DEGs进行功能和通路分析及蛋白质相互作用分析,筛选出ACACB、VEGFA、YARS、IGF1、CTTN、F2、CDH1、UBE2N、H6PD以及PRPF19基因作为该网络的关键基因,这些关键基 因主要参与了生长因子激活信号通路、钾离子的跨膜转运信号通路、伽马微管蛋白结合信号通路等,并可能在BL的发生发展过程中发挥重要的作用。CDH1、PRPF19、UBE2N在网络数据中表现出的差异与本文结果相符合。CDH1为抑癌基因,其突变与多种肿瘤相关,CDH1敲除可能会影响乳腺上皮细胞的增殖分化,干扰T细胞的激活化生[24]。推测CDH1可能影响了T细胞的代谢通路,与免疫應答通路有相互作用关系,其突变大大增加了BL发生的可能性。PRPF19突变可导致RNA末端的剪接紊乱并下调RNA表达,推测EBV可能通过抑制肿瘤细胞中PRPF19的表达,干扰正常细胞的分化代谢,进而影响BL细胞的凋亡[25]。UBE2N是一种泛素结合酶,泛素蛋白酶体途径是目前己知的所有真核生物体内具有高度选择性的最为重要的蛋白质降解途径,其突变在BL中影响了蛋白质的降解[26]。本文结果显示,F2、H6PD、VEGFA、YARS的表达差异有统计学意义,但是其网络数据分析的结果和实验验证结果不相符,可能与样本量不足有关。F2为一种凝血因子,EBV可抑制其在BL中的表达,影响凝血因子的级联反应,可能与部分BL病人的出血倾向有关[27]。本文结果还显示,H6PD在EBV阳性细胞系中低表达,H6PD与细胞中物质代谢有关,EBV可能通过抑制其表达,导致正常细胞中物质代谢紊乱,影响BL细胞的凋亡。VEGF是一种血管内皮细胞的特异性有丝分裂原,在体外可促进血管内皮细胞的生长,在体内可诱导血管增生,增加BL的新生血管。YARS是氨酰-tRNA合成酶,参与tRNA的合成,影响BL的核酸合成代谢,对BL可能有重要意义[28]。
綜上所述,EBV在BL中引起的上述基因表达差异可能影响BL的细胞间连接而影响其转移,影响DNA的损伤后修复功能而影响BL的发生。但本文研究由于样本量的限制,结果可能存在一定的局限性,需要扩大样本量,进一步探讨与BL发生发展相关的DEGs。
[参考文献]
[1] LICCIARDI F, VAN DEN BOOGAARD M, DELLE PIANE M, et al. EBV-related hodgkin lymphoma in an ICF2 patient: is EBV susceptibility a hallmark of this ICF subtype[J]? J Clin Immunol, 2019,39:1-3.
[2] KAYMAZ Y, ODUOR C I, YU H B, et al. Comprehensive transcriptome and mutational profiling of endemic burkitt lymphoma reveals EBV type-specific differences[J]. Molecular Cancer Research, 2017,15(5):563-576.
[3] UCCINI S, AL-JADIRY M F, CIPPITELLI C A, et al. Burkitt lymphoma in Iraqi children: a distinctive form of sporadic disease with high incidence of EBV+ cases and more frequent expression of MUM1/IRF4 protein in cases with head and neck presentation[J]. Pediatric Blood & Cancer, 2018,65(12): e27399.
[4] WANG Anping, ZHANG Guibin. Differential gene expression analysis in glioblastoma cells and normal human brain cells based on GEO database[J]. Oncology Letters, 2017,14(5):6040-6044.
[5] 董政权,魏垒. 骨关节炎基因差异谱的生物信息学分析[J]. 中国组织工程研究, 2019,23(3):335-340.
[6] CHAI Yi, TAN Feng, YE Sumin, et al. Identification of core genes and prediction of miRNAs associated with osteoporosis using a bioinformatics approach[J]. Oncology Letters, 2019,17(1):468-481.
[7] GAUDET P, DESSIMOZ C. Gene ontology: pitfalls, biases, and remedies[J]. Methods Mol Biol, 2016,1446:189-205.
[8] VESZTROCY A W, DESSIMOZ C. A gene ontology tutorial in python[J]. Methods Mol Biol, 2017,1446:221-229.
[9] 赵丹蕊. EB病毒相关胃癌中RASSF1A基因甲基化状态和表达的研究[D]. 青岛:青岛大学, 2017.
[10] LEE H Y, LI C C, HUANG C N, et al. INHBA overexpression indicates poor prognosis in urothelial carcinoma of urinary bladder and upper tract[J]. Journal of Surgical Oncology, 2015,111(4):414-422.
[11] GROMIHA M M, YUGANDHAR K, JEMIMAH S. Protein-protein interactions: scoring schemes and binding affinity[J]. Current Opinion in Structural Biology, 2017,44:31-38.
[12] CUI X J, ZHANG P, DENG W L, et al. Insulin-like growth factor-Ⅰ inhibits progesterone receptor expression in breast cancer cells via the phosphatidylinositol 3-kinase/akt/mammalian target of rapamycin pathway: progesterone receptor as a potential indicator of growth factor activity in breast[J]. Molecular Endocrinology, 2003,17(4):575-588.
[13] GAVIGLIO A L, KNELSON E H, BLOBE G C. Heparin-binding epidermal growth factor-like growth factor promotes neuroblastoma differentiation[J]. FASEB Journal, 2017,31(5):1903-1915.
[14] SEVERS N J. Pathophysiology of gap-junctions in heart-disease[J]. Journal of Cardiovascular Electrophysiology, 1994,5(5):462-475.
[15] XIONG Niya, LI Shun, TANG Kai, et al. Involvement of caveolin-1 in low shear stress-induced breast Cancer cell motility and adhesion: roles of FAK/Src and ROCK/p-MLC pathways[J]. Biochimica et Biophysica Acta-Molecular Cell Research, 2017,1864(1):12-22.
[16] HUANG Qichao, CAO Haiyan, ZHAN Lei, et al. Mitochondrial fission forms a positive feedback loop with cytosolic Calcium signaling pathway to promote autophagy in hepatocellular carcinoma cells[J]. Cancer Letters, 2017,403:108-118.
[17] SI Wen, LI Zhanting, HOU Junli. Voltage-driven reversible insertion into and leaving from a lipid bilayer: tuning transmembrane transport of artificial channels[J]. Angewandte Chemie-International Edition, 2014,53(18):4578-4581.
[18] HUGHES S E, BEELER J S, SEAT A, et al. Gamma-Tubulin is required for bipolar spindle assembly and for proper kinetochore microtubule attachments during prometaphase Ⅰ in drosophila oocytes[J]. PLoS Genetics, 2011,7(8): e1002209.
[19] MOUTINHO-PEREIRA S, DEBEC A, MAIATO H. Microtubule cytoskeleton remodeling by acentriolar microtubule-organizing centers at the entry and exit from mitosis in Drosophila somatic cells[J]. Mol Biol Cell, 2009,20(11):2796-2808.
[20] WIGINGTON P, WILLIAMS C. Poly(a)RNA-binding proteins and polyadenosine RNA:new members and novel functions[J]. Wiley Interdisciplinary Reviews RNA, 2014,5(5):601-622.
[21] ZOU Xiang, QU Zhongyuan, FANG Yi, et al. Endoplasmic reticulum stress mediates sulforaphane-induced apoptosis of HepG2 human hepatocellular carcinoma cells[J]. Molecular Medicine Reports, 2017,15(1):331-338.
[22] JANG H H. Regulation of protein degradation by proteasomes in cancer[J]. J Cancer Prev, 2018,23(4):153-161.
[23] COTTAM N P, UNGAR D. Retrograde vesicle transport in the Golgi[J]. Protoplasma, 2012,249(4):943-955.
[24] 周學付,陈国星,彭晓飞. 粤北地区遗传性弥漫型胃癌与CDH1种系突变关系初探[J]. 消化肿瘤杂志(电子版), 2018,10(2):101-104.
[25] ZHANG Yuzhe, LI Yu′e, LIANG Xiao, et al. Crystal structure of the WD40 domain of human PRPF19[J]. Biochemical and Biophysical Research Communications, 2017,493(3):1250-1253.
[26] DIKSHIT A, ZHANG J Y. UBE2N plays a pivotal role in maintaining melanoma malignancy[J]. Oncotarget, 2018,9(100):37347-37348.
[27] GIROLAMI A, COSI E, FERRARI S, et al. Prothrombin: another clotting factor after FV that is involved both in blee-ding and thrombosis[J]. Clinical and Applied Thrombosis-Hemostasis, 2018,24(6):845-849.
[28] SADJJADI S M, EBRAHIMIPOUR M, SADJJADI F S. Comparison between Echinococcus granulosus sensu stricto (G1) and E. canadensis (G6) mitochondrial genes (cox1 and nad1) and their related protein models using experimental and bioinformatics analysis[J]. Computational Biology and Chemistry, 2019,79(79):103-109.
(本文编辑 黄建乡)
