电刺激法评价1型糖尿病小鼠勃起功能的应用效果
2019-09-10林向楠李红光李际涛李磊金海荣马忠堂
林向楠 李红光 李际涛 李磊 金海荣 马忠堂
[摘要]目的 探讨电刺激阴茎海绵体神经测定海绵体内压法(简称电刺激法)在1型糖尿病小鼠模型勃起功能障碍评价中的应用效果。方法 将30只SPF级8周龄C57BL6J小鼠随机分为对照组(n=10)和实验组(n=20),实验组小鼠给予腹腔注射链脲佐菌素(STZ)诱导1型糖尿病模型,随机选取10只作为后续实验对象。8周后,电刺激小鼠阴茎海绵体神经,记录勃起时的海绵体内压最大值(ICPmax),间隔10 min,重复测量3次。记录电刺激之前小鼠的平均系统血压(MSBP),使用ICPmax/MBSP评估小鼠的勃起功能。结果 实验组3次测得的ICPmax和ICPmax/MBSP差异无显著性(P>0.05),对照组3次测得的值差异也无显著性(P>0.05),但两组组间每次测得的ICPmax和ICPmax/MBSP差异均有显著性(t=17.71~18.27,P<0.05)。结论 在1型糖尿病小鼠模型中,应用电刺激法测量海绵体内压是一种安全、稳定、可重复的理想方法。
[关键词]糖尿病,1型;阴茎勃起;电刺激;小鼠
[中图分类号]R698.1;R587.1
[文献标志码]A
[文章编号] 2096-5532(2019)05-0528-04
doi:10.11712/jms201905006
[开放科学(资源服务)标识码(OSID)]
勃起功能障碍(ED)是指阴茎持续不能达到和(或)维持足够勃起以获得满意的性生活[1]。有调查结果显示,在40~69岁的人群中ED的发病率高达52%[2]。ED是糖尿病的主要并发症之一,目前全球范围内的糖尿病病人约有3亿5 000万[3],而高达75%的糖尿病病人有不同程度的ED,且发病年龄比普通人群提前10~15年,并随着年龄和病程的增长而加重[4]。目前我国人口正呈现老龄化趋势,因此老年男性糖尿病病人ED的防治越来越受到关注。如何有效评价糖尿病性ED的海绵体内压,是对其后续治疗的有力保障。国外常用的评价勃起功能的方法是电刺激阴茎海绵体神经测定海绵体内压法(简称电刺激法),而国内运用此方法的报道不多,且研究对象多为大鼠。目前1型糖尿病小鼠模型的建立已经成熟,本研究就该方法在1型糖尿病小鼠模型ED评价中的应用效果进行观察。
1 材料与方法
1.1 材料
8周龄SPF级C57BL6J小鼠30只,购自济南朋悦实验动物繁育有限公司(经山东省实验动物中心质检合格)。多导生理记录仪、铂金双极电极、电刺激仪(美国BIOPAC公司),Visitech Systems BP-2000小动物无创血压分析系统(美国INC公司),链脲佐菌素(STZ,美国Sigma公司),解剖显微镜及显微手术器械(德国徕卡公司)。
1.2 方法
1.2.1 分组与建模 实验小鼠饲养于滨州医学院医药研究中心的SPF级动物房,随意取食物和水,饲养环境:光/暗周期12 h/12 h,室温(22±2)℃,湿度50%~55%。随机选择10只小鼠,给予标准饮食、自由饮水,设为对照组;余20只小鼠设为实验组,给予高脂饮食、自由饮水,腹腔注射STZ(用pH值4.5的0.1 mol/L冰柠檬酸钠-柠檬酸缓冲液配制20 g/L的STZ溶液,注意避光,即配即用)50 mg/(kg·d),连续5 d,8周后测禁食10 h后的空腹血糖浓度,高于16.7 mmol/L者即为1型糖尿病建模成功[5],从中随机选取10只进行后续实验。
1.2.2 小鼠勃起功能实验 以6 g/L戊巴比妥钠腹腔注射麻醉小鼠(66~80 mg/kg),将小鼠仰面固定于动物解剖操作台上。剃去小鼠下腹部手术区域毛发,沿阴茎纵轴剪开阴茎包皮,分离包皮和白膜,充分暴露阴茎海綿体。取阴茎包皮切口向上延续2~3 cm,切开皮肤及腹壁,打开腹膜,用纱布条攒成球挤开肠道,增加手术操作空间。分离耻骨联合前肌肉组织,充分暴露前列腺,在前列腺后外侧,识别盆神经节,沿尿道方向寻及阴茎海绵体神经,从底部穿过铂金双极电极并固定妥当。用充满肝素生理盐水的头皮针穿入阴茎海绵体中部,头皮针通过三通阀门连接注射器和压力换能器,推注少许肝素生理盐水可见阴茎勃起,证明穿刺连接正确,术毕。
1.2.3 观察指标 电刺激小鼠的阴茎海绵体神经,两组给予相同强度的电刺激:电压1或5 V,波宽1 ms,频率13 Hz,刺激时间60 s,间隔10 min,共刺激3次[6]。记录小鼠阴茎勃起时海绵体内压最大值(ICPmax)。在电刺激之前用Visitech Systems BP-2000无创尾压测量系统检测两组小鼠血压[7]。计算ICPmax/平均系统血压(MSBP)。
1.2.4 统计学分析 采用SPSS 19.0统计学软件进行分析,实验所得计量数据以[AKx-D]±s表示,组内比较采用单因素方差分析,组间比较采用t检验,以P<0.05为差异有显著性。
2 结果
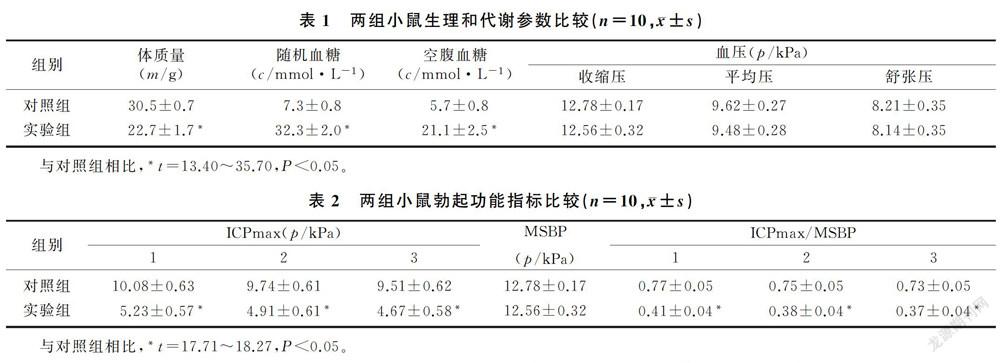
实验组小鼠体质量明显低于对照组、随机血糖和空腹血糖显著高于对照组(t=13.40~35.70,P<0.05),而两组血压比较差异无显著性(P>0.05)。见表1。两组MSBP比较差异无显著性(P>0.05)。给予小鼠电刺激后,海绵体内压迅速升高,持续电刺激期间,压力先是迅速增加,然后进入平台期,增加的幅度减弱,电刺激60 s时压力达到最大值,停止电刺激,压力迅速降低,恢复到基础值左右。每组小鼠3次电刺激测量的ICPmax和ICPmax/MBSP差异均无统计学意义(P>0.05),而两组组间每次测得的ICPmax和ICPmax/MBSP差异均有显著意义(t=17.71~18.27,P<0.05)。见表2。
3 讨论
ED是糖尿病的主要并发症之一,5型磷酸二酯酶(PDE5)抑制剂是目前治疗ED的常用药物,但其对糖尿病病人的有效率要远低于非糖尿病病人[8]。其他治疗如海绵体内注射血管活性物质、尿道内栓剂、阴茎假体植入等方式[9],能获得一定效果,但均不理想。因此需要更深入地研究1型糖尿病ED的发病机制及探索有效的新治疗方式。以病人为研究对象进行性功能研究因为受到伦理、道德、法律等限制,无法开展基础实验的研究,目前多是以动物模型作为实验基础[10]。因此,选择合适的实验对象建立1型糖尿病模型,并在此基础上开展ED的生理、病理生理和药理学等各方面的研究,是将实验结果安全有效地外推到人体应用的保障。
在ED研究中,選择合适的实验动物需要考虑诸多因素,根据研究者的目的、动物成本、动物繁殖周期等因素,可以考虑猫、狗、兔、大鼠、猴等动物,小鼠近来也用于研究[11]。目前国内最常用来研究糖尿病及其并发症的实验动物是大鼠,因为其具有抗感染能力强、繁殖快、易饲养、相对经济等优点[12]。但与小鼠相比,大鼠应用于实验所需的耗材及试剂仍然相对较多,因此国内外对于糖尿病性ED的实验研究越来越多地选择小鼠作为实验对象。
糖尿病动物模型的构建方法主要有3种:实验性糖尿病动物模型、自发性糖尿病动物模型和转基因糖尿病动物模型[13]。其中自发性糖尿病动物模型因为繁殖饲养成本太高,其应用受到一定限制,而利用基因敲除技术制备的转基因糖尿病动物模型还未广泛应用,因此目前最常用的是实验性糖尿病动物模型。最经典的建立糖尿病动物模型的方法是腹腔或静脉注射STZ,STZ通过特异性破坏动物胰岛β细胞,引起胰岛素合成释放减少,进而导致动物血糖升高[14]。STZ引起β细胞死亡的机制主要为:①烷化胰岛β细胞DNA链,使其断裂;②烷化一些细胞内的关键酶如ADP核糖体合成酶,导致ATP生成障碍,细胞内ATP含量降低,从而引起β细胞死亡[15]。STZ的溶液制剂不稳定,pH值在3.5~4.5范围之外,放置在常温环境中会迅速降解,因此最好是用柠檬酸缓冲液现配现用,并置于冰盒上,在尽可能短的时间内完成操作。
目前常用的注射方式是静脉注射和腹腔注射,前者注射难度相对较高,容易出现操作误差,而腹腔注射易操作、准确、方便。程祎等[16]通过对比不同注射剂量的建模成功率和死亡率发现,STZ的注射剂量为60 mg/kg时,既能避免剂量过大引起器官损伤导致动物死亡,又能避免剂量过小而降低建模成功率、浪费实验动物。
目前文献报道的检测、评价勃起功能的方法有阴茎海绵体测压[17]、性行为直接观察如阿扑吗啡实验[18]、勃起时肌电图图谱测量[19]、多普勒超声检测阴茎动脉血流变化[20]等。STEERS等[21]和CHEN等[22]分别以大鼠和小鼠为实验对象成功测量了阴茎海绵体内的压力。对实验动物勃起功能的检测和[LL]评价要遵循客观、准确、简单易行的原则,通过电刺激诱导阴茎勃起测量阴茎海绵体内压力的方法,因为能通过换能器直接读取海绵体内的压力,不受外界环境和实验者主观因素的影响,能够客观、公正地评价阴茎勃起功能,成为国内外评价阴茎勃起功能的标准方法。SEZEN等[23]首次报道了以电刺激法测量海绵体内压,并获得成功。
本实验参考国外相关文献的电刺激参数[5],以C57BL6J小鼠为实验对象,在STZ诱导糖尿病模型成功后8周,电刺激小鼠阴茎海绵体神经,比较两组小鼠的海绵体内压,结果显示糖尿病小鼠较对照组明显下降,与既往研究结果一致。在实验操作过程中,我们的经验是:小鼠的体积较小,生理解剖肉眼难辨,需要借助解剖显微镜和显微手术器械,以减少对周围组织和脏器的损伤,减少操作过程中出血,避免失血过多对实验数据产生影响;识别前列腺后外侧的阴茎海绵体神经时,可以用无菌棉球将周围肠管推开,提供充分的操作空间。
本研究利用电刺激法测量小鼠阴茎海绵体内压,两组均连续给予3次电刺激,间隔10 min,得到的勃起功能指标基本一致,无明显变化,而两组之间勃起功能指标比较差异有统计学意义。表明电刺激法能有效反映糖尿病小鼠与正常小鼠海绵体内压的差异,可以为1型糖尿病性ED提供评价的客观依据。总之,电刺激法测量海绵体内压,应用于小鼠糖尿病模型中安全、可靠、可重复,是一种理想的评价勃起功能的方法。
[参考文献]
[1]NIH Consensus Conference. Impotence. NIH consensus deve-lopment panel on impotence[J]. JAMA, 1993,270(1):83-90.
[2]JOHANNES C B, ARAUJO A B, FELDMAN H A, et al. Incidence of erectile dysfunction in men 40 to 69 years old:longitudinal Results from the Massachusetts male aging study[J]. The Journal of Urology, 2000,163(2):460-463.
[3]CHENG S K, PARK E Y, PEHAR A, et al. Current progress of human trials using stem cell therapy as a treatment for diabetes mellitus[J]. American Journal of Stem Cells, 2016,5(3):74-86.
[4]MALAVIGE L S, LEVY J C. Erectile dysfunction in diabetes mellitus[J]. The Journal of Sexual Medicine, 2009,6(5):1232-1247.
[5]JIN H R, KIM W J, SONG J S, et al. Functional and morphologic characterizations of the diabetic mouse corpus cavernosum:comparison of a multiple low-dose and a single high-dose streptozotocin protocols[J]. The Journal of Sexual Medicine, 2009,6(12):3289-3304.
[6]JIN H R, CHUNG Y G, KIM W J, et al. A mouse model of cavernous nerve injury-induced erectile dysfunction:functional and morphological characterization of the corpus cavernosum[J]. Journal of Sexual Medicine, 2010,7(10):3351-3364.
[7]KREGE J H, HODGIN J B, HAGAMAN J R, et al. A noninvasive computerized tail-cuff system for measuring blood pressure in mice[J]. Hypertension (Dallas,Tex.:1979), 1995,25(5):1111-1115.
[8]HIDALGO-TAMOLA J, CHITALEY K. Type 2 diabetes mellitus and erectile dysfunction[J]. Journal of Sexual Medicine, 2009,6(4):916-926.
[9]BURNETT A L. Erectile dysfunction management for the future[J]. Journal of Andrology, 2009,30(4):391-396.
[10]BURNETT A L. General use of animal models for investigation of the physiology of erection[J]. International Journal of Impotence Research, 2001,13(3):135-139.
[11]ANDERSSON K E. Penile erectile function:recommendations for future research[J]. International Journal of Impotence Research, 2000,12(Suppl 4):S163-S167.
[12]MEHTA N, SIKKA S, RAJASEKARAN M. Rat as an animal model for male erectile function evaluation in sexual medicine research[J]. The Journal of Sexual Medicine, 2008,5(6):1278-1283.
[13]潘衛兵,曹石金,谢礼仁,等. 大鼠糖尿病性勃起功能障碍模型的制备[J]. 海南医学, 2015,26(5):629-631.
[14]ELABBADY A A, GAGNON C, HASSOUNA M M, et al. Diabetes mellitus increases nitric oxide synthase in penises but not in major pelvic ganglia of rats[J]. British Journal of Urology, 1995,76(2):196-202.
[15]PETTEPHER C C, LEDOUX S P, BOHR V A, et al. Repair of alkali-labile sites within the mitochondrial DNA of RINr 38 cells after exposure to the nitrosourea streptozotocin[J]. The Journal of Biological Chemistry, 1991,266(5):3113-3117.
[16]程祎,韦安阳,李煜罡. 糖尿病性勃起功能障碍大鼠模型的建立[J]. 南方医科大学学报, 2008,28(4):564-566.
[17]LEWIS J E, WALKER D F, BECKETT S D, et al. Blood pressure within the corpus cavernosum penis of the bull[J]. Journal of Reproduction and Fertility, 1968,17(1):155-156.
[18]GOWER A J, BERENDSEN H G, PRINCEN M M, et al. The yawning-penile erection syndrome as a model for putative dopamine autoreceptor activity[J]. European Journal of Pharmacology, 1984,103(1/2):81-89.
[19]MIURA T, KONDO Y, AKIMOTO M, et al. Electromyography of male rat perineal musculature during copulatory behavior[J]. Urologia Internationalis, 2001,67(3):240-245.
[20]PARK K, SON H, KIM S W, et al. Initial validation of a novel rat model of vasculogenic erectile dysfunction with genera-lized atherosclerosis[J]. International Journal of Impotence Research, 2005,17(5):424-430.
[21]STEERS W D, MALLORY B, DE GROAT W C. Electrophysiological study of neural activity in penile nerve of the rat[J]. The American Journal of Physiology, 1988,254(6 Pt 2):R989-R1000.
[22]CHEN K K, CHAN J Y, CHANG L S, et al. Intracavernous pressure as an experimental index in a rat model for the eva-luation of penile erection[J]. The Journal of Urology, 1992,147(4):1124-1128.
[23]SEZEN S F, BURNETT A L. Intracavernosal pressure monitoring in mice:responses to electrical stimulation of the caver-nous nerve and to intracavernosal drug administration[J]. Journal of Andrology, 2000,21(2):311-315.
(本文编辑 马伟平)
