若干因素对寒兰根状茎诱导、增殖与分化的影响
2019-09-10李国平杨鹭生
李国平 杨鹭生
摘要:目的:建立寒兰离体培养再生体系,为寒兰种质资源保护和工厂化育苗工作提供科学依据.方法:以寒兰假鳞茎作为外植体,比较不同植物生长调节剂组合对根状茎诱导的影响,同时探究不同复硝酚钠浓度、不同基本培养基和不同有机添加物等因素对寒兰根状茎增殖与分化的影响.结果:根状茎诱导的最适培养基为1/2MS+6-BA 1mg/L+NAA 5mg/L+蔗糖30g/L+活性炭3g/L+香蕉100g/L,根状茎诱导率达40.5%;根状茎增殖与分化的最适培养基为1/2 MS+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L+椰子汁10%+蔗糖30g/L,分化率达98.2%.结论:通过寒兰假鳞茎侧芽诱导根状茎形成,筛选出寒兰根状茎诱导、增殖与分化的最适培养基,从而建立了稳定、高效的寒兰离体培养再生体系.
关键词:寒兰;根状茎;诱导;分化;植株再生
中圖分类号:Q813.1 文献标识码:A 文章编号:1673-260X(2019)08-0026-04
寒兰(Cymbidium kanran)属兰科兰属植物,主要分布在福建、江西、浙江、广西、湖南、四川、云南以及贵州等地[1].寒兰的表型性状变异显著、多样性丰富,具有很高的观赏和经济价值[2].武夷山脉寒兰资源丰富,是全国寒兰主要产区,但由于野生寒兰遭到人为滥采,寒兰资源日渐减少.野生寒兰自然繁殖系数低,而且寒兰相对于春兰、建兰、墨兰等国兰而言较难驯化栽培,下山寒兰驯化栽培的成功率较低,致使许多寒兰品种流失.更有一些商家大量收购下山寒兰,寒兰种质资源破坏和流失情况严重,为此,有必要开展寒兰组织培养与快速繁殖技术研究.目前,已有一些关于寒兰组织培养以及快繁技术的研究报道[3-7],朱国兵等以种子萌发后形成的根状茎为外植体建立了相应的离体快繁技术[4,5];张天翔等以寒兰茎尖为外植体进行寒兰组织培养技术体系的研究[6];苏妍[7]及徐晓薇等[8]以寒兰杂交种子为外植体进行离体培养获得寒兰再生植株.总体上说,寒兰组织培养方面的研究成果甚少,缺乏较为高效稳定的植株再生系统,有必要进一步研究寒兰的组培与快速繁殖技术问题.以寒兰假鳞茎为外植体,通过诱导假鳞茎侧芽形成根状茎的研究还未见报道.本研究以寒兰的假鳞茎为外植体诱导形成根状茎,通过根状茎增殖与分化影响因素的研究建立寒兰高效的组织培养快繁体系,旨在为寒兰资源的保护和可持续开发利用奠定基础.
1 材料和方法
1.1 材料
供试材料为寒兰(Cymbidium kanran)假鳞茎,取自武夷山下山细叶寒兰成熟株.
1.2 方法
1.2.1 外植体选择与灭菌
每年3月至4月,选择生长健壮、无病虫害的成年植株,剪取假鳞茎作为外植体.将假鳞茎上的根、包叶和鳞片小心摘除,用洗衣液清洗干净后置于烧杯中,在自来水下用缓水流冲洗12h.在超净工作台上,用添加了2-3滴吐温80的0.1% HgCl2溶液浸泡20min(也可以根据外植体的幼嫩情况适当增减浸泡时间),菌水冲洗4-5次,备用.
1.2.2 根状茎诱导培养
将灭菌后的外植体接种于诱导培养基:(1)1/2 MS+TDZ(苯基噻二唑基脲-Thidiazuron)2mg/L+NAA 0.5mg/L;(2)1/2 MS+KT-30(吡效隆-Forchlorfenuron)2mg/L+NAA 0.5mg/L;(3)1/2 MS+6-BA 2mg/L+NAA 0.5mg/L;(4)1/2 MS+6-BA 0mg/L+NAA 5mg/L;(5)1/2 MS+6-BA 0.5mg/L+NAA 5mg/L;(6)1/2 MS+6-BA 1mg/L+NAA 5mg/L;(7)1/2 MS+6-BA 2mg/L+NAA 5mg/L.每处理接种9瓶,每瓶接种3个外植体,90d后观察统计结果.上述培养基均添加蔗糖30g/L,琼脂8g/L,pH值5.8,(4)~(7)号培养基另添加活性炭3g/L、香蕉100g/L.培养温度为(25±2)℃,光照时间为14h/d,光照强度为1000~1500lx.
1.2.3 根状茎的增殖与分化
将诱导形成的根状茎切割下来,接种到根状茎增殖与分化培养基(8)~(19)中培养,其中,(8)~(11)培养基研究不同浓度复硝酚钠对寒兰根状茎增殖与分化的影响,(12)~(15)培养基比较不同基础培养基[9]对寒兰根状茎增殖与分化的影响,(16)~(19)培养基比较不同有机添加物对寒兰根状茎增殖与分化的影响.以上每处理接9瓶,每瓶接3小丛根状茎,共接18小丛,120d后统计结果.培养条件与1.2.2同.
增殖与分化培养基为:
(8)1/2 MS+复硝酚钠0mg/L+NAA 0.25mg/L
(9)1/2 MS+复硝酚钠0.5mg/L+NAA 0.25mg/L
(10)1/2 MS+复硝酚钠0.75mg/L+NAA 0.25mg/L
(11)1/2 MS+复硝酚钠1.0mg/L+NAA 0.25mg/L
(12)1/2 MS+S-3307(优康唑-uniconazole)0.75 mg/L+6-BA 1mg/L+NAA 0.5mg/L
(13)B5+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5 mg/L
(14)N6+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L
(15)WPM+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L
(16)1/2 MS+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L+10%香蕉泥
(17)1/2 MS+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L+10%土豆汁
(18)1/2 MS+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L+10%苹果汁
(19)1/2 MS+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L+10%椰子汁
以上培养基均添加蔗糖30g/L,琼脂8g/L,pH值5.8.
1.2.4 数据处理与统计方法
诱导率(%)=诱导出根状茎的外植体数/接种的外植体总数×100%;增殖系数=增殖后的总数/接种总数;分化率(%)=分化苗数/接种总数×100%.试验数据采用SPSS 16.0软件进行统计及差异显著性分析.
2 结果与分析
2.1 不同生长调节剂种类和浓度对寒兰根状茎诱导的影响
将消毒灭菌后的假鳞茎分别接种在(1)~(7)培养基上,结果如表1.
寒兰假鳞茎在不同培养基中的培养反应不同,(1)~(3)号培养基时仅诱导侧芽的伸长生长(图1-a,b),对侧芽的诱导效果TDZ>KT-30>6-BA,但无根状茎的形成.(4)号培养基中仅添加NAA,外植体稍膨大后死亡;一定质量浓度6-BA与NAA配比可诱导根状茎形成,(5)~(7)号培养基培养结果表明不同质量浓度6-BA对根状茎诱导率有极显著影响(p<0.01),当6-BA质量浓度为1mg/L时假鳞茎上侧芽先萌动伸长(图1-c),后期侧芽停止伸长,而从其基本形成簇生根状体(图1-d),根状茎诱导率达40.5±5.14%,因此,(6)号培养基1/2 MS+6-BA 1mg/L+NAA 5mg/L+蔗糖30g/L+活性炭3g/L +香蕉100g/L最适合寒兰根状茎诱导.
2.2 不同复硝酚鈉浓度对寒兰根状茎增殖与分化的影响
本研究以(8)号培养基1/2 MS+NAA 0.25mg/L为对照,比较添加不同质量浓度复硝酚钠对寒兰根状茎增殖与分化的影响,实验结果表明:低浓度复硝酚钠对根状茎增殖与分化有显著促进作用(p<0.05),(9)(10)号培养基中根状茎有一定增殖与分化,但芽生长较弱,且无根的形成.添加复硝酚钠质量浓度0.75mg/L的(10)号培养基中既有不定芽的形成,又有不定根的生成,其形态正常(图2-a),分化率达65.0±5.86%;(11)号培养基中复硝酚钠质量浓度达1.0mg/L,对寒兰根状茎增殖和分化有负作用,分化率仅为34.5±3.04%(图2-b).所以,对于寒兰根状茎分化形成再生植株,培养基中复硝酚钠适宜添加量为0.75mg/L.
2.3 不同基础培养基对寒兰根状茎增殖与分化的影响
不同基础培养基对寒兰根状茎增殖与分化有极显著的影响(p<0.01)(表2),1/2 MS对根状茎增殖与分化的效果显著优于B5、N6和WPW(图3-a).B5与N6培养基中根状茎增殖较快,但不定芽分化少,且大都不能正常发育成苗(图3-b,c).非常有趣的是(15)号培养基中仅有不定根的分化,不定根粗壮、肉质,发育快且形态正常(图3-d).通过筛选,确定适宜寒兰根状茎增殖与分化的基础培养基为1/2 MS.
2.4 不同有机添加物对寒兰根状茎增殖与分化的影响
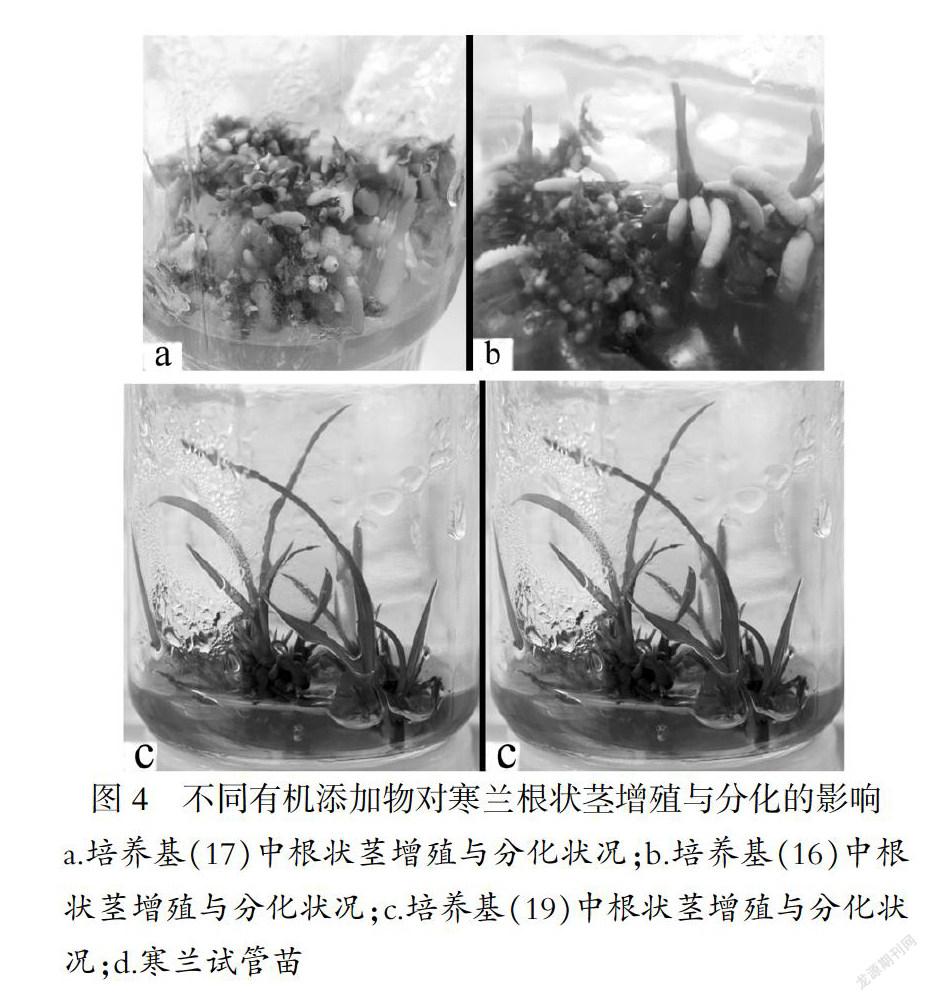
寒兰根状茎在(16)~(19)号培养基上生长发育状况有所不同,有机添加物种类对寒兰根状茎的影响增殖与分化有显著影响(p<0.05).根状茎在(17)(18)号培养基中的培养反应相似,添加土豆汁、苹果汁有助于根状茎的增殖和不定根分化,而不利于不定芽分化(图4-a);添加香蕉泥的(16)号培养基中根状茎增殖速度中等,形态正常,且不定芽与不定根同步发育,形成正常再生植株(图4-b).添加椰子汁的(19)号培养基中根状茎的增殖与分化情况明显优于其它三种,根状茎增殖速度较快,且不定芽与不定根同步分化,分化率达98.2±8.81%,再生植株形态正常(图4-c、d).
3 讨论
寒兰属于国兰.与洋兰比,国兰的组织培养与快速繁殖技术体系相对较难建立.朱国兵曾以寒兰种子萌发后形成的根状茎为外植体建立寒兰快速繁殖技术[4],张天翔以寒兰茎尖为外植体[6]、徐晓薇以新芽为外植体进行寒兰组织培养技术体系的研究,并获得再生植株[8].本研究以寒兰假鳞茎为外植体诱导形成根状茎,通过根状茎增殖与分化获得再生植株,其快繁技术体系与前人报道的有所不同.通过种子无菌培养再生的试管苗不能保持母本遗传性状,而以假鳞茎为外植体进行组织培养再生的试管苗保持了母本遗传性状,这对于寒兰种质资源的保存和优良品种的快速繁殖与推广具有重要意义.
本实验通过筛选确定最适合寒兰根状茎诱导的培养基为1/2 MS+6-BA 1mg/L+NAA 5mg/L+蔗糖30g/L+活性炭3g/L+香蕉100g/L.初步研究了基础培养基、复硝酚钠和有机添加物对寒兰根状茎增殖与分化的影响.复硝酚钠是一种新型的人工合成植物生长调节剂,对促进种子萌发、提高幼苗生长质量及改善果实品质等有良好效果[10,11].虽然实验观察到添加一定质量浓度的复硝酚钠对寒兰根状茎增殖与分化有一定促进作用,但诱导形成的芽苗质量和分化率不及(12)(16)和(19)号培养基.1/2 MS确定为适宜寒兰根状茎增殖与分化的基础培养基,此研究结果与其它报道相同[5,6].通过不同有机添加物比较实验,筛选出适宜寒兰根状茎增殖与分化的培养基为1/2 MS+S-3307 0.75mg/L+6-BA 1 mg/L+NAA 0.5mg/L+椰子汁10%+蔗糖30g/L.
以WPM为基础培养基的(15)号培养基中仅有不定根的分化,此结果可为研究寒兰不定根的生长发育提供理想研究系统.WPM基础培养基是根据MS培养基改良,属低盐培养基,一般适用于木本植物的组织培养[9].不同基础培养基和不同激素组合对寒兰根状茎增殖与分化的调控机制有待进一步研究.
4 结论
以寒兰假鳞茎为外植体,建立了稳定、高效的寒兰离体培养再生体系.根状茎诱导的最适培养基为1/2 MS+6-BA 1mg/L+NAA 5mg/L+蔗糖30g/L +活性炭3g/L+香蕉100g/L,根状茎诱导率达40.5%;根状茎增殖与分化的最适培养基为1/2 MS+S-3307 0.75mg/L+6-BA 1mg/L+NAA 0.5mg/L+椰子汁10%+蔗糖30g/L,分化率达98.2%.
——————————
参考文献:
〔1〕吴应祥.中国兰花[M].北京:中国林业出版社,1991.50-51.
〔2〕段艳皊,范义荣,敖素燕,等.寒兰种质资源表型性状多样性分析[J].中國农学通报,2014,30(16):143-147.
〔3〕Lee J S. Shim K K.、YOO M S. et al. Studies on rhizome growth and organogenesis of Cymbidium Kanran cultured in vitro.J Korean Soc Hortic Sci. 1986, 27(2):174-180.
〔4〕朱国兵,杨柏云,敖爱艳.寒兰的组织培养与试管开花[J].植物生理学通讯,2008,44(03):513-514.
〔5〕朱国兵,杨柏云,蔡奇英,等.寒兰的快速繁殖技术[J].热带亚热带植物学报,2006,14(02):151-156.
〔6〕张天翔.寒兰组织培养体系研究[D].福州:福建农林大学,2011.
〔7〕苏妍.寒兰杂交后代快速繁殖体系及生理生化研究[D].福州:福建农林大学,2016.
〔8〕徐晓薇,柴明良,杨燕萍,等.寒兰杂交及种子离体萌发研究[J].园艺学报,2011,38(10):2010-2016.
〔9〕陈振光.园艺植物离体培养学[M].北京:中国农业出版社,1996.182-187.
〔10〕刘兴宇.新型植物生长调节剂复硝酚钠及其应用[J].农药市场信息,2007(14):35,44.
〔11〕王雪丽,李萍萍,吴坤阳,等.日本五针松针叶胚性愈伤诱导及愈伤组织细胞[J].植物生理学报,2017,53(03):422-428.
