同步推量调强放疗治疗肺癌脑转移的效果
2019-09-10王晗张芹王思伟
王晗 张芹 王思伟

[摘要] 目的 探讨同步推量调强放疗治疗肺癌脑转移的效果。
方法选择2013年1月—2016年8月我院收治的肺癌脑转移病人50例作为研究对象,随机分为序贯组和同步组,各25例。同步组给予同步推量调强放疗,全脑95%计划靶区体积(PTV)40 Gy/20 f,转移灶95%计划肿瘤靶区(PGTV)60 Gy/20 f;序贯组给予全脑放疗后序贯局部转移灶放疗,全脑95% PTV为40 Gy/20 f,后缩野至转移灶加照20 Gy/10 f。比较两组放疗后1个月的治疗效果、放疗后6个月的生存率及平均住院时间。
结果同步组有效率为92.0%,序贯组有效率为68.0%,两组比较差异有显著性(χ2=4.50,P<0.05)。放疗后6个月的生存率同步组为64.0%,序贯组为36.0%,两组比较差异有统计学意义(χ2=3.92,P<0.05)。同步组住院时间明显短于序贯组,两组比较差异有统计学意义(t=11.09,P<0.05)。
结论同步推量调强放疗治疗肺癌脑转移具有显著的临床效果。
[关键词] 肺肿瘤;肿瘤转移;放射疗法,调强适形
[中图分类号] R734.2;R815
[文献标志码] A
[文章編号] 2096-5532(2019)01-0114-04
EFFICACY OF SIMULTANEOUS INTEGRATED BOOST-INTENSITY MODULATED RADIOTHERAPY IN TREATMENT OF MULTIPLE BRAIN METASTASES FROM LUNG CANCER
WANG Han, ZHANG Qin, WANG Siwei
(Department of Oncology, The First People’s Hospital of Jining, Jining 272500, China)
[ABSTRACT]ObjectiveTo investigate the efficacy of simultaneous integrated boost-intensity modulated radiotherapy (SIB-IMRT) in the treatment of multiple brain metastases from lung cancer.
MethodsFrom January 2013 to August 2016, 50 patients with multiple brain metastases from lung admitted to our hospital were enrolled as subjects. Those patients were randomly and equally divided into sequential treatment group and simultaneous treatment group. The simultaneous treatment group received SIB-IMRT with a dose of 40 Gy in 20 fractions delivered to 95% of the planning target volume (PTV) for the whole brain and a dose of 60 Gy in 20 fractions delivered to 95% of the planning gross tumor volume for metastatic lesions. The sequential treatment group received whole-brain radiotherapy with a dose of 40 Gy in 20 fractions delivered to 95% of the PTV and sequentially underwent shrinking-field radiotherapy for local metastatic lesions with a dose of 20 Gy in 10 fractions. The treatment outcomes at one month after radiotherapy,6-month survival rate after radiotherapy, and mean hospital stay were compared between the two groups.
ResultsThe simultaneous treatment group had a significantly higher response rate than the sequential treatment group (92.0% vs 68.0%,χ2=4.50,P<0.05). The 6-month survival rate after radiotherapy was significantly higher in the simultaneous treatment group than in the sequential treatment group (64.0% vs 36.0%,χ2=3.92,P<0.05). The simultaneous treatment group also had a significantly shorter hospital stay than the sequential treatment group (t=11.09,P<0.05).
ConclusionSIB-IMRT achieves substantial clinical outcomes in the treatment of multiple brain metastases from lung cancer.
[KEY WORDS]lung neoplasms; neoplasm metastasis; radiotherapy, intensity-modulated
肺癌是发生脑转移最常见的恶性肿瘤,在不治疗的情况下其中位生存期仅1个月[1]。脑转移瘤传统治疗方法有全脑放疗、立体定向放疗、全脑放疗联合立体定向放疗、化疗等,均有较好的临床疗效[2-3]。其中全脑放疗为肺癌脑转移瘤的基本治疗方式[4]。但因正常脑组织、晶体、视神经、视交叉、脑干等重要器官耐受剂量的限制,肺癌脑转移瘤局部控制并不满意,预后较差。“减时增量”的同步推量调强放疗可在同一个射野内对肿瘤及亚临床病灶同时进行不同分割剂量的照射,该技术可通过生物和物理优化途径达到缩短治疗总时间,提高治疗总剂量的作用,同时提高肿瘤病人的生存率。因此,应用同步推量调强放疗治疗肺癌脑转移迫在眉睫。目前,关于同步推量调强放疗的治疗方案如分次量、总量和分割方法等因素对肺癌脑转移瘤生存期的影响报道较少。本研究拟通过对比同步推量调强放疗及全脑适形序贯推量放疗的近期疗效、预后、住院时间等,分析同步推量调强放疗的临床应用价值,为该方法在肺癌脑转移病人的应用提供临床指导。现将结果报告如下。
1 资料与方法
1.1 一般资料
2013年1月—2016年8月,我院收治肺癌脑转移病人50例,原发灶经手术或活检病理证实为非小细胞肺癌,且为单发肿瘤,颅内转移病灶均经增强MRI扫描证实,颅内病灶数目≤4个,且均为可测量病灶。50例病人中,男29例,女21例,年龄30~65岁;入院时功能状态卡氏评分(KPS评分)≥70分,脑转移瘤未行外科手术、立体定向放疗等治疗,原发病灶控制好,无颅外其他部位转移。随机分为同步组和序贯组,各25例。两组一般资料比较差异无显著性(P>0.05)。均同步TP方案化疗。入组病人均签署知情同意书。
1.2 治疗方法
1.2.1定位 两组均采用相同的定位方法。平静状态下,病人取仰卧位,采用头部热塑膜固定病人体位,采用螺旋CT直接增强扫描,层厚3 mm,扫描范围:上界开放,下界至颈2椎体。扫描结束后图像传至英国Pinnacle 9.6治疗计划系统。
1.2.2勾画靶区 同步组:定位CT上转移灶定义为大体肿瘤体积(GTV),以GTV均匀外放5 mm为计划肿瘤靶区(PGTV);全脑定义为临床靶区(CTV),将CTV外放3 mm定义为计划靶区体积(PTV)。序贯组:全脑定义为CTV,外放3 mm定义为PTV。若强化病灶不明显,可采用图像融合技术(CT与MRI的融合)。
1.2.3放疗 处方剂量定义95% PTV所接受剂量。靶区最小剂量≥95%,最大剂量≤110%。同步组:全脑95%PTV 40 Gy/20 f,转移灶95%PGTV 60 Gy/20 f。序贯组:全脑95%PTV 40 Gy/20 f,后缩野至转移灶加照20 Gy/10 f。危及器官(OAR)勾画:主要包括晶体、视神经、视交叉、脑干。限制OAR剂量:晶体<9 Gy,视神经<54 Gy,视交叉<54 Gy,脑干<54 Gy。所有病人在放疗前均经降颅压脱水治疗,以控制颅内压。
1.3 疗效评价方法
放疗后1、6个月行颅脑MRI及胸部增强CT检查,监测有无肿瘤复发或转移,参照2009年实体瘤疗效评价标准(RECIST)1.1 版[6] 评定客观疗效。完全缓解(CR):全部肿瘤病灶消失,并维持4周;部分缓解(PR):肿瘤最长径的总和缩小30%或以上,维持4周;稳定(SD):非PR/进展(PD);PD:肿瘤最长径的总和增加20%或出现新病灶。CR+PR为总有效,CR+PR+SD为临床疾病控制。治疗期间每周记录病人骨髓抑制程度、脑损伤以及消化道反应情况。
1.4 统计方法
采用SPSS 20.0软件进行统计学处理,计数资料比较采用χ2检验,计量资料比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗结果比较
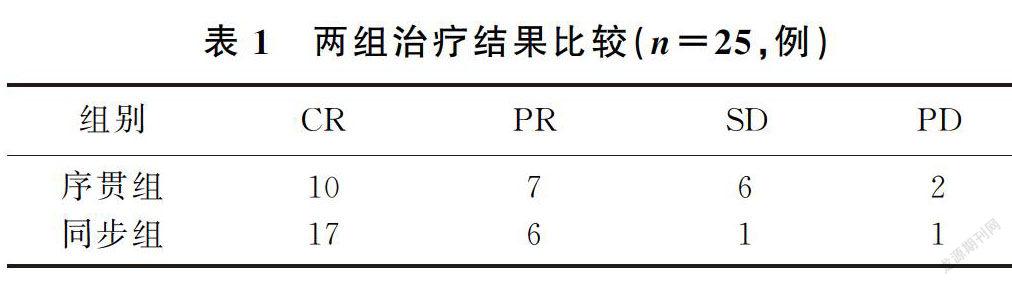
所有病人均顺利完成治疗,放疗后1个月评定疗效,序贯组有效率为68.0%,同步组为92.0%,两组比较差异有显著性(χ2=4.50,P<0.05)。 见表1。
2.2 两组生存情况比较
放疗后6个月序贯组存活9例,占36.0%;同步组存活16例,占64.0%,两组比较差异有统计学意义(χ2=3.92,P<0.05)。
2.3 两组住院时间比较
同步組住院时间(29.4±3.7)d,序贯组住院时间(38.7±4.0)d,两组比较差异有统计学意义(t=11.09,P<0.05)。
2.4 两组不良反应比较
同步组与序贯组放疗期间脑损伤发生情况比较,差异有显著性(uc=2.675,P<0.05);骨髓抑制和消化道反应发生情况比较,差异无显著性(P>0.05)。见表2。
3 讨 论
肺癌一旦出现脑转移,则提示病情进展极为迅速,预后极差。传统的全脑放疗可以使脑转移病人的生存时间明显延长。但大剂量全脑放疗可以造成放射性脑损伤,甚至引起脑萎缩和脑实质坏死[7]。
全脑适形序贯放疗[8]需按一定顺序进行,过程相对复杂,治疗时间相对较长,且不良反应重[9-10]。
同步推量调强放疗技术为解决这一难题提供了技术可能,其可实现非均匀照射,在不延长总治疗时间的前提下,可以提高单次照射剂量,且不增加放射损伤[11]。调强放疗可以使用同步推量技术实现全脑放疗的同时给予脑转移瘤病灶更高的治疗剂量,且不受病灶数目及体积的限制。调强放疗一方面减少了摆位误差,提高了放疗的精确性;另一方面总治疗时间也短于常规分割照射的时间,更符合“减时增量”技术原理,并能显著降低正常组织的受照射剂量,对肿瘤周围的正常组织和邻近OAR有较好的保护作用[12-13]。
从放射生物学的角度来讲,通过等效生物剂量(BED,BED=nd[1+d/(α/β)],n=治疗次数,d=每次剂量,脑转移瘤α/β=10 Gy[14])的计算公式可见,同步推量调强放疗可以在物理剂量相同的情况下实现较高的BED,而BED的提高将有可能提高局部肿瘤的治疗效果,且缩短了治疗时间。有研究显示,同步推量调强放疗体积较大的脑转移瘤,早期颅内局控率高[15]。另研究认为,脑转移灶高剂量照射病人的生存时间较长;脑转移瘤照射剂量54.4 Gy可使病人获得更长的生存期。另有研究表明,对肺癌等增殖较快的肿瘤,延长放疗时间会直接降低脑转移瘤的局控率。同步推量调强放疗治疗多发性脑转移瘤也有明显优势[16]。综上结果,减时增量的同步推量调强放疗技术可能会使病人受益。
已有多项研究探讨同期推量调强放疗的疗效及安全性。刘刚等[17]的结果显示,同期推量放疗组病人的完全缓解率为72.4%(55/76),1、2和3年生存率分别为64.5%、31.6%、11.8%,均高于序贯治疗组病人。程学斌等[18]对32例肺癌脑转移病人研究显示,同期推量放疗总有效率为71.9%,肿瘤局部控制率为96.9%,1年生存率为44%,治疗不良反应发生率低。本文采用同步推量调强放疗对我院收治的肺癌脑转移瘤病人进行治疗,结果显示,序贯组有效率为68.0%,同步组有效率为92.0%;放疗后6个月,序贯组生存率为36.0%,同步组为64.0%,同步组生存率高于序贯组,说明同步推量调强放疗治疗肺癌脑转移瘤效果较传统方法有所提高。这与相关研究结果一致[19]。有研究显示,同步推量调强放疗治疗肺癌脑转移瘤不仅效果优于序贯放疗法,且脑转移瘤靶区适合度也有优势,配合图像引导放疗治疗更为安全、有效[20]。
放疗的关键是照射剂量及分割方案的确定,主要在于肿瘤细胞的杀灭和正常组织损伤的平衡。同步推量调强放疗技术可以给肿瘤区域增加放疗剂量,且不增加放射损伤。王浩等[21]的研究显示,与全脑36 Gy/20 f同期加量、转移灶24 Gy/20 f
剂量分割模式相比,全脑40 Gy/20 f、转移灶加量20 Gy/10 f治疗病人生存率和局控率未见明显差异,不良反应也未见差异,但因同步推量组治疗时间明显缩短,疗效确切,病人对不良反应有很好的耐受,因此更推荐同步推量的分割及治疗方式。范华平等[22]对比了同步推量全脑PTV 1.8 Gy/f、PGTV 2.2 Gy/f共25 f,及全脑2 Gy/f共20 f、后期大的转移灶(直径>1 cm)2 Gy/f共5~10 f治疗效果,结果显示同步推量调强放疗有效率及放疗后1年生存率均明显好于适形序贯组,且能够在降低正常组织器官受量的同时,提高病灶GTV靶区的治疗量,提高了局控率。ANTONI等[23]报道,病人行全脑放疗30 Gy/10 f,局部加量9 Gy/3 f,中位生存期分别是5.9月和3.7月。同步推量组局部控制率更高,原因可能与转移病灶单次放疗分割剂量较高,以及同期推量放疗可逆向调整放疗强度使肿瘤靶区剂量高于邻近组织,且尽可能地保护正常组织细胞有关[24]。
我们的前期研究结果显示,同步推量调强放疗对正常组织保护明显优于同期全脑适形序贯推量放疗,病人血液学及脑损伤不良反应发生率亦明显降低[25]。本研究结果显示,同步组脑损伤不良反应发生强度低于序贯组,病人耐受性较好,无病人因为严重不良反应导致治疗暂停。有研究回顾性分析了同步推量调强放疗治疗头颈部肿瘤的毒副反应,结果显示其毒副反应较低[26]。SPIOTTO等[27]比较了379例Ⅲ~Ⅳ期非转移性头颈部肿瘤病人应用3D-CRT、SEQ-IMRT、同步推量调强放疗治疗的毒副反应,结果显示同步推量调强放疗虽然没有提高病人的疗效,但放射性毒副反应明显降低。RODRI-GUES等[28]应用同步推量技术进行了Ⅰ期临床剂量递增试验,显示全脑放疗30 Gy/10 f、脑转移灶同期加量至60 Gy/10 f,并未产生治疗相关严重不良反应,有效率较高。本文研究结果与其一致。
颅脑放疗作为一种姑息治疗的手段,主要应考虑其治疗的安全性,其对血液学和胃肠功能等的影响有限,临床观察到的血液学毒性和胃肠毒性普遍较轻。本文个别病人出现不可耐受的不良反应,经
积极对症处理均有好转,未影响治疗。本文结果显示,同步推量调强放疗与序贯放疗比较,血液学、胃肠道毒性均未增加。理论上讲,单次分割剂量越高对脑组织的损伤越大,本文由于观察时间较短,因此对神经认知功能等神经损伤还需更长时间的观察。
综上所述,對于肺癌脑转移瘤,尤其是多个转移瘤,采用同步推量调强放射治疗,可以在实现全脑放疗的同时尽早给予脑转移病灶更高的治疗剂量,在延长病人生存期的前提下缩短治疗时间,节省医疗资源。但是全程调强费用昂贵,限制了其应用,其对于脑转移瘤的局部控制率及病人更长时间的生存率还有待大样本前瞻性研究来进一步证实。
[参考文献]
[1]殷蔚伯,余子豪,徐国镇,等. 肿瘤放射治疗学[M]. 北京:中国协和医科大学出版社, 2009:1350-1352.
[2]院刚,张晨武,李小军,等. 调强放疗(IMRT)治疗颅内转移瘤的临床研究[J]. 疾病监测与控制, 2015,9(9):618-619.
[3]FRAZIER J L, BATRA S, KAPOR S, et al. Stereotactic ra-diosurgery in the management of brain metastases: an institutional retrospective analysis of survival[J]. International Journal of Radiation Oncology Biology Physics, 2010,76(5):1486-1492.
[4]徐海亭,张涛,沈曼曼,等. 全脑同期推量调强放射治疗对颅脑多发性转移癌患者的应用效果[J]. 实用癌症杂志, 2015,30(11):1738-1740.
[5]王静,周志孝. “减时增量”放疗技术原理及临床应用[J]. 中国医学物理学杂志, 2008,3(2):555-559.
[6]EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. European Journal of Can-cer, 2009,45(2):228-247.
[7]LIU Wenjing, ZENG Xiantao, QIN Haifeng, et al. Whole brain radiotherapy plus chemotherapy in the treatment of brain metastases from lung cancer: a meta-analysis of 19 rando-mized controlled trails[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2012,13(7):3253-3258.
[8]李明,刘伟. 脑转移瘤全脑放疗同步立体定向放射治疗的临床观察[J]. 中华肿瘤防治杂志, 2013,20(8):611-613.
[9]赵儒钢,孟祥颖,申戈,等. 贝伐珠单抗治疗脑转移瘤难治性瘤周水肿的疗效分析[J]. 临床肿瘤学杂志, 2016,21(3):233-237.
[10]马玉超,肖建平,毕楠,等. 大分割放疗联合替莫唑胺治疗大体积脑转移瘤的前瞻性临床研究[J]. 中华放射肿瘤学杂志, 2016,25(4):320-326.
[11]邱艳芳,杨雯娟,刘志刚,等. 同期整合推量调强放射治疗在肿瘤中的研究进展[J]. 肿瘤学杂志, 2017,23(6):523-527.
[12]ESIASHVILI N, KOSHY M, LANDRY J. Intensity-modulated radiation therapy[J]. Curr Probl Cancer, 2004,28:47-84.
[13]LIANG Xiaodong, NI Lingqin, HU Wei, et al. A planning study of simultaneous integrated boost with forward IMRT for multiple brain metastases[J]. Medical Dosimetry, 2013,38(2):115-116.
[14]KOCHER M, TREUER H, VOGES J, et al. Computer simulation of cytotoxic and vascular effects of radiosurgery in solid and necrotic brain metastases[J]. Radiotherapy and Oncology, 2000,54(2):149-156.
[15]EDWARDS A A, KEGGIN E, PLOWMAN P N. The developing role for intensity-modulated radiation therapy (IMRT) in the non-surgical treatment of brain metastases[J]. The British Journal of Radiology, 2010,83(986):133-136.
[16]崔建国,吴星娆,夏群,等. 多发性脑转移患者全脑同期推量调强放疗疗效分析[J]. 河北医学, 2014,20(10):1628-1631.
[17]刘刚,张秀亮,张亚男,等. 同期推量放射和全脑照射+三维适形放射序贯治療非小细胞肺癌脑转移瘤的疗效及影响预后因素分析[J]. 海南医学, 2017,28(4):554-556.
[18]程学斌,肖林. 适形调强放疗同期整合瘤床推量治疗肺癌脑转移瘤的可行性研究[J]. 中国癌症杂志, 2016,26(8):687-692.
[19]应申鹏,单国平,于长辉,等. 全脑放疗联合同期推量调强技术治疗多发脑转移瘤7例[J]. 肿瘤学杂志, 2011,17(1):42-45.
[20]何君,张成大,贾霖. 全脑放疗同步瘤床推量治疗肺癌脑转移瘤临床疗效及预后分析[J]. 肿瘤防治研究, 2018,8:587-592.
[21]王浩,吳磊,王天昶,等. 同步加量放疗技术在非小细胞肺癌脑转移患者中的应用[J]. 现代肿瘤医学, 2014,22(9):2075-2078.
[22]范华平,刘瑞振. 同步推量调强放疗治疗多发脑转移瘤的疗效分析[J]. 中国农村卫生, 2015,1(11):54-55.
[23]ANTONI D, CLAVIER J B, SCHUMACHER C, et al. 3D radiationtherapy boost improves the outcome of whole brain radiation therapy treated RPAⅡ patients with one or two brainmetastases[J]. International Journal of Molecular Sciences, 2014,15(5):7554-7562.
[24]张波,苏胜发,欧阳伟炜,等. 放化疗联合脑转移瘤放疗治疗非小细胞肺癌脑转移的临床疗效分析[J]. 中国癌症防治杂志, 2016,8(1):22-26.
[25]张芹,董叶. 同步推量调强放疗治疗脑转移瘤的临床研究[J]. 中国老年保健医学, 2014,12(2):83-84.
[26]JIN X, YI J, ZHOU Y, et al. A new plan quality index for nasopharyngeal cancer SIB IMRT[J]. Physica Medica: PM, 2014,30(1):122-127.
[27]SPIOTTO M T, WEICHSELBAUM R R. Comparison of 3D confromal radiotherapy and intensity modulated radiotherapywith or without simultaneous integrated boost during concurrent chemoradiation for locally advanced head andneck cancers[J]. PLoS One, 2014,9(4):e94456.
[28]RODRIGUES G, YARTSEV S, YAREMKO B, et al. Phase Ⅰ trial of simultaneous in-field boost with helical tomotherapy for patients with one to three brain metastases[J]. International Journal of Radiation Oncology Biology Physics, 2011,80(4):1128-1133.
