小球藻适宜培养营养盐以及添加单糖对生长的影响
2019-09-10刘秀花梁梁杜风光王有名梁峰
刘秀花 梁梁 杜风光 王有名 梁峰



摘 要:木糖为自然界中最丰富和经济的糖资源之一,但木糖很少被证明是野生型微藻的碳源。本实验的目的是确定小球藻的最适培养基以及对糖的具体利用情况。通过对小球藻干重和培养后的藻液中糖含量的测定发现,在HSM培养基中,小球藻生长较好,最适pH为6.5。添加木糖对小球藻的生长存在一定的抑制作用,随着糖含量的增加,抑制越来越严重。在木糖含量扩大培养中发现,木糖耐受在6g/L左右。之后进行混合糖(木糖和葡萄糖)培养小球藻,确定混合糖培养效果明显好于单糖培养;经过薄层层析和DNS对培养后的藻液进行测定,结果发现,有葡萄糖存在时,小球藻优先利用葡萄糖。
关键词:小球藻;木糖;葡萄糖;薄层层析
中图分类号:S963.213 文献标识码:A 文章编号:1003-5168(2019)17-0136-06
Abstract: Xylose is one of the most abundant and economical sugar resources in nature, but xylose is rarely proven to be a carbon source for wild-type microalgae. The purpose of this experiment was to determine the optimum medium for Chlorella and the specific use of sugar. By measuring the dry weight of the Chlorella and the sugar content in the algae after the culture, it was found that the Chlorella grew well in the HSM medium, and the optimum pH was 6.5. The addition of xylose had a certain inhibition on the growth of Chlorella, and as the sugar content increases, the inhibition became more and more serious. In the expansion of xylose content, xylose tolerance was found to be around 6 g/L. After the cultivation of Chlorella with mixed sugar (xylose and glucose), it could be confirmed that the mixed sugar culture effect was significantly better than the monosaccharide culture, and the cultured algae liquid was measured by thin layer chromatography and DNS, and it was found that there was glucose present. Chlorella preferentially utilized glucose.
Keywords: Chlorella;xylose;glucose;thin layer chromatography
1 研究背景
小球藻为绿藻门小球藻属(Chlorella sp)普生性单细胞绿藻,以光合自养生长繁殖,分布广泛,尤以淡水水域种类为最多,生物量大。小球藻通过光合作用将CO2转化为生物燃料、食物、饲料和高价值的生物活性物质。以小球藻为原料,可以生产几种不同的可再生生物燃料,如通过小球藻生物质的厌氧消化生产沼气;小球藻的油脂可以提炼生物柴油;光生物学上的生物产氢等[1]。另外,小球藻具有多种保健和药理作用,是目前保健食品开发应用较理想和研究较多的微藻之一。通过对微藻生长过程中能量和碳代谢的分析,Yang等人[2]证明了异养和混合营养培养比光养细胞产生了更多的ATP和生物量。
但是,有机碳供应的可用性和可持续性仍然是大规模应用的限制因素。木质纤维素材料是有前途的原料,这主要是因为其较为丰富且成本相对较低。单糖可以从木质纤维素的水解获得,且可以用作微藻异养或混合营养培养的碳源。D-葡萄糖(主要来自纤维素)和D-木糖(来自半纤维素)是木质纤维素水解产物中的两种主要碳水化合物。D-葡萄糖被证明是许多微藻生长的合适碳源,如C. rypthecodinium cohnii, Schizochytrium sp,Nitzschia laevis,Euglena gracilis,Galdieria sulphuraria和Chlorella等[3]。尽管学术界已经深入研究了用D-葡萄糖培养微藻,但关于D-木糖利用的报道非常有限。缺乏有效的摄取系统和(或)相关的代谢途径可能是导致这种情况的主要原因。Neish[4]评估了各种碳水化合物对小球藻(Chlorella vulgaris)生長的影响。结果表明,D-葡萄糖、D-果糖、D-半乳糖和β-葡萄糖苷是藻类生长的碳和能量的物质来源,但很少甚至没有关于包括木糖的戊糖生长的模拟。同样,Samejima和Myers[5]发现尽管葡萄糖和半乳糖支持微藻生长,但是C. pyrenoidosa和小球藻椭球体很难在木糖上生长。此外,Hassall[6]证明D-木糖不能用作微藻类pyrenoidosa化学合成的基质,相反,其作为光合作用的特异性抑制剂,在存在0.5%D-木糖(33mM)的情况下,细胞分裂被阻止并且微藻的颜色在几天内消失。
本文的研究目的是确定小球藻的最适培养基以及对糖的具体利用情况,将小球藻进行21d光照培养,对培养后的藻液进行DNS和薄层层析分析。通过不同培养基的比对、确定最适pH、小球藻对木糖的最大耐受、混合糖(木糖和葡萄糖)培养及薄层层析分析糖的具体利用情况,结果发现:在一定范围(0.5g/L)内,木糖对小球藻的生长并不表现出抑制;pH也是影响小球藻利用木糖生长的重要因素。此外还发现,葡萄糖存在时会降低木糖的利用,这也很好地佐证了葡萄糖为小球藻生长最佳碳源的结论。
2 材料和方法
2.1 实验材料
小球藻(Chlorella. sp)为生物精炼河南省工程实验室保藏小球藻L4;HSM培养基、BBM培养基溶液和BG-11用于小球藻营养培养基。
2.2 方法
2.2.1 培养。接种前,从斜面挑取小球藻在液体培养基上培养,置于26℃光照下培养,获得生长对数期的藻液,按107/100mL计数接种(采用血球计数法计数)于相应培养基,每组三个重复,后置于26℃照射21d。
2.2.2 生物量测定。收集适量藻液,于8 000r/min离心5min,沉淀于85℃下烘2h,后采用差重法称取干重。
2.2.3 还原糖测定。培养后的藻液经过离心后取上清,再进行DNS测定,计算糖利用率[7];培养后的藻液经离心后进行薄层层析分析,根据显色结果分析小球藻对糖的具体利用情况。
2.3 实验设计
本研究对比了小球藻在三种不同的培养基HSM、BBM和BG-11中的干重和木糖利用率,设置的木糖含量梯度为0.5、1.0、1.5g/L和2.0g/L,pH为7,经过21d光照培养后测小球藻的干重和木糖利用率。基于HSM培养基,分析小球藻利用木糖和葡萄糖的情况。前期研究显示,木糖会抑制小球藻生长,因此,为了使实验效果更明显,选择糖含量为2.0g/L。此外,为了分析pH对小球藻生长的影响,设置pH梯度为pH6、pH6.5、pH7、pH7.5和pH8。经过相同的培养条件后测小球藻干重和木糖利用率。为了分析小球藻对木糖的最大耐受,通过增加木糖含量进行实验。设置的木糖含量为1、2、4、6、8、10g/L和12g/L,pH选最优pH,为6.5,同样经过21d光照培养,测小球藻干重和木糖利用率。为了进一步优化实验,对其进行混合糖培养,由此来确定混合糖培养是否有利于小球藻的生长。为了分析混合糖中各组分的具体利用情况,采用薄层层析对培养后的藻液进行分析。
3 结果与讨论
3.1 不同培养基对小球藻生长的影响
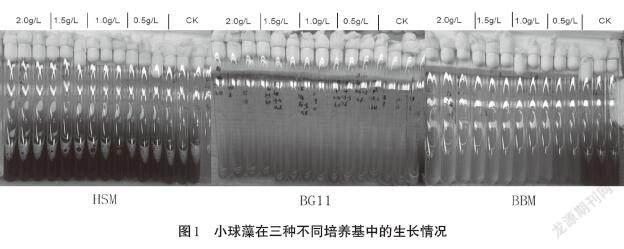
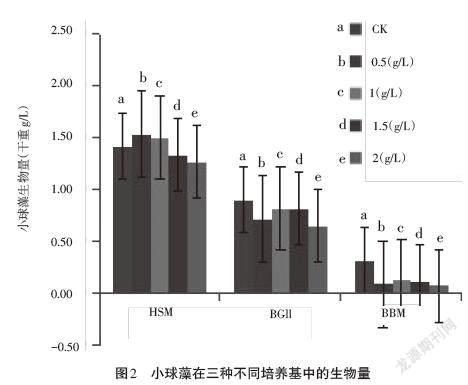
小球藻在三种不同的培养基中经过21d培养后,生长情况如图1所示。培养液颜色的深浅可以大体反映小球藻的生物量。从图中可以明显看出:小球藻在HSM培养基中颜色最深,说明其生长得较好;在BG11培养基中颜色较浅;BBM培养基中颜色较BG11更浅。单独来看每一种培养基,在HSM中,木糖浓度的增加对小球藻生长的影响不明显;BG11培养基中每组分小球藻生长情况差异也不大;而在BBM培养基中,可以明显看出小球藻液存在一定的梯度,最右边颜色最深的为CK,之后木糖含量增加,小球藻液颜色越来越浅,可见,木糖对小球藻的生长存在抑制作用。小球藻具体的生物量以及木糖的利用情况如图2和图3所示。
从图2和图3可以看出,在HSM培养基中,添加木糖对小球藻生长存在一定的影响,当木糖含量为0.5g/L和1.0g/L时,小球藻的生物量略高于CK;而随着木糖含量的增加,小球藻的生物量开始下降,说明木糖开始抑制小球藻的生长。整体来看,添加木糖使得小球藻的生物量先增加后降低。在BG11培养基中,CK的小球藻生物量高于实验组,说明木糖抑制了小球藻的生长。但木糖含量不同,对小球藻生长的抑制情况也不同,当木糖含量为1.0g/L和1.5g/L时,小球藻的生物量有所增加,但仍低于CK。在BBM培养基中,添加木糖对小球藻的生长抑制明显,实验组的生物量明显低于CK。
就三种培养基而言,三种培养基中的CK差异也明显,在HSM培养基中,小球藻生长明显好于其他两种培养基。这主要是因为这三种培养基中的盐分、碳源和氮源含量不同:HSM培养基中的C含量要高于其他两种培养基;BG11和BBM中的N含量相对较高。此后的实验都基于HSM培养基。
3.2 初始糖的不同及pH对小球藻生长的影响
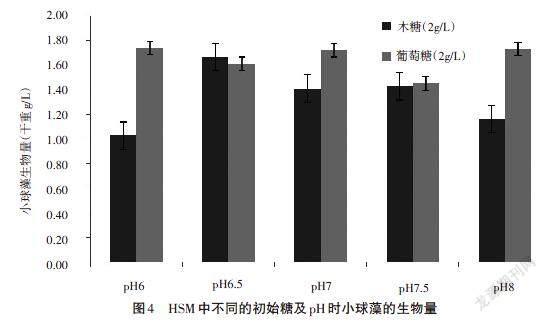
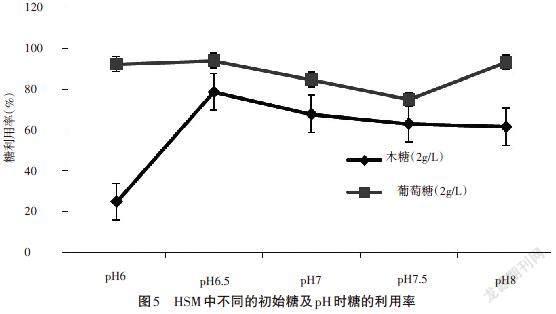
添加的初始糖为木糖和葡萄糖,含量都为2g/L时,小球藻在不同pH的HSM培养基中的干重和糖利用率如图4和图5所示。
从图4和图5可以看出,添加的初始糖不同,小球藻的生物量也存在一定差异。在相同的pH下,初始糖为葡萄糖时,小球藻的生物量相对好于木糖,只有在pH为6.5时,初始糖为木糖时小球藻生物量略高于葡萄糖。造成这种现象的原因是葡萄糖作为碳源能更快地进入代谢循环,适宜小球藻的生长,而木糖并不能直接作为小球藻的碳源,木糖含量的增加或者pH的改变都可能抑制小球藻的生长。初始糖为木糖时,随着PH的增加,小球藻的生物量呈现出先增加后降低的趋势;pH为6.5时,小球藻生物量最高,之后开始下降。圖5的木糖利用率趋势和图4的小球藻干重趋势大致相同。当初始糖为葡萄糖时,pH为6、7和8时,小球藻生物量差异不大;pH为7.5时,小球藻生物量最低,且葡萄糖的利用率也是最低。可见,葡萄糖的利用率整体高于木糖。综上,pH也是影响小球藻生长的重要条件。初始糖为木糖时小球藻最适宜的pH为6.5,此后实验选择6.5为初始pH。
3.3 小球藻对木糖的最大耐受
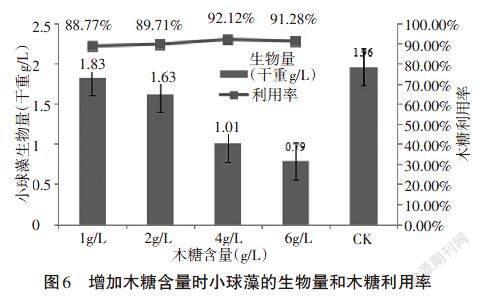
增加木糖含量时,小球藻的生物量和木糖利用率如图6所示。
从图6可知,CK和木糖浓度为1.0g/L时,小球藻生物量高于上述结果,说明小球藻在pH为6.5时生长较pH为7.0时有明显优势。同时可以发现,培养基中只有木糖时,随着糖含量的增加,小球藻的生物量随之下降,说明木糖对小球藻的抑制作用越来越严重,木糖含量为6g/L时,小球藻的生物量仅为0.79g/L。图中并未显示出6g/L后的实验数据,这是因为木糖含量继续增加时,小球藻的生长已经严重受影响,不能正常生长而死亡,故无实验数据。由此可得出,小球藻对木糖的最大耐受在6g/L左右。
3.4 混合糖培养对小球藻生长的影响
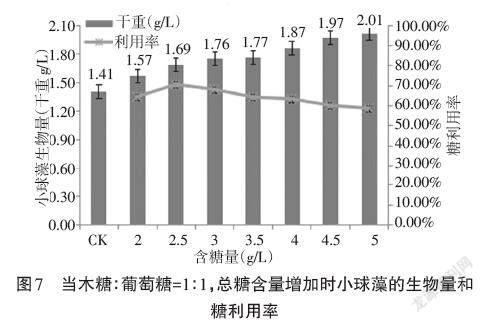
同时添加木糖和葡萄糖,总糖含量为2、2.5、3、3.5、4、4.5、5g/L,以木糖∶葡萄糖分别为1∶1和1∶1.5进行实验,观察对小球藻生长的影响。培养后测得的小球藻生物量和利用率如图7和图8所示。
通过这两组实验可以明显发现,混合糖培养效果好于单糖培养。当木糖∶葡萄糖为1∶1时,小球藻的生物量随着糖含量的增加不断增加,但糖利用率却在下降。干重在糖含量为5g/L时出现最大,为2.01g/L,而糖利用率在糖含量为2.5g/L时出现最大,为70.31%。当木糖:葡萄糖为2∶3时,大体趋势和木糖∶葡萄糖为1∶1时相似,最大干重出现在木糖含量4.5g/L时,为2.06g/L,最大的糖利用率出现在糖含量3g/L时,为76.25%。这可能是由于添加了葡萄糖之后,会改善木糖对小球藻生长的抑制。为了分析混合糖中木糖和葡萄糖的具体利用情况,下面进行薄层层析分析糖的具体利用情况。
3.5 薄层层析分析混合糖利用情况
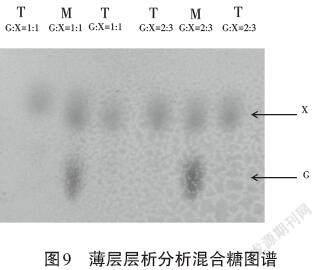
此次进行分析的总糖含量为6g/L,在木糖∶葡萄糖分别为1∶1和1∶1.5时进行实验,显色后的情况如图9所示。
注:T为实验组;M为糖标准液;G为葡萄糖;X为木糖。
通过图谱分析发现,实验组中都未显示出葡萄糖的点,说明葡萄糖大部分被利用,而木糖点的颜色会略浅于实验组,说明木糖被少部分利用。这个图直观反映了混合糖培养时小球藻会优先利用葡萄糖,当葡萄糖用完时才开始利用木糖。基于这个猜想,经过DNS计算过利用总糖后,对这次实验数据进行进一步处理,结果如表1所示。
从表中可以清晰地发现,加入葡萄糖过多,导致木糖几乎没有利用。当木糖∶葡萄糖=1∶1时,木糖可以被少许利用,和之前只加木糖的实验相比,木糖的利用明显降低。当木糖∶葡萄糖=2∶3时,木糖几乎没有被利用。分析认为,当有葡萄糖存在时,小球藻会优先利用葡萄糖,当葡萄糖耗尽时才开始利用木糖;加入葡萄糖确实有利于小球藻生长,但会限制木糖的利用。因此,为了提高小球藻利用木糖的量,应添加适量的葡萄糖。
4 结论
通过分析上述实验数据可以发现,小球藻在HSM培养基中可以利用木糖,且小球藻的生物量也明显好于其他两种培养基;在木糖含量为0.5g/L时,小球藻生长情况较好且木糖的利用率也较高。此浓度下,并未表现出木糖对小球藻生长的抑制,但木糖含量增加会对小球藻生长产生抑制作用。从小球藻对木糖最大耐受实验中可以看出,只有木糖存在时,木糖含量增加,小球藻生长情况变差,木糖含量超过6g/L后,小球藻已经不能正常生长。之后进行的不同pH培养可以发现,pH对小球藻的生长确实存在一定影响,当pH为6.5时,小球藻的干重明显优于pH为7时,因此之后部分实验pH选为6.5。在进行混-
基于此猜想,对DNS测糖利用的数据进行进一步分析发现,在混合糖实验中,假设葡萄糖全部被利用,经过计算,发现木糖的利用最大,为0.7g/L,在单糖实验中,当木糖含量为6g/L时,木糖利用可以达到5.4g/L,而在2g/L木糖单独存在时,木糖的利用可以达到1.8g/L,相比于只加木糖,添加葡萄糖使得小球藻对木糖的利用大大降低。通过这些数据可以发现,在一定范围内,随着木糖含量的增加,小球藻利用木糖的量也在增加,但其生长已经受到抑制。当培养基中加入葡萄糖后,小球藻的生长情况可以得到明显改善,但木糖的利用明显减少,小球藻会大量利用葡萄糖,也就是说,加入葡萄糖可以缓解木糖对小球藻生长的抑制。在之后的实验中,会继续探究小球藻对木糖的利用情况,寻找葡萄糖的最适含量,以得到小球藻生长最适宜的糖浓度。
参考文献:
[1]Kapdan I K, Fikret Kargi. Bio-hydrogen production from waste materials[J]. Enzyme & Microbial Technology,2006(5):569-582.
[2]Yang C, Hua Q, Shimizu K. Energetics and carbon metabolism during growth of microalgal cells under photoautotrophic, mixotrophic and cyclic light-autotrophic/dark-heterotrophic conditions[J]. Biochemical Engineering Journal,2000(2):87-102.
[3]Bumbak F, Stella Cook, Vilém Zachleder, et al. Best practices in heterotrophic high-cell-density microalgal processes: achievements, potential and possible limitations[J]. Applied Microbiology & Biotechnology, 2011(1):31-46.
[4]Neish A. C. Carbohydrate nutrition of Chlorella vulgaris[J]. Can J Bot,1951(29):68-78.
[5]Samejima H, Myers J. On the Heterotrophic Growth of Chlorella pyrenoidosa[J]. Journal of General Microbiology, 1958(1):107.
[6]Hassall K A. Xylose as a Specific Inhibitor of Photosynthesis[J]. Nature, 1958(4618):1273-1274.
[7]劉秀花,崔孟岐,王莉,等.双向薄层色谱法分析混合糖组分[J].商丘师范学院学报,2015(6):69-73.
[8]Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugars[J]. Analytical Chemistry,1959(3):426-428.
[9]刘秀花,王莉,张淑红,等.薄层色谱法分析玉米芯降解液糖类成分优化研究[J].商丘师范学院学报,2014(9):55-59.
