小球藻固定CO2能力与油脂积累条件研究
2019-09-10梁梁杜风光陈嘉山刘秀花梁峰
梁梁 杜风光 陈嘉山 刘秀花 梁峰
摘 要:小球藻生长速率快、易于培养且能进行光合作用,可作为生物法固碳的优良材料。而CO2作为全球变暖的元凶,如何减少大气中CO2含量已是当今热门话题。但目前对小球藻去除CO2的研究中,大规模培养的较少。因此,本实验以120L玻璃封闭的自制大容器为培养器,以HSM1添加植物激素6-BA 0.5mg/L为培养基,培养时持续通入CO2和空气,通气量为1L/min,CO2的浓度为6.56%,并进行光照、水循环等,对小球藻进行大规模培养。结果表明:小球藻对CO2的去除率最高达24.09%,鲜重为3.624g/L,产油能力为0.14g/L。
关键词:小球藻;大规模培养;生物固碳;生物燃料
中图分类号:Q945 文献标识码:A 文章编号:1003-5168(2019)17-0131-05
Abstract: Chlorella has a high growth rate, is easy to cultivate and can perform photosynthesis, and can be used as an excellent material for biological carbon fixation. CO2, as a greenhouse gas, is the main culprit of global warming. How to reduce CO2 content in the atmosphere is a hot topic today. In the current study of CO2 removal by Chlorella, large-scale cultures are less common. Therefore, in this experiment, a large-scale culture of Chlorella vulgaris was carried out in a 120L glass-enclosed self-made container with HSM1 and phytohormone 6-BA 0.5mg/L as the medium. During the culture, CO2 and air were continuously injected with a ventilation rate of 1L/min and a concentration of CO2 of 6.56%. Light and water circulation were also carried out to culture Chlorella vulgaris on a large scale. The results showed that the highest CO2 removal rate of Chlorella was 24.09%, fresh weight was 3.624g/L, and oil production capacity was 0.14g/L.
Keywords: Chlorella;large-scale culture;biological carbon fixation;biofuel
小球藻(Chlorella)為绿藻门小球藻属普生性单细胞绿藻,是一种球形单细胞淡水藻类,直径3~8μm,内有一个周生、杯状或片状的色素体,是一种高效的光合植物。微藻固碳已经成为消减温室气体排放的新的研究热点[1]。自养型藻类主要依靠CO2和光能生长,在光合作用过程中,藻类吸收CO2,并将其转化为糖、蛋白质、油脂等生物质能。藻类对光量子(太阳能)的吸收转化率可达8%~10%,而一般农作物的光能转化率只有1%~3%[2]。每生产100t微藻,约可吸收利用470t碳元素,可转化掉185t CO2。因此,藻类养殖是控制和减少大气中CO2的一种有效途径[3]。在300mL的小培养容器中,对CO2的去除率为27.69%,固碳量达到256.86mg/(L·h)[4],而小球藻去除CO2的研究必将迈向大容器、大规模培养。小容器培养与大容器培养中存在许多微小且令人意想不到的问题,这些问题也是在实验的深入研究中所必须要面临的。
对于以消减大气中CO2为目的大规模微藻培养,其主要利用微藻生长速度快、易于培养且能达到较高密度培养的特性来进行本次实验。本实验选用实验室分离纯化的一株小球藻,生长迅速,抗逆性强,且能在杂藻及杂菌中优势生长,可作为CO2减排藻株。以HSM1添加6-BA为其培养基,并在培养过程中,对光照强度、通气量、容器内水循环等进行控制。本文主要分析大容器培养中,每个时期的CO2去除率,并观察其变化,分析变化的内外原因。同时,观察并测量每个时期的生物量,最后将其回收并测量藻内含油量,以为后续生物精炼方向的研究提供参考。
1 材料与方法
1.1 试验材料
试验菌株为小球藻,来自于生物精炼河南省工程实验室。本实验的基本培养基为HSM1培养基,其成分为:NH4Cl 0.500g/L,K2HPO4 1.440g/L,KH2PO4 0.720g/L,MgSO4·7H2O 0.020g/L,CH3COONa 2.000g/L,CaCl2·2H2O 0.010g/L,Trace 1mL。其他涉及培养基有以下三种。
BBM培养基:NaNO3 0.250g/L,KH2PO4 0.175g/L,K2HPO4 0.075g/L,MgSO4·7H2O 0.075g/L,CaCl2·2H2O 0.025g/L,NaCl 0.025g/L,Trace 1mL。
DS培养基:NaNO3 0.300g/L,CO(NH2)2 0.150g/L,K2HPO4·3H2O 0.050g/L,FeC6H5O7 0.006g/L,CaCl2·2H2O 0.025g/L,Trace 1mL。
SE培养基:NaNO3 0.250g/L,K2HPO4·3H2O 0.075g/L,MgSO4·7H2O 0.075g/L,CaCl2·2H2O 0.025g/L,KH2PO4 0.180g/L,NaCl 0.025g/L,FeCl3·6H2O 0.010g/L,Fe-EDTA 1mL。
1.2 试验方法
1.2.1 CO2发生器的制作。取两个2L的雪碧空瓶,并贴上A、B标签。A瓶装200g柠檬酸加600mL水,B瓶装200g小苏打加300mL水,摇匀待用。然后取双出口瓶盖两个,并贴上A、B标签。A盖顶部一个口接压力表,另一个口连接B盖,下部接有通到瓶底的管子;B盖一个口连接A盖,其接口下部接有连接斜三角的管子(使其内液体单向流动,即A瓶液体能进入B瓶,B瓶液体不能进入A瓶,且B瓶的气体能进入A瓶),另一个口为出气口,其上接有调节出气量的阀门。
接着盖上瓶盖,挤压A瓶,使其内柠檬酸进入B瓶与小苏打反应;松开A瓶,B瓶气体进入A瓶,所以两瓶气压相等。重复挤压几次后,随着小苏打与柠檬酸反应,内部气压升高,以致挤压不动时,打开出气口5s左右,使B瓶气压降低,A瓶的柠檬酸就会再次进入B瓶,关紧出气口。摇晃B瓶,使其产生更多CO2,待压力表上压力为1.5左右时,出气口接上通往培养器内的管子即可。为了保证安全,在压力表处接上自动泄压阀,也可手动泄压,防止瓶内压力过高。
1.2.2 培养装置的制作。光照:用8条LDE长条灯带环绕在玻璃培养器周围,顶部装上吸顶灯环形替换光源。测得内部光照强度大约为3 000lx。循环:玻璃培养器内部装上两个多功能潜水泵,提供内部的水循环,且保证一定的搅拌效果,防止过多的小球藻沉淀。通气:外部装上超静音增氧泵和CO2发生器,通过橡胶管接入培养器内;每根橡胶管装上止逆阀,防止内部水倒流;培养器内的橡胶管末端接上空气细化器,使气体均匀进入培养器。电源的接通:以上仪器均接于智能控制插座上,可自动控制以上仪器开启和关闭的时间。气密性检查:开启增氧泵,同时集气口接上集气袋,观察集气袋是否有气体进入,正常进入即制作完成。
1.2.3 培养基的选择及改良。用250mL的三角瓶对本实验室小球藻进行培养基的选择及改良实验。本实验用BBM、DS、SE、HSM1四种培养基培养小球藻,对其生长情况及油脂积累情况进行比较,选出最优。同时,用最优培养基添加不同的植物激素2,4-D、6-BA 0.5mg/L,对其生长情况及油脂积累情况进行比较,选出最优作为大容器培养的培养基。
1.2.4 菌种的活化。配制HSM1固体培养基20mL,然后和事先包扎好的10个平板一起放入灭菌锅灭菌。灭过菌之后,在超净工作台中开始倒完平板,待平板凝固后拿出斜面保存着的菌种,进行四区划线。最后,将划好线的平板放入培养箱内培养4~5d。
1.2.5 种子液的配制。配制好HSM1培养基后,对其进行灭菌。灭完菌,待冷却后,拿出之前活化好的平板,在超净工作台中,挑取单菌落接入锥形瓶里的培养基中。将接好的种子液进行光照培养4~5d。
1.2.6 计数接种。对培养了5d的种子液进行计数,并通过计算得出大约接种子液100mL,使得玻璃培养器中的含藻量为105个/mL。
1.2.7 气体的测量。用气体收集袋收集培养器内1min所排出的气体,再利用排水法得出气体的体积。CO2浓度的测量:用收集袋收集培养器内的气体,再用便携红外气体分析仪测量收集袋中气体的CO2浓度。根据气体流量和通入气体与流出气体中CO2的浓度变化算出小球藻对CO2的去除量和去除率[5]。
1.2.8 生物量的测定。浊度法:从玻璃培养器中取小球藻培养液,合理稀释后在680nm下测定其光密度值,以OD680来衡量小球藻的相对生长量。
鲜重法:在玻璃培养器充分搅拌后,取100mL培养液,8 000r/min离心后将上清液倒掉,并将离心管倒置于报纸上,使其水分充分流失,称重。
1.2.9 回收及含油量的测定。将衰亡期的培养液进行沉淀、离心回收,并取10g的鲜菌于离心管中,加入6mol/L盐酸6~8mL,用玻璃棒搅拌均匀,超声波30min后放入沸水浴中水浴1d,取出放到冰中冷却后,加入95%乙醇10mL,用力摇匀,置于冰浴中10min。向离心管中加入5mL石油醚(30~60),5mL乙醚摇匀,4 800r/min,离心4min,小心用吸管吸取醚层液,放入已知重量的试管中(重量记为[m1])。再加入3ml石油醚(30~60),3mL乙醚摇匀,4 800r/min,离心4min,小心用吸管吸取醚层液,放入同个试管中。在烘箱中由低到高逐渐升温(不要暴沸),至85℃烘箱中干燥1h,取出冷却称重,直到达到恒重,重量记为[m2],既得小球藻油脂重(g)为[m=m2-m1],则可算得鲜菌的含油量。
2 結果分析
2.1 不同培养基对小球藻生长和油脂积累的影响
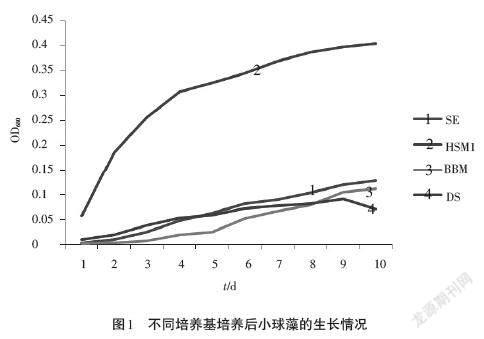
在培养小球藻的过程中,培养基是否合适至关重要。因此,在大规模培养之前,要对培养小球藻的培养基进行选择优化,选出最优培养基,并将其改良成为适合本实验的培养基,然后再开始进行实验。小球藻L4在4种培养基BBM、DS、SE、HSM1中培养,培养10d后小球藻的生长情况如图1所示。图1中OD680为原液稀释10倍的数值。从图1可以看出,以HSM1为培养基能使小球藻迅速生长,且具有较大的生物量。这可能与HSM1含有较大量的NH4Cl和CH3COONa有关,NH4Cl为小球藻提供充足的氮源,而CH3COONa具有缓冲作用,防止培养基过酸而导致藻细胞大量死亡。
小球藻L4在4种培养基BBM、DS、SE、HSM1中培养,培养10d后小球藻的油脂积累情况如图2所示。从图2可以看出,以HSM1为培养基收获的总油脂最多,这与其生物量大有关。因此,本实验室保藏的小球藻适合生长于HSM1培养基中。该培养基能使小球藻在短时间内快速生长,符合培养小球藻去除CO2的实验要求,并能在后期提供生物精炼方向的研究。在以下所有实验中均以HSM1为基础培养基。
2.2 不同植物激素对小球藻生長和油脂积累的影响
小球藻L4以HSM1培养基不加植物激素作为对照,添加植物激素6-BA、2,4-D培养10d,以100mL为培养单位的生长和油脂积累情况如表1所示。
从表1可以看出,在添加2,4-D的培养基中,小球藻的鲜菌重最高,但含油量低;而在添加6-BA的培养基中,虽然鲜菌重比添加2,4-D的培养基低,但含油量高。这主要是因为生物柴油是最常用的生物燃料之一,被公认为理想的可再生能源,因而也被看作为未来主要的能源来源。考虑到后期生物柴油方向的研究,选用HSM1添加植物激素6-BA为大容器培养的培养基。
2.3 大容器培养中小球藻的生物量变化
在以HSM1添加植物激素6-BA 0.5mg/L为培养基,培养时持续通入CO2和空气,通气量为1L/min,CO2的浓度为6.56%,光照强度为3 000lx的大容器培养中,小球藻受多种因素的影响,因此,和锥形瓶培养的结果会有所不同。大容器培养中小球藻的生长情况如图3所示。
图3中OD680为原液稀释10倍的数值。从图3可以看出,其延滞期比锥形瓶培养长了将近1d。因为通入CO2的原因,对数生长期生长情况优于锥形瓶培养。但是,在第6天提前进入了稳定期且OD680处于较低的状态,这可能与内部水循环不充分有关,导致藻体沉淀以及生长不良。
2.4 大容器培养中小球藻对CO2的去除
小球藻在生长过程中会进行光合作用,从而吸收CO2产生O2,达到去除CO2的目的。在120L的大容器培养中,在优化的培养基中通入含6.56% CO2的空气,通气量为1L/min,观察小球藻对CO2的去除情况,结果如图4所示。
图4上是大容器中CO2浓度的变化情况,图4下是CO2去除率的变化情况。从图4可以看出,小球藻在延滞期及对数生长前期吸收的CO2小于放出的CO2,之后对CO2的去除与生长具有一定的相关性。在此培养器中,有一段时间会有阳光直射,内部温度可能会升高,使小球藻的呼吸作用加强。小球藻去除CO2的量最终会反映到生物量上来。随着生物量的增加,颜色的加深,CO2的去除量及去除率逐渐与生长体现出相关性,培养8d时,去除率达到最高24.09%。最后,随着小球藻生长速率减慢,对CO2的去除率逐渐降低。
2.5 大容器培养中小球藻的回收及含油量
因为小球藻具有多方面的价值,因而被广泛应用于美容、医疗保健、生物精炼等行业。在大容器培养中,小球藻的生物量达到一定程度且稳定后,可对其进行回收利用,进行其他方面的检测,从而充分体现小球藻的价值。培养10d,大容器中小球藻的生长已达到相对稳定。生长情况如图5所示。
此时,生物量已达到稳定水平。但是,由于光线原因看起来会是不均匀的,后期将对光照装置进行改良。
回收的方法是先关掉所有设备,使其沉淀2d,去除上清,留取约20L,取出用8 000r/min离心。此收集法获得约200g鲜重,藻体含油量0.14g/L。小球藻藻体油滴的显微拍照如图6所示。
在图(b)中,红色为叶绿素,黄色为生物柴油。可见,大容器培养中小球藻的油脂较为明显,可进一步改进提取油脂的方法。
3 讨论
小球藻的生长繁殖快、抗逆性强、光合作用速率高、易于调控,适合用于生物工程技术方面的研究;同时,小球藻藻体具有很高的利用价值,具有较高的工业化潜力。因此,小球藻对CO2的固定有望成为一种可行性和经济价值较高的CO2固定方法。
小球藻除了可应用于CO2的固定外,因营养丰富,细胞壁极薄,易于消化吸收,在水产养殖方面也具有重要的经济价值;同时,小球藻的油脂含量高,微藻生物柴油是具有广泛发展前景的生物柴油;在污水处理的研究中也有较大的进展等。
本文的研究仅仅是初步探索大规模培养小球藻所面临的一些问题,而要真正深入探究及解决所带来的问题,还需要迎接巨大的挑战。
参考文献:
[1]宋成军,董保成,赵立欣,等.纯二氧化碳条件下小球藻固定CO2[J].环境工程学报,2012(12):4566-4572.
[2] Morison J I L, M.T.F. Piedade, E. Müller, et al. Very high productivity of the C4aquatic grassEchinochloa polystachyain the Amazon floodplain confirmed by net ecosystem CO2 flux measurements[J]. Oecologia, 2000 125(3):400-411.
[3] Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances,2007(3):294-306.
[4] Multidisciplinary B – A. BioCO2 - a multidisciplinary, biological approach using solar energy to capture CO2 while producing H2 and high value products[J]. Biomolecular Engineering, 2007(4):405-413.
[5]杨凯,战景明,高芬芳,等.小球藻用于生物柴油生产的研究进展[J].中国生物工程杂志,2015(11):99-104.
