调胃承气汤对肠源性脓毒症大鼠免疫功能的影响
2019-09-07赵锋利王澍欣罗苑苑郑述铭陈静赵馥冼绍祥
赵锋利 王澍欣 罗苑苑 郑述铭 陈静 赵馥 冼绍祥


[摘要] 目的 观察調胃承气汤(TWCQ)对肠源性脓毒症大鼠免疫功能的影响。 方法 将60只SPF级雄性SD大鼠按体重随机分为假手术组、模型组、乌司他丁组(30 000 U/kg)、TWCQ灌胃组(9.45 g生药/kg)、TWCQ灌肠组(9.45 g生药/kg)和TWCQ灌肠+乌司他丁组(n = 8),在造模后2、10、24 h分别给药,乌司他丁经腹腔注射给药,TWCQ根据组别分别通过灌胃途径和灌肠途径给药,在24 h结束实验。用酶联免疫吸附测定法(ELISA)检测血清中白细胞介素10(IL-10)和肿瘤坏死因子α(TNF-α)水平,流式细胞仪检测小肠系膜中CD4+和CD8+T淋巴细胞水平,并在光镜下观察小肠HE染色结果。 结果 与假手术组比较,模型组大鼠小肠系膜中CD4+/CD8+T淋巴细胞数的比例明显下降(P < 0.05),血清IL-10水平降低,TNF-α水平升高(P < 0.05),小肠可见明显的病理性损伤;与模型组比较,TWCQ治疗组大鼠小肠系膜中CD4+/CD8+T淋巴细胞数的比例明显上升(P < 0.05),血清IL-10水平升高,TNF-α水平降低(P < 0.05),并且模型小肠的损伤程度明显改善;与TWCQ灌胃组比较,TWCQ灌肠组的治疗效果更为明显(P < 0.05)。 结论 TWCQ具有改善肠源性脓毒症大鼠模型CD4+/CD8+T淋巴细胞比例、降低免疫炎症的功能,且灌肠疗法要优于灌胃疗法。
[关键词] 调胃承气汤;肠源性脓毒症;免疫功能;淋巴细胞
[中图分类号] R631.2 [文献标识码] A [文章编号] 1673-7210(2019)06(b)-0018-05
Influence of Tiaowei Chengqi Decoction on the immunologic function of rats with gut-derived sepsis
ZHAO Fengli1 WANG Shuxin2 LUO Yuanyuan1 ZHENG Shuming1 CHEN Jing1 ZHAO Fu1 XIAN Shaoxiang3
1.Intensive Care Unit, the First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangdong Province, Guangzhou 510405, China; 2.Acupuncture Department, the First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangdong Province, Guangzhou 510405, China; 3.the First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangdong Province, Guangzhou 510405, China
[Abstract] Objective To observe the influence of Tiaowei Chengqi Decoction (TWCQ) on the immunologic function of rats with gut-derived sepsis. Methods Sixty SPF male SD rats were randomly divided into sham operation group, model group, Ulinastatin group (30 000 U/kg), TWCQ gavage group (9.45 g/kg), TWCQ enema group (9.45 g/kg) and TWCQ enema + Ulinastatine group according to their body weight (n = 8). After modeling for 2, 10, 24 h, Ulinastatine was administered by intraperitoneal injection, respectively. TWCQ was administered by gastric way and enema way respectively according to different groups, and the experiment was completed at 24 hours. The levels of serum interleukin 10 (IL-10) and tumor necrosis factor α (TNF-α) were detected by enzyme linked immunosorbent assay (ELISA), the levels of CD4+ and CD8+ T lymphocyte in mesentery of small intestine were detected by flow cytometry, and the results of HE staining in small intestine were observed under light microscope. Results Compared with sham operation group, the proportion of CD4+/CD8+ T lymphocyte in mesentery of small intestine in rats of model group was decreased significantly (P < 0.05), the level of IL-10 was reduced and TNF-α was improved significantly (P < 0.05), and the pathological damage of small intestine could be seen obviously. Compared with model group, the proportion of CD4+/CD8+ T lymphocyte in mesentery of small intestine in rats of TWCQ treatment group increased significantly (P < 0.05), the level of IL-10 was improved and TNF-α was reduced significantly (P < 0.05), and the damage degree of model small intestine was improved obviously. Compared with TWCQ gavage group, the therapeutic effect of TWCQ enema group was more obvious (P < 0.05). Conclusion TWCQ has the function of improving the proportion of CD4+/CD8+ T lymphocyte and reducing immunologic function in model rats with gut-derived sepsis, and enema therapy is superior to gavage therapy.
[Key words] Tiaowei Chengqi Decoction; Gut-derived sepsis; Immunologic function; Lymphocyte
肠源性脓毒症是一种由肠道感染引发的全身性反应,主要包括引起宿主免疫功能失调,并最终导致多器官功能障碍[1]。肠源性脓毒症是ICU常见的危重病,其病情发展迅速,临床救治难度大,每年全世界患病人数超过数百万,病死率已超过脓毒症患者数量的四分之一,并且这一数据逐年上升[2-3]。肠源性脓毒症的发病机制主要包括肠黏膜机械屏障破坏、自身抵抗力下降及肠道微生态环境失衡[4-6]。尽管肠源性脓毒症的致病因素是多方面的,但机体对肠源性脓毒症的免疫反应将决定病情的走向,并且,过度而持久的炎性反应严重降低机体免疫功能,进一步加重病情[7-8]。同时,由于肠黏膜的破坏,经灌胃给药途径的药物生物利用度降低,而直肠黏膜血流丰富,利于药物的吸收,临床上常采用灌肠给药来提高疗效[9]。本研究通过大鼠盲肠结扎穿刺法(cecum ligation puncture,CLP)复制肠源性脓毒症大鼠模型,观察调胃承气汤(TWCQ)灌胃与灌肠疗法对模型大鼠的血清白细胞介素10(IL-10)和肿瘤坏死因子α(TNF-α)炎症水平的影响,并应用流式细胞术观察TWCQ对该疾病模型的免疫调节作用,从而探讨该中药汤剂对肠源性脓毒症大鼠肠黏膜的影响,解决脓毒症肠功能障碍的难题。
1 材料与方法
1.1 药物与试剂
大黄(130908261)、芒硝(130707541)和炙甘草(130713191)均购自康美药业股份有限公司:乌司他丁(商品名:天普洛安,广东天普生化医药股份有限司,批号:031609203,10万U)。大鼠TNF-α(569180 115)和IL-10(385r1229)酶联免疫吸附测定(ELISA)试剂盒均购自天津安诺瑞康生物技术有限公司;Anti-CD4-FITC(BioLegend,货号:201505);Anti-CD8-PE(Biolegend,货号:201712);APC CD3 Antibody(Biolegend,貨号:201413)。
1.2 仪器
Varioskan Flash型全波长多功能酶标仪(美国Thermo公司);Cytomics FC500 MPL流式细胞仪(Beckman Coulter,Inc);5450型小型高速离心机(德国Eppendorf公司);L-600台式大容量低速离心机(上海利鑫坚离心机有限公司);JJ500型电子天平(常熟市双杰测试仪器厂);BSA2245型电子天平(赛多利斯科学仪器有限公司)。
1.3 实验动物
48只SPF级雄性SD大鼠,体重280~320 g,由广东省医学实验动物中心提供,实验动物生产许可证号SCXK(粤)2013-0002,实验动物质量合格证号为440 07200047550。动物实验环境:广东省中医研究所SPF级动物实验室,设施使用许可证号为SYXK(粤)2010-0059。
1.4 分组与给药
将大鼠随机分为假手术组、模型组、乌司他丁组、TWCQ灌胃组、TWCQ灌肠组及TWCQ灌肠+乌司他丁组,每组8只。乌司他丁组(30 000 U/kg)以腹腔注射方式(3 mL/kg)给药,TWCQ灌胃组以灌胃方式(10 mL/kg)给药,TWCQ灌肠组通过直肠灌肠方式(3 mL/kg)给药,假手术组与模型组以灌胃方式给予等量生理盐水。TWCQ的临床处方量为105 g(大黄60 g、甘草30 g、芒硝15 g),以此临床用量为基础,换算得出大鼠临床给药剂量(9.45 g生药/kg)。在术后造模2、10、24 h分别给药,并在第3个时间点给药1 h后结束实验。
1.5 模型复制
采用CLP方法复制肠源性脓毒症大鼠模型[10]。实验前所有大鼠禁食12 h,用10%水合氯醛麻醉大鼠后,沿腹中线剪开约2 cm开口,小心取出盲肠置于用75%酒精消毒的纱布上,而后将粪便赶至盲肠尾端,用传统代号为1号的医用真丝编织线结扎盲肠50%,往盲肠尾端注射1 mL生理盐水稀释粪便,而后用针头穿孔3次,轻轻挤压盲肠使粪便流出后将盲肠小心放回腹腔。逐层缝合切口,腹腔注射37℃恒温生理盐水5 mL,使大鼠生理复苏。假手术组除不做盲肠结扎穿刺术外,其余同模型组。
1.6 血清相关指标检测
10%水合氯醛腹腔注射麻醉大鼠,从腹主动脉收集3 mL血液,以3000 r/min、12.42 cm离心半径离心10 min后,取血清于-80℃冻存。按照ELISA说明书检测血清中IL-10和TNF-α炎症水平。
1.7 淋巴细胞悬液制备与流式细胞仪检测
无菌取小肠系膜上的淋巴结,剪碎研磨,用预冷的PBS 缓冲液洗涤细胞2次,以12 000 r/min、8.4 cm离心半径离心10 min,弃掉上清液,调整淋巴细胞悬液浓度为1×107个/mL。取淋巴细胞悬液100 μL,按照试剂盒说明分别加入荧光素标记的CD3 0.5 μL、CD4和CD8单克隆抗体各1 μL,避光4℃孵育30 min,加入预冷PBS 1 mL重悬细胞,2400 r/min离心5 min,弃上清,细胞沉淀重悬于500 μL缓冲液,而后上机检测,并分析大鼠小肠系膜CD4+T细胞/淋巴细胞、CD8+T细胞/淋巴细胞、CD4+/CD8+T细胞的百分比。
1.8 HE染色
将小肠除去组织周围的脂肪及结缔组织,生理盐水冲洗后,用10%甲醛固定组织,随后依次使用乙醇浓度梯度法脱水,将脱水后的组织浸入二甲苯,待组织呈透明状时,停止二甲苯浸泡。随后,将组织进行包埋、切片和烘干。经二甲苯脱蜡后,用乙醇梯度法洗去二甲苯。之后进行苏木精-伊红染色,随后用乙醇脱水,二甲苯透明,最后用中性树脂封片并观察。
1.9 统计学方法
所有数据由SPSS 22.0软件完成。计量资料以均数±标准差(x±s)表示,多组间均数的比较采用单因素方差分析(One-way ANOVA),组间均数两两比较,方差齐时采用SNK法,方差不齐时采用Dunnett′s T3法。以P < 0.05为差异有统计学意义。
2 结果
2.1 TNF-α和IL-10炎症水平
与假手术组比较,模型组中TNF-α水平明显上升,IL-10水平明显下降,差异有高度统计学意义(P < 0.01):与模型组比较,乌司他丁组、TWCQ治疗组(包括TWCQ灌胃组、TWCQ灌肠组及TWCQ灌肠+乌司他丁组,下同)中的TNF-α水平均显著下调(P < 0.01),IL-10水平均显著上调(P < 0.05或P < 0.01);与TWCQ灌胃组比较,乌司他丁组、TWCQ灌肠组以及TWCQ灌肠+乌司他丁组血清中TNF-α水平均明显降低,差异有高度统计学意义(P < 0.01),但TWCQ灌肠组中IL-10水平要高于TWCQ灌胃组,差异有统计学意义(P < 0.05)。见图1。
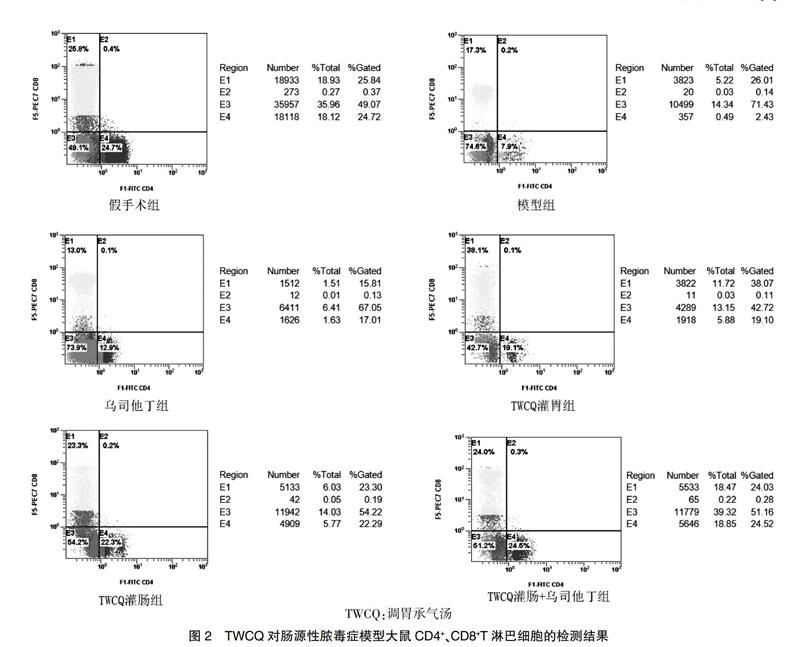
2.2 流式细胞技术检测结果
本实验采用标记有特异荧光的3种抗体CD3、CD4和CD8检测肠系膜淋巴结淋巴细胞的百分比。从流式细胞仪结果可以看出,与假手术组比较,模型组小肠系膜组织中的CD4+和CD8+T淋巴细胞数量均减少,CD4+/CD8+T淋巴细胞比例显著下降,差异均有高度统计学意义(P < 0.01)。与模型组比较,TWCQ治疗组的CD4+和CD8+T淋巴细胞数量均明显上升(P < 0.01),且CD4+/CD8+T淋巴细胞比例均显著回升,差异有高度统计学意义(P < 0.01);与TWCQ灌胃组比较,乌司他丁组、TWCQ灌肠组和TWCQ灌肠+乌司他丁组CD4+/CD8+T淋巴细胞比例均明显升高,差异有高度统计学意义(P < 0.01)。见表1、图2。
表1 各组CD4+、CD8+和CD4+/CD8+T淋巴细胞的比較(x±s,n = 8)
注:与假手术组比较,**P < 0.01;与模型组比较,##P < 0.01;与TWCQ灌胃组比较,▽▽P < 0.01。TWCQ:调胃承气汤
2.3 病理结果
在假手术组中,大鼠小肠黏膜结构基本正常,绒毛结构基本完整,且没有炎性组织浸润。在模型组中,可见绒毛坏死现象,黏膜间隙增大,固有层萎缩,炎性组织浸润严重。在乌司他丁组中,绒毛的损伤有一定程度的恢复,固有层基本完整,黏膜间隙较小,炎性组织浸润相对减少。在TWCQ治疗组中,TWCQ灌胃组绒毛结构破坏的部分有一定程度的恢复,固有层完整,黏膜间隙较小,炎性组织浸润相对减少;TWCQ灌肠组及TWCQ灌肠+乌司他丁组中绒毛结构均相对完整,黏膜间隙部分扩大,炎性组织浸润相对减少。从结果可知,TWCQ治疗组均能明显改善由肠源性脓毒症引起的小肠病理性变化,TWCQ灌肠组及TWCQ灌肠+乌司他丁组对小肠病理改善的程度更明显。见图3。
3 讨论
肠道是脓毒症所致损伤最早受累的器官之一,肠黏膜屏障的破坏及其通透性的改变将导致菌群移位到其他器官组织,随后导致脓毒症及多器官功能障碍综合征(MODS)[11-12],但随后细菌的生存状态将取决于机体免疫功能的强弱。因此,肠道作为机体最大的免疫器官之一,调节其免疫功能可以有效地防治肠源性脓毒症[13]。
传统中医理论认为,脓毒症属于伤寒、温病范畴,毒邪内蕴是其重要发病基础,临床上相对应的有清热解毒、通腑降下及活血化瘀等治则[14]。TWCQ出自《伤寒论》,主要由大黄、芒硝、炙甘草三味药组成[15],具有泻热和胃、润燥软坚的功效,对于脓毒症肠功能障碍时毒热内盛、瘀毒内阻证型有非常好的效果[16]。现代药理研究表明,TWCQ具有显著的抗炎及抗变态反应作用,能有效降低由内毒素引起的炎症水平,调节机体免疫功能,还能对肠黏膜引起没有损伤性的化学和机械刺激效应,从而促进肠蠕动[17-19]。
由于该疾病的特殊性,临床观察发现灌胃给药的疗效没有预期中理想,而灌肠给药的方式疗效显著[20-22],同时也能解决ICU危重症患者经常不能口服给药的不足。据文献研究,药物通过直肠途径给药,肠道黏膜可以直接将其吸收入血,并且可以避免肝脏首过清除效应,因而外周血药物浓度达到峰值的时间和峰值高度都较口服方式有较大的提高[23-24],提高了药物的吸收利用率。
本研究发现,在TWCQ干预后的肠系膜淋巴细胞中,CD4+/CD8+T淋巴细胞平衡得以改善,且血清中IL-10含量升高,TNF-α水平下降,提示TWCQ能调节Th1/Th2淋巴细胞比例的平衡,从而调控抗炎和促炎因子的释放,增加对移位细菌的灭杀,改善肠源性脓毒症:并且,本研究探讨了TWCQ两种不同给药途径,发现灌肠疗法较之灌胃疗法能更明显地降低免疫炎症。同时,基于TWCQ能有效地发挥抗炎作用,本研究下一步将探究在TWCQ灌肠干预后机体内肠道黏膜屏障的完整性,从而对细菌移位的必要条件进行充分的研究,以期完善TWCQ治疗肠源性脓毒症的作用机制,为其临床应用提供理论依据。
[参考文献]
[1] 王正国.当前脓毒症研究的思考[J].解放军医学杂志,2012,37(11):1011-1014.
[2] Rhodes A,Evans LE,Alhazzani W,et al. Surviving Sepsis Campaign [J]. Crit Care Med,2017,45(3):486-552.
[3] 唐昊.中国西部地区重症医学科脓毒症流行病学研究[D].重庆:第三军医大学,2016.
[4] Zhang J,Ankawi G,Sun J,et al. Gut-kidney crosstalk in septic acute kidney injury [J]. Crit Care,2018,22(1):117.
[5] Hammer AM,Morris NL,Earley ZM,et al. The First Line of Defense:The Effects of Alcohol on Post-Burn Intestinal Barrier,Immune Cells,and Microbiome [J]. Alcohol Res,2015,37(2):209-222.
[6] 陈路芳.乳酸杆菌制剂对脓毒症小鼠的保护作用及其肠道微生态与血清、粪便代謝组学研究[D].杭州:浙江大学,2017.
[7] 朱亚婕.脓毒症患者IL-32的差异及PB1对LPS介导的THP-1源性巨噬细胞炎症反应的抑制作用[D].大连:大连医科大学,2016.
[8] 余德金,吴丽.腹腔感染所致全身炎症反应综合征的中药治疗进展[J].世界中西医结合杂志,2010,5(7):635-637.
[9] 梁群,刘廷廷,谢礼翔,等.大承气汤化裁保留灌肠对脓毒症患者凝血功能的影响[J].中国急救医学,2018,38(7):596-599.
[10] 黄鑫,张敏州.盲肠结扎穿孔术——脓毒症模型研究的金标准[J].医学综述,2015,21(3):392-395.
[11] Pl?觟tz FB,Slutsky AS,van Vught AJ,et al. Ventilator-induced lung injury and multiple system organ failure:a critical review of facts and hypotheses [J]. Intens Care Med,2004,30(10):1865-1872.
[12] 王正国.当前脓毒症研究的思考[J].解放军医学杂志,2012,37(11):1011-1014.
[13] 付瑜,黄煜,姜树民.黄龙汤对脓毒症大鼠肠道黏膜免疫屏障保护作用[J].辽宁中医药大学学报,2017,19(7):39-42.
[14] 许国振,许源.从瘀热证论治脓毒血症的理论及临床研究[J].中国中医急症,2016,25(11):2069-2071.
[15] 熊曼琪.论伤寒论学科发展方向与研究方法[J].中医教育,1996(5):20-21.
[16] 王润春,潘琳琳,刘欢,等.张志远运用四承气汤经验[J].世界中西医结合杂志,2016,11(7):917-919.
[17] 张玲.芒硝临床运用经验[J].新疆中医药,2010,28(1):37.
[18] 张保国,刘庆芳.调胃承气汤实验研究与临床新用[J].中成药,2012,34(12):2408-2411.
[19] 刘绍永.大承气汤临床方药用量历史轨迹研究[D].北京:北京中医药大学,2016.
[20] 李良,蒋永泼,杨英姿,等.脂氧素和乌司他丁对脓毒症内皮细胞Ang表达的影响对比观察及作用机制研究[J].中国现代医生,2017,55(27):19-22.
[21] 李锦灵,黄树武,李舸,等.大鼠脓毒症模型的凝血功能研究[J].中国实验动物学报,2018,26(2):224-229.
[22] 赖善中,王燕,陈丹,等.浅析中药肠道给药在急症方面的应用[J].光明中医,2009,24(2):343-344.
[23] 郭海雷,卢才教,刘政,军等.脓毒症大鼠早期血管内皮和心肌损害及其相关性研究[J].中国现代医生,2018, 56(10):37-41.
[24] 邓京振,徐吉民,何国华,等.中药汤剂动物直肠给药实验研究[J].中药通报,1986(5):30-32.
