干旱沙漠区2种深根植物根际微生物数量分布及根际效应研究
2019-09-06高欢欢曾凡江赵秀芳朱心宁张倩丁泽华
高欢欢 曾凡江 赵秀芳 朱心宁 张倩 丁泽华

摘要 本研究以古尔班通古特沙漠东南缘2种深根植物疏叶骆驼刺、多枝柽柳不同土层深度根际土壤、根外土壤为研究对象,运用平板划线法研究根际土壤、跟外土壤微生物数量,并对其根际效应进行探讨。研究结果显示,细菌占根际可培养微生物数量中的绝大多数。每种植物根际细菌数量、微生物总数在不同土层有相同的波动变化规律。根际真菌、放线菌在不同植物不同土层也呈现差异性分布。根际细菌数量、微生物总数排序为疏叶骆驼刺>多枝柽柳根际真菌放线菌数量排序为疏叶骆駝刺>多枝柽柳。除多枝柽柳根际细菌放线菌、微生物总数在0~50cm和200~250cm土层呈现负效应,其余样本根际效应均为正效应。
关键词 根际微生物;平板划线法;根际效应;干旱沙漠区
中图分类号 S154.3
文献标识码 A
文章编号 1007-5739(2019)08-0172-04
细菌、真菌、放线菌是可培养微生物的主要分类方式,土壤中可培养微生物是微生物群落结构的重要组成部分,由于三大微生物计数手段的简便易行使其成为评价微生物多样性及土壤状况的重要指标"。土壤中三大微生物数量的变化既能反映出微生物对养分、水分、光照、植物分泌物等外界生境因子的变化,又能体现微生物群落自身的应激策略。根际作为特殊的微生物生境,是土壤微生物链接植物与环境参与能量物质转换的重要场所。游走于根际的微生物从植物根系分泌物及枯落物中获取有效碳源和氮源,同时为植物生长提供必要的小分子元素与微环境吧。在根际中,植物一微生物形成相互依托的互助体。由于根际与根外环境存在显著差异性,导致根际、根外土壤微生物数量、理化性质等均存在差异,即根际效应。通常情况下,将根际、根外微生物数量的比值作为衡量根际效应的重要指标,其比值大于1说明根际呈现正效应,比值小于1说明根际呈现负效应用。
在荒漠这种干旱生态系统中,降雨稀少、沙漠化严重、土壤养分贫瘠是其主要特点可。虽然生活条件非常苛刻,但是在世界各地的沙漠中,微生物数量和种类都很多,达到1.6x107个/g。早期研究发现,放线菌占据了沙漠土壤细菌总数的近50%7,研究发现沙漠野生植物的根际细菌种类比根外土壤多1.5~3.0倍。随着分子生物学的发展,更多种类的微生物群落已经在荒漠生态系统被发现。在以往的研究中将每个土层中所有根系的根际微生物作为一个整体去研究,而根据前人大量研究发现,不同根系的根功能不同,分为吸收根和运输根8。GUI等通过人工挖掘法研究了自然条件下不同潜水埋深疏叶骆驼刺克隆分株生长情况和根系结构。挖掘中发现大部分深根系植株拥有发达的地下根系,疏叶骆驼剌主根直达地下水,但细根的含量相对较少。根系吸收养分、水分的具体位置还不确定。因此,不能单纯以某段较浅土层根际微生物群落特征代表该植物根际微生物群落的全部特征,垂直梯度上根际微生物的研究十分关键。
在本研究中,以古尔班通古特沙漠中2种深根植物根际土壤根外土壤微生物为研究对象,对不同植物不同土壤深度下根际细菌、真菌放线菌、微生物总数数量分布特征及相应根际效应进行研究,探讨根际可培养微生物群落多样性。
1材料与方法
1.1样品采集
本研究于2014年7月在古尔班通古特沙漠东南缘天然试验场进行。选取自然生长的2种深根植物疏叶骆驼刺(AlhagisparsifoliaShap.)、多枝柽柳(TamarixramosissimaLedeb.),分别选取立地条件相似、地下潜水埋深基本相同的3个20mx20m的单纯植被样方,共计9个样方进行调查取样。
取样前所有工具、容器都要经过严格的消毒,防止微生物交叉污染。正式取样前,先将土壤表层、根系周围枯落物清除,然后,将土壤表层1cm左右的腐殖质层剔除。
每个样方分别随机选取6~10株植物,对所调研的物种根系进行垂直剖面的挖掘。先用挖掘机挖掘周边大型土方,制造出取样剖面,再进行人工挖掘清理根系周围土壤,进行根际土壤样品的采集。采集深度3.5m,每隔50cm作为一个取样深度。采用自然环境中采集的根际、根外土壤样品作为试验材料。根际及根外土壤细菌、真菌、放线菌、微生物总数计数选取的土壤样品均在49C条件下保存。
1.2微生物计数
微生物培养:采用划线平板法将接种后的培养皿倒置,细菌培养2~3d,真菌培养3~5d,放线菌培养5~7d,然后取出,选择菌落数适合的培养皿(细菌和放线菌为20~200个,真菌为10~100个),剔除占琼脂表面超过15%的菌落。按照下式计算菌数:
菌数(CFU/g)=.菌落平均数x稀释倍数x20x鲜土重千土重
2结果与分析
2.1多年生植物根际三大微生物数量垂直分布特征
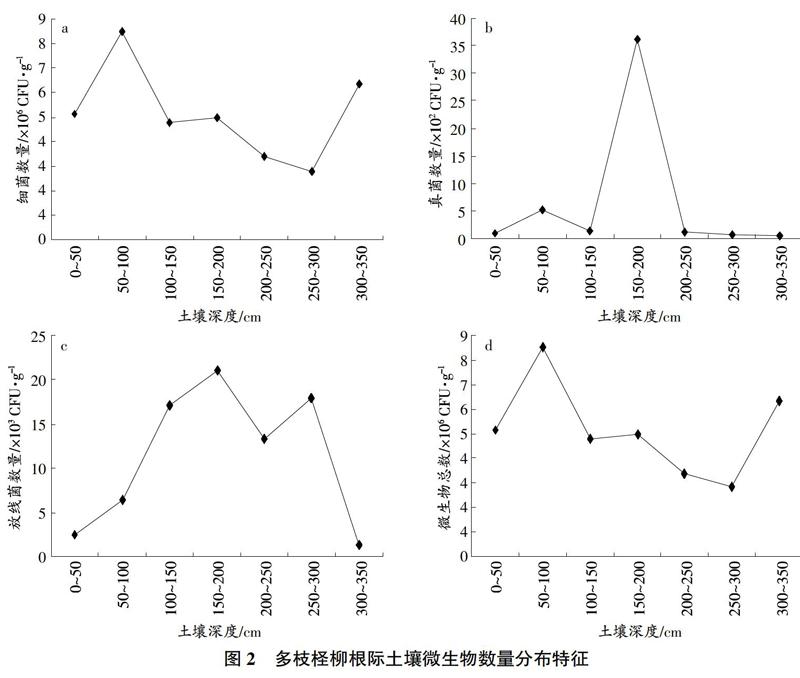
骆驼刺根际土壤细菌、真菌、微生物总数在不同土壤深度呈现双峰波动分布模式,放线菌数量在不同土壤深度呈现单峰分布模式(图1)。细菌数量和微生物总数呈现一致的波动规律,即随士壤深度的增加,细菌数量和微生物总数上升下降交替波动,在100~150cm、200~250cm土层出现峰值,真菌数量也在这2个土层出现峰值。放线菌在150~200cm土层中分布最多。
与疏叶骆驼刺相同的是,多枝柽柳根际细菌数量和微生物总数也具有相同的分布模式,但与疏叶骆驼刺分布模式不同(图2)。多枝柽柳根际细菌数量和微生物总数在50~150cm土层出现数量最大值,随后随土层增大而逐渐减少,在300~350cm土层又增大。真菌数量呈现单峰分布模式,在150~200cm土层最多。放线菌数量分布呈双峰分布,在150~200cm和250~300cm出现2个峰值。
2.2多年生植物根际效应垂直分布特征
根据ANOVA分析,不同植物种根际土壤中各可培养微生物根际效应都不存在显著差异,因而不进行不同植物种间对比分析,仅分析每个植物种根际土壤微生物数量分布特征。
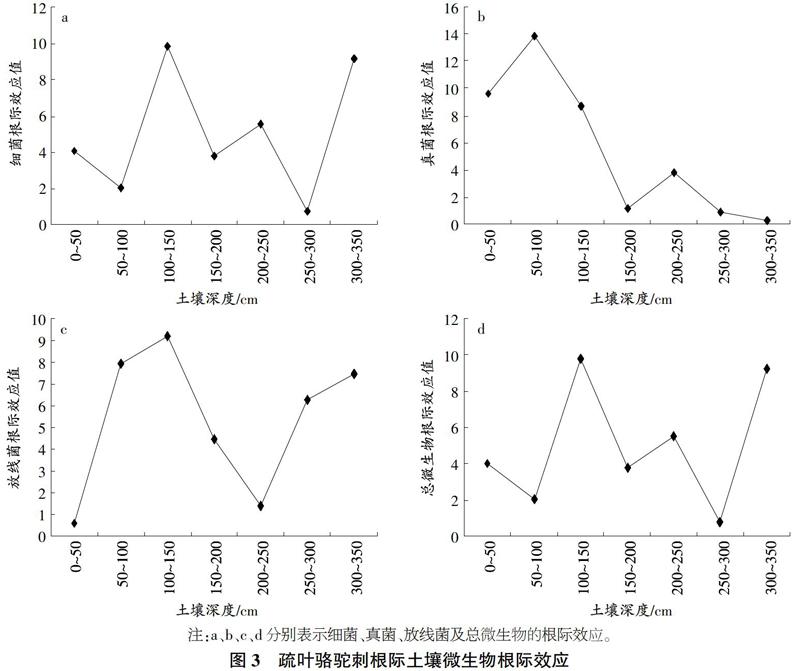
如图3所示,疏叶骆驼刺200~250cm细菌、真菌,250~300cm土层真菌、微生物总数,0~50cm土层放线菌等根际效应呈现负效应,其余各可培养微生物根际效应均呈现正效应。细菌、真菌、放线菌微生物总数根际效应均值分别为5.01、6.32、4.96、5.02。细菌、微生物总数根际效应波动规律相似,在100~150em土层根际效应最大,250~300cem土层根.际效应最小。真菌根际效应呈现波动下降趋势,在50~100cm土层最大,为13.86;当土壤深度达到300~350cm时,根际效应下降到0.25。放线菌根际效应随土壤深度的增加呈现先增大后减小再增加的趋势,在100~150cm土层最大;当土壤深度达到200~250cm时达到最低点,而后又逐渐上升。
多枝柽柳根际土壤细菌、微生物总数根际效应波动变化规律一致(图4),在0~50cm和200~250cm2个土层呈现负效应,其余土层呈现正效应;在50~100cm根际效应最大,分别为6.13.6.12。真菌根际效应均呈现正效应,波动规律呈现先增大后减小的单峰分布,在150~200cm土层真菌根际效应最大,为116.40。放线菌根际效应随土层的增加呈现逐渐递增趋势,在0~50cm土层呈现负效应;随土壤深度的增加呈现正效应,当土壤深度到达250~300cm时,放线菌根际效应到达最高值10.17,随后又降低。
2.3根际微生物数量及根际效应相关性分析
将不同植物不同土壤深度根际士壤各微生物数量及根际效应进行两两相关性分析,由表1可知,根际细菌数量与根际微生物总数呈现极显著正相关性(P<0.01),相关系数接近1.00。根际放线菌数量与根际真菌根际效应呈现极显著正相关性(P<0.01),相关系数0.81。其余参数之间不存在显著相关性(P>0.05)。
3结论与讨论
根际微生物作为根际生态系统的重要组成部分,其数量及分布对根际生态系统中土壤的健康及植被的恢复具有重要意义0,根际微生物数量受植被类型、土壤性质等影响存在空间异质性分布"。在我国干旱生态系统微生物研究中发现,千旱半干旱区域土壤存在大量可培养微生物,其数量与分布随土壤状况变化存在动态变化。与以往研究相似,本研究区域根际可培养微生物总数量化级别10,不同植物种间根际细菌数量、根际微生物总数差异显著。头状沙拐枣根际细菌、微生物总数最多,疏叶骆驼刺次之,多枝柽柳最少。
在2种植物根际土壤可培养微生物中,细菌都是为优势菌群,量化度为106;放线菌次之,量化度为10;真菌最少,量化度为102。从数量上,疏叶骆驼刺、多枝檉柳的根际细菌分别占微生物总数的99.32%和99.81%。这一结果导致了根际细菌数量与根际微生物总数呈现极显著的正相关关系。在根际微生物数量随土壤深度增加的分布中,每种植物根际细菌、微生物总数的分布规律都一致,这也印证了细菌在根际微生物数量中的主体地位。在腾格里沙漠、塔克拉玛干沙漠的研究中也发现,在千旱半千旱区域的荒漠土壤中,土壤中细菌数量占可培养微生物总数的主体地位,本研究与前人研究一致。
在本研究中,根际真菌与根际细菌呈现不同的空间分布异质性,在古尔班通古特沙漠不同土壤深度中2种植物根际真菌数量及根际效应均呈现单峰分布。但利用划线平板法测定可培养真菌数量并未发现与已经研究的根际生境因子呈现显著的相关关系,对根际可培养真菌空间异质性还需要进一步探讨。
放线菌在研究区域古尔班通古特沙漠根际土壤微生物数量中所占比重最少,但是以往的研究表明,根际放线菌从植物及土壤中吸收必要的养分与能量,通过生命活动释放嘌呤类似物调控土壤健康和根系生存环境"5,与土壤、植物存在明显的互惠互利生存关系,在千旱、贫瘠的沙漠土壤占据重要地位。根际放线菌空间异质性分布主要受土壤可溶性离子影响,可以有效阻隔有害真菌对植物的侵染,分解土壤有机质改善土壤养分状况",从而促进植物生长与植被修复。本试验中根际放线菌与根际土壤电导率呈现极显著的正相关关系,而电导率主要受土壤中可溶性离子影响,说明在本区域电导率范围内,离子含量越大,根际放线菌数量越多。
根际效应是衡量根际微生物生命活性的重要指标。微生物根际效应:主要受根际微环境因子(如土壤类型、养分状况、pH值、湿度等)以及植物因子(如物种年龄等)的影响18。根际效应的空间分布异质性反映根际微生物活性的空间分布异质性。本研究中,由于细菌数量占微生物总数的大部分,故2种植物细菌根际效应与微生物总数根际效应都呈现一致的分布规律。试验结果可以看出,2种植物真菌根际效应均呈现正效应,真菌根际效应与根际真菌数量呈现极显著相关性(P<0.01),而其他微生物根际效应与根际相对应的微生物数:量无显著相关性(P>0.05)。这说明极端干旱区土壤中真菌数量虽然不占主体地位,可能由于根际对土壤真菌吸引能力较强,真菌主要活动在根际范围内造成真菌较高的根际效应。
4参考文献
[1]吴楠,张元明,潘惠霞,等.古尔班通古特沙漠地衣结皮中可培养细菌多样性初探[J].中国沙漠,2013,33(3):710-716.
[2]卫云燕,尹华军,刘庆,等夜间增温和施肥对川西亚高山针叶林两种树苗根际效应的影响[J].生态学报,2011,31(3):698-708.
[3] PHILLIPS R P,FAHEY T J.the influence of soil fertility on rhizosphereeffects in northern hardwood forest soils[J].Soilence Society of AmericaJournal , 2013,72(2):453- -461.
[4]王卫霞.新疆几种典型荒漠植物根际微生物特征及内生固氮菌的分离促生性能研究[D].乌鲁木齐:新疆农业大学,2009.
[5] NOYMEIR I.desert ecosystems : environment and producers [J].AnnualReview of Ecology & Systematics,1973,4(1):25- -51.
[6] SKUJINS J.microbial ecology of desert soils[J]. Advances in MicrobialEcology , 1984,7:49-91.
[7] BHATNAGAR A, BHATNAGAR M.Microbial diversity in desert ecosys-tems[J].Current Science , 2005, 89( 1):91-100.
[8]刘波.多年生植物细根主要功能特征及其变异格局[D].乌鲁木齐:中国科学院新疆生态与地理研究所,2013.
[9] GUI D.Characteristics of the clonal propagation of Alhagi sparsifolia Shap.(Fabaceae )under different groundwater depths in Xinjiang, China小Rangeland Journal , 2013 ,35(3):355-362.
[10]何尋阳,苏以荣,梁月明,等喀斯特峰丛洼地不同退耕模式土壤微生物多样性[J].应用生态学报,2010,21(2):317-324.
[11] BRUNDRETT M C.Tansley review no.134:Coevolution of roots andmycorrhizas of land plants [J].New Phytologist , 2002, 154(2):275-304.
[12]李从娟,雷加强,徐新文,等.古尔班通古特沙漠土壤水分与化学性质的空间分布[J].生态学报,2014,34(15):4380-4389.
[13]張憲武,許光輝.騰格里沙漠地区沙地士壤微生物学特性的研究[J].土壤学报,1962(3):227-234.
[14]靳正忠,雷家强,李生宇,等.流动沙漠腹地灌木根际土壤微生物比较分析[J].应用与环境生物学报,2010,16(6):759-764.
[15] GUNATILAKA A A L.Natural products from plant- -associated microor-ganisms : Distribution , structural diversity , bioactivity , and implicationsof their occurrence[J].Journal of Natural Products , 2006 , 69(3) :509.
[16] MCLELLAN C A,TURBYVILLE TJ, WIJERATNE E M , et al.A rhizos-phere fungus enhances Arabidopsis thermotolerance through productionof an HSP90 inhibitor[J].Plant Physiology , 2007, 145(1):174-82.
[17]庹利,旭格拉.哈布丁,郭琳,等.罗布泊地区沙生植物根际放线菌多
样性及生物活性的研究[J].中国抗生素杂志,2012,37(1):21-26.
[18] WARDLE D A.A comparative assessment of factors which influencemicrobial biomass carbon and nitrogen levels in soil [J]. BiologicalReviews, 1992 , 67(3):321-358.
