磷钼酸的特性、制备及萃取分离研究进展
2019-08-29张汉宇
张 亨,张汉宇
(1.锦西化工研究院有限公司,辽宁 葫芦岛 125000) (2.北京卫星制造厂有限公司,北京 100094)
0 引 言
磷钼酸[1]主要用作氧化还原反应及酯化反应等的催化剂。如直接氧化甲烷为甲醛,氧化丙烯为丙烯醛和丙酮,丙烯氨氧化制备丙烯腈,催化醇酸进行酯化反应等。磷钼酸用于丝和皮革的加重剂,制备有机颜料的原料。用作化学分析试剂,可分析检验生物碱、尿素、黄嘌呤、肌酐、铵根、胺和某些稀土金属。用于微量分析,测定锑、铈、铜、铊和钒等。磷钼酸与苏木色精可用于神经染色,也用于缓蚀剂和高速公路路标的颜料。
1 理化性质
磷钼酸别名十二钼磷酸,简称12-MPA,为嫩黄色或桔黄色菱形结晶或结晶粉末。磷钼酸其实为一大类杂多酸(见表1),1962年前CAS名称Phosphomolybdic acid,1962年后CAS名称Molybdophosphoric acid,CAS登录号11104-88-4。水合磷钼酸H3PO4·12MoO3·xH2O(x=3~30)的CAS登录号51429-74-4。溶于水、乙醇、乙醚等。熔点78~80 ℃。无水磷钼酸H3PO4·12MoO3的CAS登录号12026-57-2,分子量1 825.254,相对密度3.15,熔点70~80 ℃。H3PO4·12MoO3·30H2O分子量2 365.71,相对密度2.53,熔点78 ℃。除特别标明外,磷钼酸一般指化合物 H3PO4·12M0O3·xH2O或H3PO4·12M0O3。
磷钼酸属于一种络合物H3[P(Mo3O10)4],可由磷酸盐和钼酸盐在酸性溶液中反应生成。再加入适当的还原剂加热,磷钼酸易被还原成磷钼蓝[2],根据磷钼蓝颜色的深浅,用分光光度法和目视比色法测定含量。磷钼酸有腐蚀性,具有酸的通性,与一氧化碳及氯化钯混合后变蓝,可以此来检验一氧化碳。
Gerhart Jander等[3]通过扩散试验研究了磷钼酸与0.1M Na2MoO4·2H2O、0.1M Na2HPO4·12H2O和1M NaClO4混合溶液的形成、行为和结构。实验数据显示了不同氢离子浓度下的钼离子状态。给出了磷钼酸的光吸收特性曲线。
H3PMo12O40·nH2O与Fiske试剂和Subbarow试剂发生还原反应生成磷钼蓝Ⅱ和Ⅳ[4]。分子式为H5PMo12O40·nH2O和H7PMo12O40·nH2O。易溶于极性溶剂,不溶于非极性溶剂。在浓硫酸和硝酸溶液中,PO43-和MoO42-按化学计量形成磷钼酸。S.R.Crouch等[5]以钼蓝法在PO43-检测中利用分光光度法进行研究,阐明作用机理。磷酸钠、钼酸铵和钼(Ⅴ)均以n×10-3M 浓度反应过程中[6],改变Mo(Ⅵ)∶Mo(Ⅴ)配比生成蓝色磷钼酸。

表1 磷钼酸的常见品种
单体钼酸盐阴离子在pH值5~7时形成六钼酸。随着介质酸度增加,形成十二钼酸,其浓度在pH值1.5时达到最大值。在磷酸存在和pH值为4时,生成大量磷钼酸[7]。A.V.Rakovskii等[8]测定了磷钼酸及其三钠盐在水中0~98 ℃的溶解度。20 ℃时钼酸在1~39 N磷酸中的溶解度曲线[9]表明,在12 N磷酸时溶解度最大(155.1 g Mo/L),在24 N磷酸时最小(100 g Mo/L)。得到平衡固体相的组成。在较高的磷酸浓度下,从体系中形成磷钼酸。确定磷钼酸是由磷酸聚合物的氧原子被单体钼阴离子取代后形成的。
2 光谱数据及晶体结构
磷钼酸固体及溶液中的磷钼酸阴离子等[10],在1 060、960、880、780 cm-1处出现特征吸收峰,分别归属于P-O、Mo-O、Mo-O-Mo键的伸缩振动频率。650~850 cm-1和300~400 cm-1是Keggin结构的特征。
磷钼酸所带的水分为结晶水和结构水两部分。磷钼酸的热分解过程首先是脱水,在DTA曲线上出现2个热分解放热峰,这是发生晶格改变所致。H3PMo12O40·30H2O[11]为立方晶系,空间群Fd3m,a=2.325 5 nm,Z=8。磷钼酸阴离子具有四面体结构,周围络合6个水分子。H3PMo12O40·(H2O)13-14[12]具有三斜结构,杂多阴离子具有准对称性。a=1.410(1) nm,b=1.413(1) nm,c=1.355(1) nm,α=112.1(3)°,β=109.8(3)°,γ= 60.7(3)°,Z=2,D和d(X-ray)= 3.22(14H2O)。
Strandberg Rolf[13]得到H3PMo12O40·(H2O)29-31的X射线衍射数据,具有Keggin结构型式。共边八面体MoO6中,Mo-Mo间距0.342 nm,共角八面体Mo-Mo间距增至0.370 nm。四方晶系的晶胞尺寸为a=1.647 3 nm,c=2.333 6 nm,Z=4。
3 制备方法
磷钼酸的制备方法通常为三氧化钼-磷酸法和钼酸盐-磷酸(盐)酸化法等。
3.1 三氧化钼-磷酸法
以三氧化钼和磷酸为原料制备磷钼酸,反应式如下:
12MoO3+ H3PO4+ xH2O = H3PO4·12MoO3·xH2O
将三氧化钼加入反应器中,并按三氧化钼∶水 = 1∶10的比例(质量比)加水搅拌均匀,再加入85%磷酸(三氧化钼与磷酸物质的量比12∶1),煮沸3 h。反应前溶液为乳白色,前期为金黄色,后期为绿色,反应进行中保持反应液平稳沸腾,并加水保持液面高度,反应后期pH值控制在1.0左右,再经真空抽滤除去滤渣(可回收利用),滤液滴加30%过氧化氢溶液,使溶液由绿色转变成黄色,然后蒸发浓缩至溶液温度105 ℃时,将溶液缓慢冷却结晶,离心分离制得磷钼酸晶体。分离母液可循环使用。
E.A.Nikitina[14]研究了德布雷(Debray)法和德雷克塞尔(Drechsel)法。在水溶液中将磷酸和三氧化钼直接反应合成磷钼酸,产率80%~85%。A.Linz[15]将144 g 三氧化钼和61 g 85%的磷酸煮沸3 h。静置2 min过滤,蒸发至约100 mL。冷却过夜,过滤得到112 g晶体。T.J.Hastings Jr.等[16]发现无论磷酸和三氧化钼配比如何,反应均生成磷钼酸。
E.A.Nikitina等[17]将160 g 三氧化钼、8.8 mL 75%的磷酸和0.5 L水组成的溶液煮沸3 h,过滤,在水浴上蒸发直到形成结晶膜,冷却至室温。重结晶得到纯净的磷钼酸。三氧化钼加入量为75%,二次稀释不能增加产率。三氧化钼过量 400%,产率提高到90%。三次重结晶后,从母液中可回收10%~12%的磷钼酸。结晶操作温度80~103 ℃。
Raluca Ripan等[18]得到合成H5PMo12O40溶液的适宜条件及溶液酸碱度函数的平衡态演化。在E1/2=-0.27、-0.49和-0.92 V下,产物极谱图显示3个极谱步骤,并进行分析。
Javier A.C.等[19]采用快速停流分光光度反应速率技术研究了磷钼酸生成的动力学。提出磷酸根离子与钼(Ⅵ)发生初始反应,再进行聚合生成磷钼酸的机理。推导出速率定律,与实验测试的速率和速率常数一致。
首都师范大学王淑萍等[20]研究制备磷钼酸的乙醚萃取法、王水法和三氧化钼磷酸法。设计了制备磷钼酸的一种新方法——乙醇溶解法。重复了制备磷钼酸的乙醚萃取法和王水法,调查了三氧化钼磷酸法。在总结这些方法的基础上,提出制备磷钼酸的乙醇溶解法。
四川理工学院郭明秀等[21]进行正交试验,研究反应物料配比、三氧化钼浓度、反应温度和反应时间对磷钼杂多酸产率的影响。适宜反应条件为∶物质的量比n(三氧化钼)∶n(磷酸)=12∶1.0、反应温度70 ℃、反应时间7 h、三氧化钼与水的质量比1∶8。经红外光谱及熔点测定确定所得产品为磷钼杂多酸。
3.2 钼酸盐-磷酸(盐)酸化法
钼酸盐-磷酸(盐)酸化法通常选用钼酸钠和磷酸(盐)进行酸化反应制得磷钼酸。
12Na2MoO4+ Na3PO4+ 3HCl + 12H2O = H3[P(Mo3O10)4] + 3NaCl + 24NaOH
取一定配比的钼酸钠与磷酸钠的混合物,加水溶解(微热),加浓盐酸酸化至pH>1,溶液逐渐变黄。将溶液蒸干,得淡黄色固体(磷钼酸与氯化钠的混合物)。用有机溶剂将混合物中的磷钼酸溶解而与氯化钠分离。蒸发掉有机溶剂,得蓝绿色固体,加水溶解,用极少量的硝酸或过氧化氢调至蓝色刚刚褪去呈黄色为止。浓缩,得黄色磷钼酸结晶。
磷钼酸的生成取决于反应物浓度、温度和酸度。室温下生成24-钼磷酸,生成18-钼磷酸需要煮沸。磷酸和钼酸钠以任何比例混合,不会形成磷钼酸。加入和钼酸钠等物质的量氯化氢,形成18-钼磷酸和24-钼磷酸的混合物。Hsein Wu[22]将100 g 二水钼酸钠溶于200 g水中,加入20 mL 85% 磷酸、100 mL浓盐酸和150 mL乙醚,在分液漏斗中摇匀,冷却5~10 min后,将3层中的最低层转移到另一个漏斗。加入100 g水,摇匀,加入50 mL浓盐酸和更多的乙醚,再摇匀。冷却并再次除去最底层,重复清洗。转移到烧杯中,加入25 g水和几滴浓硝酸,在水浴上蒸发直到表面形成晶体。慢慢冷却,得到黄色八面体晶体P2O5·24MO3·3H2O。另将100 g 二水钼酸钠溶于450 g水中,加入15 mL 85%磷酸和80 mL浓盐酸,煮沸8 h。回流冷却,加入100 g粉末氯化铵搅拌。在布赫纳过滤器上尽量干燥地过滤。溶于等量水中,过滤掉24-钼磷酸中的铵盐。溶于少量水中,然后蒸发。在≤40 ℃的真空中,直到晶体开始形成。缓慢冷却至5~6 ℃,过滤尽可能干燥。断开吸力,用干燥乙醚覆盖住晶体,搅拌,静置,然后吸干。快速干燥,得到橙色棱柱晶体P2O5·18MoO3·11H2O。
Chiola Vincent等[23]在2.2 L水和320 g氢氧化钠的溶液中,溶解576 g三氧化钼制备钼酸钠溶液。在200 mL水和80 g氢氧化钠的溶液中,溶解一定量的磷酸制备磷酸钠溶液。将两种溶液混合,过滤,滤液以H+形式通过阳离子交换树脂床层,去除钠离子。流出物经蒸发,得到H3(PMo12O40)·xH2O结晶,产率>98%,钠含量<0.01%。
国内学者[24-25]在制备磷钼酸催化剂时,通常向0.12 mol钼酸盐溶液中加入乙酸调节pH值为6.4时,滴加0.01 mol的磷酸钠溶液,加热至沸,搅拌20 min后逐滴加入浓盐酸,冷却后,用乙醚萃取得到H3PMo12O40·xH2O。
3.3 其他制备方法
用王水处理磷钼酸铵,赶掉挥发酸后,水溶残余物,加硝酸酸化,进行重结晶,可得磷钼酸。此法收率很低,产品中含有大量不溶物,操作过程复杂且时间长,反应激烈,不宜于生产。
L.S.Malowan[26]将约5 g磷钼酸铵放入瓷坩埚中,使坩埚底部加热至深红色。当盐完全变为蓝黑团后,冷却,加入约20 mL 3%的过氧化氢,煮沸,直到变为天青石色化合物。溶解完全,溶液呈金黄色,得到磷钼酸溶液。然后加入几滴浓HNO3,蒸发清除溶液中多余的过氧化氢。
Chiola Vincent等[27]在400 mL去离子水中,加入1g 85%的磷酸,再加入47.59 g六氯化钼粉末,在25 ℃搅拌反应6~7 h,过滤,在蒸汽浴上蒸发滤液,形成晶体。将晶体风干,得到H3(PMo12O40)·xH2O 产品,钠含量<0.01%。
4 原料消耗定额和产品规格
磷钼酸消耗定额见表2。

表2 磷钼酸生产消耗定额 kg/kg
磷钼酸产品规格见表3。
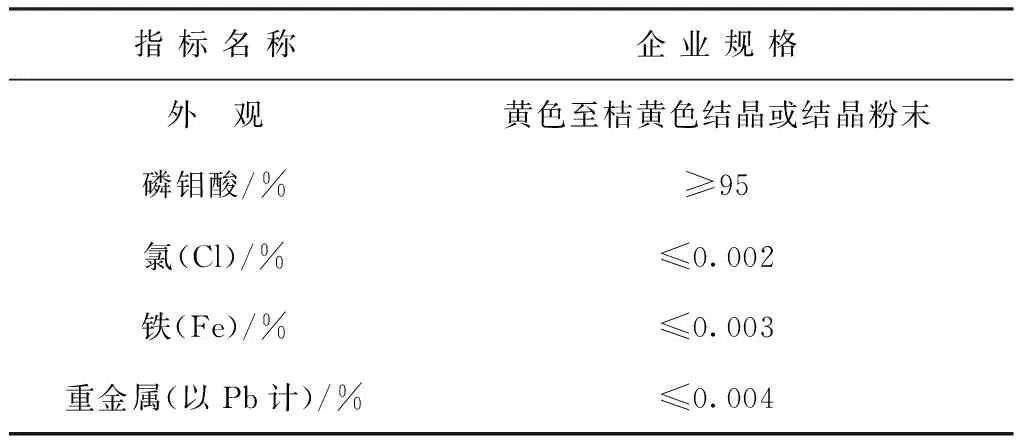
表3 磷钼酸产品规格
5 精制研究
制备磷钼酸的溶液体系中含有多种杂质,其中的挥发性物质可用蒸发浓缩法除去;可溶性物质则用萃取、结晶和重结晶法提纯。
5.1 萃取研究
利用各种物质在彼此互不相溶或仅部分互溶的两种溶剂中的溶解度或络合能力不同,将混合物的组分部分或完全分离的过程称为萃取。在磷钼酸的制备分离中,萃取几乎都是在水溶液和有机溶剂之间进行的。常用萃取剂有乙醇、乙醚、正丁醇、异丁醇、二正辛胺、三正辛胺、乙酸丁酯、乙酸丙酯、磷酸三丁酯、三苯基膦等。常用稀释剂有苯、硝基苯、煤油等。
在H2O+BuOH溶液中,H3PO4·12MoO3·xH2O 的生成是pH值的函数[28]。浓度分布系数呈阶梯状,表示产物取决于浓度存在两种类型。在pH值0.9时,分布系数维持常数0.53。在纯丁醇中,磷钼酸通过萃取得到分离。
还原磷钼酸的萃取取决于溶剂的性质和溶液相的酸度,V.I.Klitina等[29]进行分光光度研究。还原形式的萃取过程与非还原形式的萃取过程相似。用不同还原剂萃取还原的磷钼酸的吸光度差异较大,表明每次萃取不同的化合物。通过增加介质的酸度来提高磷钼酸的萃取浓度。适宜的萃取剂是丁醇或异丁醇。列出了萃取百分比、萃取摩尔吸收系数。
V.I.Klitina等[30]用二正辛胺和三正辛胺对还原磷钼酸进行萃取,以光谱分析进行表征,研究了还原剂性质、胺稀释剂和水溶液酸度的关系。
R.B.Heslop等[31]在pH <1的溶液中,用乙酸丁酯对磷钼酸进行萃取,可将磷钼酸H3(PMo12O40)和砷钼酸H3(AsMo12O40) 分离。
Murata Katsuo等[32]阐明磷钼酸的液-液萃取机理。通过电位测量、电导测量和分布测量方法,对溶液中可萃取物质和有机相中萃取物质的形成进行研究,适宜pH值在1~2之间。磷钼酸在有机溶剂中的分布,与溶剂和水溶液的形成有关,还取决于极性溶剂的性质。萃取物的最大吸收在310 nm。磷钼酸以丁醇为萃取助溶剂,同6 mol丁醇以H3PMo12O40·6BuOH·xH2O形式存在。
Lakshmanan V.I.等[33]研究三苯基膦在苯或硝基苯溶剂中萃取H3PMo12O40。表明每3 mol三苯基膦与1 mol磷钼酸结合萃取进入有机相中。得到每个体系的萃取平衡常数。
Rais J.[34]推导出水和极性有机物相之间多碱基酸分布的关系式。磷钼酸以单价阴离子和一种单碱性酸的形式进入硝基苯中。磷钼酸含量的萃取常数log K=-2.94。
Sastri M.N.等[35]在酸度范围(高氯酸)1.0~2.0 N的单一萃取液中,以氯仿为稀释剂,可定量萃取磷钼酸转入二丁亚砜(Bu2SO)中。
乙酸丙酯萃取磷钼酸过程中,Ivashkovich E.M.[36]发现在320 nm处有一个最大吸收峰,在乙酸丙酯或磷钼酸溶液中并不存在。在pH值0.6~1.4之间,萃取系数急剧上升,然后保持恒定。萃取物IR显示磷钼酸的OH带和乙酸丙酯的的CO带的位移,表明在未溶解的酸和酯分子间形成一个H键。甲苯、乙酸丙酯或丁醇溶液萃取系数的变化,表明在萃取物中含有8 mol氧化物。
Nikiforov A.F.等[37]在加入烷基三甲基氯化铵(II)的溶液中,通过泡沫浮选得到疏水性沉淀。磷钼酸(I)从溶液中的萃取产率93%~95%。适宜的萃取条件为:pH值2.0~4.5,Ⅱ∶Ⅰ(物质的量比)为3~7,空气吹扫时间5~7 min,FeCl3和AlCl3加入量分别为≤10-4M和<5×10-4M,提高了磷钼酸的萃取效率。
Shapiro K.Ya等[38]以磷酸三丁酯的煤油溶液从H3PMo12O40·(2-5)H2O和1~4 N盐酸溶液中萃取钼,用化学分析和IR分析方法进行研究。萃取物为 H3PMo12O40·12Bu3PO4。IR显示萃取的溶剂化机理。
5.2 蒸发浓缩研究
蒸发是加热溶液使一部分溶剂(通常是水)气化而使溶液浓缩的过程。蒸发过程中需要不断供给热能。溶液经过蒸发达到过饱和而结晶,或使溶液经过冷却达到过饱和而结晶。
Chiola Vincent等[39]发明了一种从水溶液中分离钨钼杂多酸的方法。先鼓泡通入氮气,对溶液间接加热进行预浓缩。最终浓缩,通过冷冻干燥方式升华去除溶剂。分离得到的化合物稳定,水溶性好。
6 结 语
磷钼酸是非常重要的一大类杂多酸,涉及品种繁多。磷钼酸的特性、制备、精制分离、催化机理、应用研究等仍需进一步深化拓展。
