棉花不同发育时期根际微生物的动态变化
2019-08-29刘珊珊盛福瑞乔清华
刘珊珊,韦 鑫,盛福瑞,乔清华,2,*
(1.玉林师范学院 生物与制药学院,广西 玉林 537000; 2.山东棉花研究中心,农业农村部黄淮海棉花遗传改良与栽培生理重点实验室,山东 济南 250100)
植物根际是植物根系-土壤-微生物相互作用形成的特殊土壤微区域,是土壤微生物与植物根系作用最激烈的区域,也是植物-土壤-微生物进行物质交换和能量、信号传递最重要的界面。一方面,作为植物的“第二基因组库”,根际微生物的活动和代谢对植物的生长发育、生物和非生物胁迫抗性具有一定的调节作用。研究表明,植物根际微生物可以通过调节植物的根型[1]、改变土壤特性[2-3]、降解有机物质[3]、降解或者消除有毒物质[4-5]、参与碳氮磷等营养元素的循环[6-10]、抑制有害微生物[11]等影响植物的生长。另一方面,植物通过根系分泌物的输出直接或者间接影响根际微生物的群落结构,大量土壤微生物在植物根际富集,并受到根系分泌物的选择性促进或者抑制[12-16]。根际微生物群落的物种和功能多样性受到多种因素的影响,如植物品种、发育时期、生长环境等。根际微生物结构和功能的多样性是衡量植物健康状况的重要指标。
棉花是一种重要的经济作物,棉籽、茎秆,特别是棉纤维是多种生产加工行业的重要原料。棉花种植过程中因连作或气候异常导致的土传病高发是导致棉花减产的重要原因。了解连作土壤中棉花根际微生物群落结构的动态变化,可为人工干预调整棉花根际土壤微生物群落结构,从而调整棉花的生理周期,降低棉花土传病发病率,避免不利气候因素导致的减产提供理论基础。本文基于二代测序技术和生物信息学分析对棉花不同发育时期的根际细菌和真菌群落结构进行研究,以期找出棉花根际微生物群落结构和功能在不同发育时期的变化规律,揭示棉花各发育时期的根际微生物群落结构特点。
1 材料与方法
1.1 试验材料
试验材料选用陆地棉遗传标准系TM-1和海岛棉Hai7124,由南京农业大学作物遗传与种质创新国家重点实验室张天真教授提供。营养土购自济南峰园科技有限公司,理化性质如下:pH值4.87±0.09,有机质(44.62±3.57)g·kg-1,水解性氮(1.39±0.17)g·kg-1,有效磷(188.37±15.68)mg·kg-1,速效钾(1.67±0.02)g·kg-1,交换性钙(2.58±0.15)g·kg-1,交换性镁(0.69±0.01)g·kg-1,交换性钠(185.33±3.51)mg·kg-1,有效铜(2.87±0.40)mg·kg-1,有效锌(5.01±0.98)mg·kg-1,有效铁(1.20±0.05)g·kg-1,有效锰(222.64±35.34)mg·kg-1。
1.2 棉花种植与取样
棉花种子经浓硫酸脱绒后用活水冲洗5 min,用10%过氧化氢浸泡1 h,然后用灭菌水反复冲洗3~5次。将种子移至铺有灭菌湿润滤纸的培养皿中,28 ℃避光培养12~24 h。种子萌发后,播种到装有营养土的花盆中,于组培室28 ℃条件下育苗。待幼苗长至15 cm左右,转移到预先消毒过的温室中培养。温室为普通塑料大棚日光温室,培养时间为5月中旬—7月上旬,利用空调将最高温度控制在35 ℃以内。每3 d浇一次灭菌水,幼苗期每次每盆浇500 mL,蕾期和花期每次每盆浇1 000 mL。
分别在幼苗期、蕾期、花期取棉花根际土。取样方法为:将花盆倒扣,倒出土后轻轻抖动,抖落多余的土壤,留下附着在根表面1 mm左右的根际土。将根放于装有灭菌水的50 mL离心管中,用灭菌水反复冲洗得到根际土悬液。将根际土悬液以10 000 r·min-1的速度离心15 min,倒掉上清液,取沉淀用液氮速冻,-80 ℃冷冻备用。在根际土取样的同时,分别取各时期不种植棉花花盆中的土壤作为相应时期的对照土,距土表6~15 cm位置取样。每个处理3个重复。
1.3 DNA提取与测序分析
1.3.1 DNA提取
采用Omega D5625-02土壤DNA提取试剂盒提取各土壤样品DNA。用荧光定量仪(美国Life Qubit 3.0)和琼脂糖凝胶电泳对DNA浓度和完整性进行检测,检测合格后用于后续建库测序。
1.3.2 测序分析
土壤DNA样品检测合格后,由深圳华大基因科技服务有限公司分别对细菌16S rDNA V4区和真菌ITS1区进行扩增子建库并测序,测序平台为Illumina MiSeq platform (Illumina, San Diego, CA, USA)。
下机数据通过QIIME软件进行过滤,去除低质量的测序片断(reads),得到有效测序片断(clean reads),使用FLASH(Fast Length Adjustment of Short Reads)v1.2.11软件对过滤得到的clean reads进行拼接,将有重叠区域的reads组装成一条序列(最小匹配长度15 bp,且重叠区域允许错配率为0.1)。利用UPARSE软件在97%相似度下对所得到的标签(tags)进行聚类,得到运算分类单元(operational taxonomic units, OUT)代表序列,并利用UCHIME v4.2.40软件将PCR扩增产生的嵌合体从OTU代表序列(16S嵌合体数据库,gold database v20110519;ITS嵌合体数据库,UNITE v20140703)中去除。通过RDP classifer v2.2软件将OTU代表序列与Greengene(16S)和UNITE(ITS)数据库进行比对,做物种注释,置信度阈值为0.5。
根据OTU在每个样品的丰度文件,计算每个样品或组别具有的OTU(不考虑OTU丰度,只考虑OTU有无),通过Venny2.1平台(http://bioinfogp.cnb.csic.es/tools/venny/index.html)做出Venn图,并找出样品间或组间共有与特有的OTU。
α多样性用ACE指数和Simpson指数表示,通过Mothur v1.31.2软件计算样品的α多样性值,计算公式参见http://www.mothur.orgwikiCalculators,并基于所得数据做出相应的稀释曲线图。其中,ACE指数反映样品中群落的物种丰富度;Simpson指数反映群落的多样性,受样品群落中物种丰富度和物种均匀度的影响。
β多样性通过QIIME v1.80软件计算。首先,对每个样品的序列数进行统一:每个样品按所有样品中序列数最少的样品的序列数随机抽取序列,生成新的OTU table biom文件。使用统一处理后的文件,用Bray-Curtis指数、UniFrac指数来衡量样品的β多样性。Bray-Curtis指数在计算时不考虑序列间的进化距离,只考虑样品中的物种存在情况,值越大表示样品间的差异越大。UniFrac指数利用系统进化的信息来比较样品间的物种群落差异,考虑序列间的进化距离,与样品间的差异呈正相关。
2 结果与分析
2.1 测序结果
分别对陆地棉TM-1和海岛棉Hai7124的3个发育时期的根际和对照土细菌16S rDNA V4区和真菌ITS1区进行扩增子测序。16S rDNA V4区扩增子测序共得到2 985 104对reads,过滤后的clean reads数为2 776 140对,拼接后共得到2 759 736个tags,拼接后的tags经过优化后在97%的相似度下聚类为12 384个用于物种分类的OTUs,平均每个样品(2 880±1 708)个。真菌ITS1区扩增子测序共得到1 312 315对reads,过滤后的clean reads数为1 061 184对,拼接后共得到894 048个tags,拼接后的tags经过优化后在97%的相似度下聚类为991个用于物种分类的OTUs,平均每个样品(158±38)个。由图1可以看出,各样品的稀释曲线已趋于平缓,说明测序深度已足够,基本覆盖样品中的所有物种。
2.2 棉花根际细菌群落结构在不同发育时期的动态变化
对不同发育时期根际和对照土的细菌OTU数量进行分析发现,棉花根际细菌OTU数量(1 700±656)极显著(P<0.01)低于对照土(5 127±156)。不同发育时期对照土壤中细菌OTU数量没有显著差异,而根际土壤中细菌OTU数量在不同发育时期存在显著变化,蕾期的OTU总数(2 528±327)显著(P<0.05)高于苗期(1 251±527)和花期(1 488±75)。
定义2 一个离散时间马尔科夫链(Discrete-Time Markov Chain,DTMC)是一个四元组C=(S,P,ιinit,L).其中:
使用ACE指数和Simpson指数对棉花不同发育时期的根际细菌α多样性进行分析。如图2所示,不同发育时期对照土细菌群落ACE指数没有显著差异,且对照土细菌群落ACE指数极显著(P<0.01)大于根际。不同发育时期的根际细菌群落ACE指数存在显著差异:蕾期(3 083±278)极显著(P<0.01)高于苗期(1 423±299)和花期(1 877±110)。不同棉花品种的根际细菌ACE指数没有显著差异。

A,细菌ACE指数;B,细菌Simpson指数;C,真菌ACE指数;D,真菌Simpson指数。图例中:S,苗期;B,蕾期;F,花期;T,陆地棉TM-1;H,海岛棉Hai7124;C,对照土。图例中字母后方的数字表示重复。下同。A, ACE index of bacteria; B: Simpson index of bacterial; C, ACE index of fungal; D, Simpson index of fungal. In legends: S, Seedling sage; B, Budding stage; F, Flowering stage; T, TM-1; H, Hai7124; C, Control. The numbers in legends represented replicates. The same as below.图1 棉花根际和对照土测序结果Fig.1 Sequencing result of rhizosphere and control soil samples

图2 两个棉花品种不同发育时期根际和对照土细菌群落ACE指数和Simpson指数Fig.2 ACE and Simpson index of rhizosphere and control soil bacterial community in different growth stages of two cotton cultivars
各时期根际细菌Simpson指数均显著(P<0.05)大于相应对照土。不同发育时期对照土细菌群落间的Simpson指数无显著差异,但根际细菌群落Simpson指数间存在显著差异:蕾期(0.002 5±0.000 1)显著(P<0.05)小于花期(0.002 8±0.000 4)和苗期(0.003 7±0.002 0)。两种棉花品种的根际细菌Simpson指数在苗期和花期存在显著差异(P<0.05),均表现为海岛棉大于陆地棉。
使用Bray-Curtis、UniFrac指数对棉花不同发育时期根际与对照土的细菌群落β多样性进行统计分析。Bray-Curtis指数分析表明,根际与对照土的细菌群落Bray-Curtis指数在蕾期(TM-1,0.95±0.01;Hai7124,0.95±0.01)极显著(P<0.01)小于苗期(TM-1,0.97±0.02;Hai7124,0.99±0.01)和花期(TM-1,0.98±0.01;Hai7124,0.97±0.01)。陆地棉苗期与蕾期的Bray-Curtis指数(0.47±0.11)显著(P<0.05)低于蕾期与花期的Bray-Curtis指数(0.55±0.08),而海岛棉苗期与蕾期的Bray-Curtis指数(0.57±0.10)和蕾期与花期的Bray-Curtis指数(0.52±0.09)之间无显著差异。UniFrac指数分析表明,根际与对照土细菌群落之间的UniFrac指数在蕾期(TM-1,0.80±0.01;Hai7124,0.81±0.01)极显著(P<0.01)小于苗期(TM-1,0.86±0.05;Hai7124,0.87±0.03)和花期(TM-1,0.86±0.01;Hai7124,0.84±0.02)。陆地棉苗期与蕾期的UniFrac指数和蕾期与花期的UniFrac指数无显著差异,但海岛棉苗期与蕾期的UniFrac指数(0.64±0.05)极显著(P<0.01)高于蕾期与花期的UniFrac指数(0.58±0.03)。
对OTU进行聚类分析,得到不同发育时期棉花根际和对照土的细菌群落结构组成(图3)。变形菌门(Proteobacteria)在根际土壤细菌群落中的相对丰富最高,为47.37%~63.00%,其次为酸杆菌门(Acidobacteria)(5.74%~12.38%)、厚壁菌门(Firmicutes)(1.82%~11.03%)、蓝细菌门(Cyanobacteria)(2.60%~6.14%)、放线菌门(Actinobacteria)(2.47%~6.35%)、浮霉菌门(Planctomycetes)(4.11%~6.59%)、拟杆菌门(Bacteroidetes)(4.04%~6.97%)、疣微菌门(Verrucomicrobia)(1.72%~6.36%)等。与对照土相比,根际土中各菌门的相对丰度受到不同的影响,且不同发育时期相对丰度显著变化的菌门存在差异(表1)。

图3 棉花根际和对照土壤中细菌群落结构组成(门水平)Fig.3 Bacterial community structure of cotton rhizosphere and control soil in phylum level
表1 不同时期在陆地棉和海岛棉根际土中相对丰度与对照土有显著(P著(P < 0. 05) 差异的细菌群落( 门水平)
Table 1 Bacterial communities with significantly (P< 0. 05) different relative abundance in upland cotton and island cotton rhizosphere and control soil in different growth stages in phylum level

差异方向Variation direction苗期Seedling stage蕾期Budding stage花期Flowering stage较对照土相对丰度升高Higher than incontrol soil Proteobacteria; ActinobacteriaProteobacteria; Firmicutes;Cyanobacteria; Bacteroidetes;ChlorobiProteobacteria; Cyanobacteria; Chlorobi较对照土相对丰度降低Lower than incontrol soilAcidobacteria; Armatimonadetes; BHI80-139; BRC1; Chloroflexi; Cre-narchaeota; Elusimicrobia; Euryarcha-eota; Fibrobacteres; Gemmatimonade-tes; GN02; Nitrospirae; NKB19; OP3; Parvarchaeota; Planctomycetes; SBR1093; Thermi; WS2; WS3AC1; Acidobacteria; Armatimonade-tes; BHI80-139; BRC1; Chloroflexi; Crenarchaeota; Elusimicrobia; Eur-yarchaeota; Fibrobacteres; GAL15; Gemmatimonadetes; GN02; Nitrospi-rae; NKB19; Parvarchaeota; Planc-tomycetes; SBR1093; WS3Acidobacteria; BHI80-139; BRC1; Cren-archaeota; Elusimicrobia; Euryarchaeota; Fibrobacteres; GAL15; Gemmatimonade-tes; GN02; Nitrospirae; NKB19; OD1; OP3; Parvarchaeota; Planctomycetes; SBR1093; WPS-2; WS2; WS3
2.3 棉花根际真菌群落结构在不同发育时期的动态变化
对不同发育时期根际和对照土的真菌OTU数量进行分析,发现棉花各发育时期根际真菌OTU数量(149±29)极显著(P<0.01)低于对照(186±18)。不同发育时期所取对照土中真菌OTU数量存在显著(P<0.05)变化:蕾期真菌OTU数量(205±7)大于苗期(184±11)和花期(169±8)。根际土壤中真菌OTU数量在不同发育时期也存在显著(P<0.05)变化:蕾期的OTU总数(178±16)高于苗期(125±30)和花期(144±6)。
使用ACE指数和Simpson指数对棉花不同发育时期的根际真菌α多样性进行统计分析(图4)。ACE指数分析表明,不同发育时期对照土真菌群落ACE指数存在显著差异(P<0.05),蕾期最高。对照土真菌群落ACE指数显著(P<0.05)大于根际。不同发育时期的根际真菌群落多样性分析表明,棉花根际真菌群落ACE指数在蕾期(192±17)显著(P<0.05)高于苗期(138±22)和花期(154±8)。不同棉花品种相同发育时
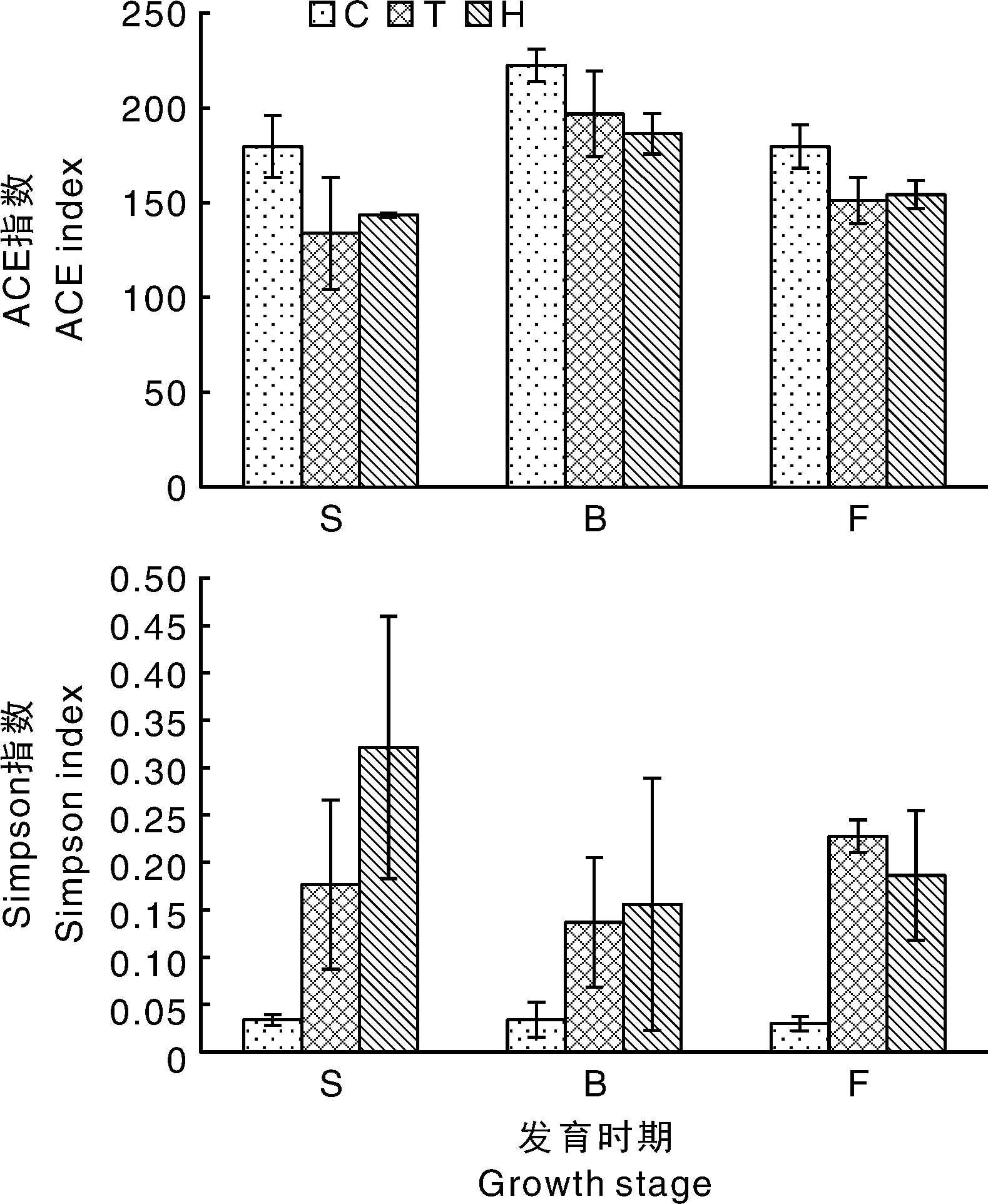
图4 两个棉花品种不同发育时期根际和对照土的真菌群落ACE指数和Simpson指数Fig.4 ACE and Simpson index of rhizosphere and control soil bacterial community in different growth stages of two cotton cultivars
期的ACE指数间没有显著差异。不同发育时期的根际和对照土真菌群落Simpson指数分析表明,不同发育时期的对照土或根际土真菌群落Simpson指数间无显著差异,各时期根际真菌Simpson指数均显著(P<0.05)大于对应对照土。
分别使用Bray-Curtis和UniFrac指数对棉花不同发育时期的根际真菌群落和根际与对照土间的β多样性进行统计分析。Bray-Curtis指数分析表明,陆地棉根际与对照土真菌群落间的Bray-Curtis指数在不同发育时期间无显著差异,而海岛棉根际与对照土真菌群落间的Bray-Curtis指数在蕾期(0.98±0.01)显著(P<0.05)大于花期(0.97±0.01)。UniFrac指数分析表明,海岛棉根际与对照土真菌群落间的UniFrac指数由苗期(0.87±0.03)、蕾期(0.76±0.01)到花期(0.71±0.01)极显著(P<0.01)降低。另外,海岛棉苗期与蕾期的UniFrac指数(0.66±0.06)显著(P<0.05)大于蕾期与花期的UniFrac指数(0.63±0.02)。
2.4 发育时期对棉花根际细菌和真菌菌属的影响
对不同发育时期棉花根际和对照土中细菌和真菌的群落组成在属水平上进行分析和比较,得到差异显著的菌属(表2~3)。其中,Burkholderia、Bradyrhizobium、Bdellovibrio等10个细菌菌属在3个发育时期根际土中的相对丰度均显著(P<0.05)高于对照土,Sinorhizobium、Novosphingobium、Lysobacter、Nitrospira、Planctomyces、Candidatus_Nitrososphaera等13个细菌菌属和Retroconis、Gliomastix、Mortierella等5个真菌菌属在3个发育时期根际土中的相对丰度均显著(P<0.05)
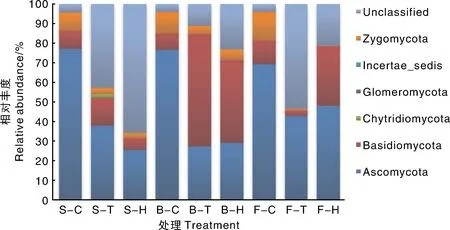
图5 棉花根际和对照土壤中真菌群落结构组成(门水平)Fig.5 Fungal community structure of cotton rhizosphere and control soil in phylum level
低于对照土。只在棉花苗期和蕾期根际土壤中相对丰度显著显著(P<0.05)高于对照土的有Mesorhizobium、Arthrobacter、Dyella等4个细菌菌属和Fusarium、Guehomyces两个真菌菌属,显著(P<0.05)低于对照土的有1个细菌菌属(OR-59)和Gibberella、Verticillium两个真菌均属。只在棉花蕾期和花期根际土壤中相对丰度显著(P<0.05)高于对照土的有Aquicella、Legionella、Phenylobacterium等4个细菌菌属和Rhodosporidium、Sakaguchia两个真菌菌属,显著低于对照土的有Pseudoxanthomonas、Paenibacillus两个细菌菌属和Rhodotorula、Engyodontium两个真菌菌属。此外,每个时期的根际土壤中都有其特有的与对照土相比相对丰度显著(P<0.05)升高或降低的菌属,详见图6。
3 讨论
根系能够通过改变土壤特性,如保水性[16]、酸碱度[17]、营养物质[18-19]等条件形成特定的土壤环境,从而间接导致其对特定微生物选择性的促进或者抑制作用。另外,植物还可以通过向土壤环境释放根系分泌物,如挥发性物质、边缘细胞、高分子聚合物等直接影响根际微生物群落结构,选择性地促进或者抑制特定土壤微生物的生长和繁殖[14,20-22],而且同种植物不同发育时期的根系分泌物种类和性质存在差异[15]。本研究表明,与对照土相比,根际细菌和真菌的OTU总数和物种多样性显著降低,说明棉花根系会抑制土壤中特定真菌和细菌的繁殖,受抑制菌群的丰度降低甚至消失,使棉花根际真菌和细菌的丰富度降低。在根际土中,细菌和真菌的物种多样性在蕾期显著高于苗期和花期,推测可能是因为受到棉花蕾期根系分泌物中某些特有成分的促进作用而致。
表2 不同时期在陆地棉和海岛棉根际土中相对丰度与对照土有显著(P< 0. 05) 差异的细菌群落( 属水平)
Table 2 Bacterial communities with significantly (P< 0. 05) different relative abundance in upland cotton and island cotton rhizosphere and control soil in different growth stages in genus level
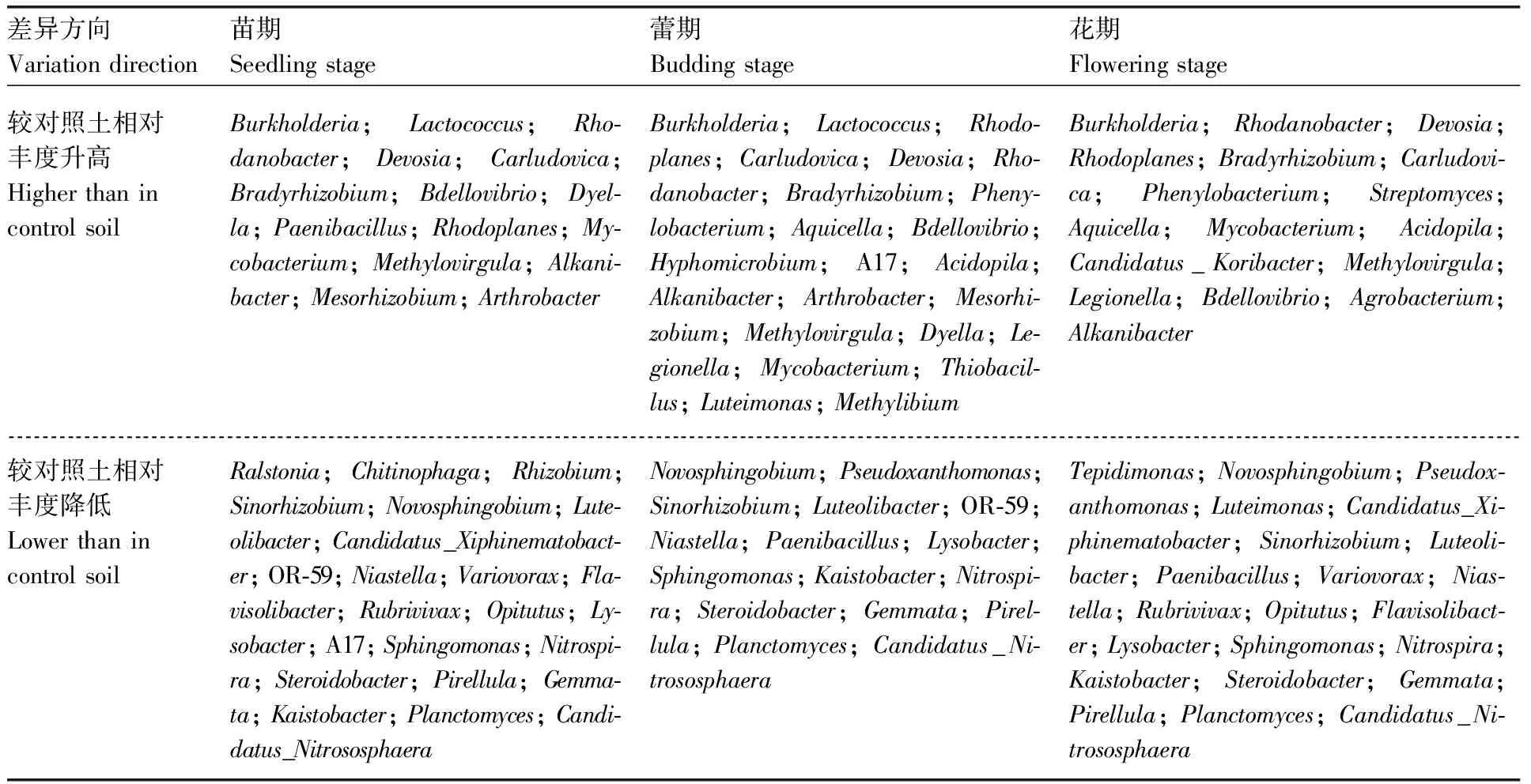
差异方向Variation direction苗期Seedling stage蕾期Budding stage花期Flowering stage较对照土相对丰度升高Higher than incontrol soilBurkholderia; Lactococcus; Rho-danobacter; Devosia; Carludovica; Bradyrhizobium; Bdellovibrio; Dyel-la; Paenibacillus; Rhodoplanes; My-cobacterium; Methylovirgula; Alkani-bacter; Mesorhizobium; ArthrobacterBurkholderia; Lactococcus; Rhodo-planes; Carludovica; Devosia; Rho-danobacter; Bradyrhizobium; Pheny-lobacterium; Aquicella; Bdellovibrio; Hyphomicrobium; A17; Acidopila; Alkanibacter; Arthrobacter; Mesorhi-zobium; Methylovirgula; Dyella; Le-gionella; Mycobacterium; Thiobacil-lus; Luteimonas; MethylibiumBurkholderia; Rhodanobacter; Devosia; Rhodoplanes; Bradyrhizobium; Carludovi-ca; Phenylobacterium; Streptomyces; Aquicella; Mycobacterium; Acidopila; Candidatus_Koribacter; Methylovirgula; Legionella; Bdellovibrio; Agrobacterium; Alkanibacter 较对照土相对丰度降低Lower than incontrol soilRalstonia; Chitinophaga; Rhizobium; Sinorhizobium; Novosphingobium; Lute-olibacter; Candidatus_Xiphinematobact-er; OR-59; Niastella; Variovorax; Fla-visolibacter; Rubrivivax; Opitutus; Ly-sobacter; A17; Sphingomonas; Nitrospi-ra; Steroidobacter; Pirellula; Gemma-ta; Kaistobacter; Planctomyces; Candi-datus_NitrososphaeraNovosphingobium; Pseudoxanthomonas; Sinorhizobium; Luteolibacter; OR-59; Niastella; Paenibacillus; Lysobacter; Sphingomonas; Kaistobacter; Nitrospi-ra; Steroidobacter; Gemmata; Pirel-lula; Planctomyces; Candidatus_Ni-trososphaeraTepidimonas; Novosphingobium; Pseudox-anthomonas; Luteimonas; Candidatus_Xi-phinematobacter; Sinorhizobium; Luteoli-bacter; Paenibacillus; Variovorax; Nias-tella; Rubrivivax; Opitutus; Flavisolibact-er; Lysobacter; Sphingomonas; Nitrospira; Kaistobacter; Steroidobacter; Gemmata; Pirellula; Planctomyces; Candidatus_Ni-trososphaera
表3 不同时期在陆地棉和海岛棉根际土中相对丰度与对照土有显著(P< 0. 05) 差异的真菌群落( 属水平)
Table 3 Fungal communities with significantly (P< 0. 05) different relative abundance in upland cotton and island cotton rhizosphere and control soil in different growth stages in genus level

差异方向Variation direction苗期Seedling stage蕾期Budding stage花期Flowering stage较对照土相对丰度升高Higher than incontrol soil Fusarium; Guehomyces; Rhodotorula; Pseudeurotium Panaeolus; Fusarium; Rhodosporidi-um; Trichoderma; Guehomyces; Chaetomium; Emericella; Mrakia; Kurtzmanomyces; SakaguchiaTalaromyces; Rhodosporidium; Lecanicil-lium; Sakaguchia较对照土相对丰度降低Lower than incontrol soilCeratobasidium; Wardomyces; Campylo-carpon; Stephanonectria; Simplicillium; Acremonium; Aspergillus; Stachybotrys; Gibberella; Metarhizium; Verticillium; Retroconis; Gliomastix; MortierellaRhodotorula; Cochliobolus; Zopfiella; Campylocarpon; Gibberella; Humico-la; Wardomyces; Verticillium; Retro-conis; Gliomastix; Engyodontium; Penicillium; MortierellaTetracladium; Campylocarpon; Rhodotoru-la; Tremellodendron; Wardomyces; Crypto-coccus; Retroconis; Engyodontium; Glio-mastix; Mortierella

绿色代表苗期,红色代表蕾期,橙色代表花期。Green circles represented seedling stage; red circle represented budding stage; orange circle represented flowering stage.图6 不同发育时期特有的根际土壤中与对照土相比相对丰度显著升高(A、C)或降低(B、D)的细菌(A、B)和真菌(C、D)菌属及其数量Fig.6 Bacteria (A, B) and fungi (C, D) with significantly higher (A, C) or lower (B, D) relative abundance in rhizosphere soils than in control soil at different growth stages
大量研究表明,同种植物不同品种的根际微生物在数量和组成方面存在一定差异[23-25]。本研究表明,海岛棉和陆地棉不同发育时期根际细菌群落结构变化特征存在差异:海岛棉根际细菌Simpson指数在苗期和花期显著大于陆地棉,但ACE指数没有显著差异,说明陆地棉和海岛棉在苗期和花期的根际细菌物种丰富度无差异,而均匀度陆地棉大于海岛棉,推测可能是因为海岛棉根际细菌中的某些菌群在苗期和花期受到了特异性的促进或者抑制作用,这部分受到促进或者抑制的菌群可能与海岛棉某些功能或者特性相关;陆地棉苗期与蕾期的Bray-Curtis指数显著低于蕾期与花期的Bray-Curtis指数,但UniFrac指数无显著差异,说明虽然陆地棉蕾期与花期的根际细菌群落物种组成差别较大,但是造成其差异的菌种进化距离较近;海岛棉苗期与蕾期的Bray-Curtis指数和蕾期与花期的Bray-Curtis指数之间无显著差异,UniFrac指数极显著降低,说明导致海岛棉苗期和蕾期根际细菌群落差异的菌种之间进化距离更远。综上所述,棉花苗期与蕾期的根际细菌群落差异菌群进化距离较远,推测海岛棉苗期和蕾期的根际细菌群落功能差异更大,因蕾期α多样性更高,推测蕾期根际细菌的功能更多。
棉花根际真菌群落结构分析结果表明,不同发育时期对照土真菌群落受外界环境的影响显著,因此在对根际真菌群落进行分析时,必须考虑因土壤自身条件改变而导致的真菌群落结构变化。棉花不同发育时期根际真菌群落α多样性分析结果表明,蕾期虽然根际真菌物种丰富度最高,但是均匀度较低,推测棉花根际真菌中特定菌群受到了特异性的促进或抑制,这部分菌群可能与棉花蕾期某些功能或特性相关。棉花根际与对照土的β多样性分析结果表明,3个时期根际与对照土真菌之间差异物种的数量没有显著差异,但是蕾期差异物种的进化距离较近。综上所述,推测棉花根际真菌在蕾期受到促进的菌群为进化距离较近的特定分类菌群。
已有研究表明,Proteobacteria、Acidobacteria、Planctomycetes、Bacteroidetes为棉花根际细菌群落相对丰度较高的优势菌门[26-27]。陆地棉和海岛棉根际细菌群落中各发育时期Proteobacteria、Acidobacteria、Firmicutes、Cyanobacteria、Actinobacteria、Planctomycetes、Bacteroidetes和Verrucomicrobia为相对丰度最高的8个优势菌门,约占棉花根际细菌群落相对丰度的71.29%~91.50%。Proteobacteria在根际的相对丰度在3个发育时期都高于对照土。BRC1、Crenarchaeota、Elusimicrobia等菌门在根际的相对丰度在3个发育时期都显著低于对照土。不同发育时期根际细菌与对照土相比相对丰度显著升高的菌门在各发育时期存在差异,除了共有菌门之外,每个发育时期还有其特有菌门,如Actinobacteria在苗期,Cyanobacteria、Bacteroidetes等在蕾期,Cyanobacteria、Chlorobi在花期的相对丰度在根际土中显著大于对照土,而Thermi在苗期,AC1在蕾期,OD1、WPS-2在花期的相对丰度在根际土中显著低于对照土。根际真菌群落中除了Unclassified(未分类)之外,相对丰度最高的菌门为Ascomycota,其次为Basidiomycota和Zygomycota,三者合为陆地棉和海岛棉根际真菌的3大主导菌门。进一步分析表明,Rhodanobacter、Devosia、Bradyrhizobium、Bdellovibrio等与有机物质降解、物质循环、生物防治等相关的菌属在棉花根际各发育时期的相对丰度都显著大于对照土,而Novosphingobium、Sphingomonas、Nitrospira等与解磷、硝化和致病等相关的菌属在棉花根际各发育时期的相对丰度则都显著低于对照土。此外,对各发育时期受到显著促进和抑制作用的菌属进行分析表明,蕾期相对丰度在根际土中大于对照土的菌属比其他2个时期要多,其中,Hyphomicrobium与有机物质的降解和反硝化功能相关[28],Thiobacillus在好养条件下有反硝化特性并与硫循环和吸收相关[29],Methylibium与尿素等有机物质的降解有关[30],Trichoderma有生物防治功能并与植物的生长发育和营养物质的吸收相关[31],Chaetomium为生物防治、抗旱、氮磷钾吸收相关菌属[32-35],推测这些菌属的富集与蕾期棉花的生长发育特性相关。
总的来看,棉花对土壤微生物群落具有一定的选择作用,其根际微生物群落结构具有一定的稳定性,不同发育时期的优势菌门相同,细菌为Proteobacteria、Acidobacteria、Firmicutes、Cyanobacteria、Actinobacteria、Planctomycetes、Bacteroidetes和Verrucomicrobia,真菌为Ascomycota、Basidiomycota和Zygomycota。不同发育时期根际微生物群落结构存在显著差异,蕾期与其他2个时期的差异最为明显,大量的与物质循环、营养物质吸收和生物防治相关的功能菌属在蕾期相对丰度增加,这些菌群与棉花的相互作用有待进一步研究。
